高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
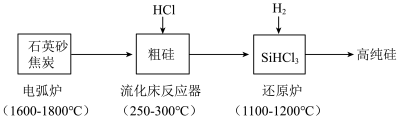
(1)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为___________ 。当有 参与反应时,该反应转移的电子数是
参与反应时,该反应转移的电子数是___________ 。
(2)还原炉中发生的化学反应方程式为___________ 。
(3)上述工艺生产中循环使用的物质除 、
、 外,还有
外,还有___________ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为___________ 。
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶(H2SiO3),进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:___________ 。
(6)关于硅及其相关化合物的叙述正确的是___________ (填字母)。
A.自然界中存在天然游离的硅单质
B.已知C与 的最高正价都是正四价,由于
的最高正价都是正四价,由于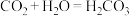 ,用类比法得知,
,用类比法得知,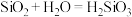
C.硅酸是一种比碳酸还弱的酸
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E. 既能和
既能和 溶液反应,又能和氢氟酸反应,所以是两性氧化物
溶液反应,又能和氢氟酸反应,所以是两性氧化物
F.硅是组成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位

(1)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为
 参与反应时,该反应转移的电子数是
参与反应时,该反应转移的电子数是(2)还原炉中发生的化学反应方程式为
(3)上述工艺生产中循环使用的物质除
 、
、 外,还有
外,还有(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶(H2SiO3),进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(6)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与
 的最高正价都是正四价,由于
的最高正价都是正四价,由于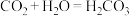 ,用类比法得知,
,用类比法得知,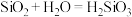
C.硅酸是一种比碳酸还弱的酸
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E.
 既能和
既能和 溶液反应,又能和氢氟酸反应,所以是两性氧化物
溶液反应,又能和氢氟酸反应,所以是两性氧化物F.硅是组成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
更新时间:2024-04-02 06:21:23
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:

石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________ (填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________ 。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。

①装置B中的试剂是___________ 。装置C中的烧瓶需要加热,其目的是_________________ 。
②反应一段时间后,装置D中观察到的现象是______________________ ;装置D中发生反应的化学方程式为___________________________________ 。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______ (填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
(1)工业上生产纯硅的工艺流程如下:

石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。

①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:

石英砂的主要成分是 ,在制备粗硅时反应的氧化产物为
,在制备粗硅时反应的氧化产物为___________ (填化学式);在该反应中,若消耗了3.6 g  ,则转移电子的总数为
,则转移电子的总数为___________ (用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
(2)某实验室利用 (沸点33.0℃)与过量
(沸点33.0℃)与过量 在1000℃~1100℃反应制得纯硅(灰黑色固体)。已知
在1000℃~1100℃反应制得纯硅(灰黑色固体)。已知 能与
能与 强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
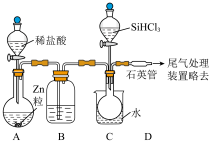
①装置B中的试剂是___________ 。装置C中水的作用是___________ 。
②反应一段时间后,装置D中观察到的现象是___________ ;装置D中发生反应的化学方程式为___________ 。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有___________ (填字母)。
a. b.氯水 c.
b.氯水 c. 溶液 d.KSCN溶液
溶液 d.KSCN溶液
(1)工业上生产纯硅的工艺流程如下:

石英砂的主要成分是
 ,在制备粗硅时反应的氧化产物为
,在制备粗硅时反应的氧化产物为 ,则转移电子的总数为
,则转移电子的总数为 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。(2)某实验室利用
 (沸点33.0℃)与过量
(沸点33.0℃)与过量 在1000℃~1100℃反应制得纯硅(灰黑色固体)。已知
在1000℃~1100℃反应制得纯硅(灰黑色固体)。已知 能与
能与 强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有
a.
 b.氯水 c.
b.氯水 c. 溶液 d.KSCN溶液
溶液 d.KSCN溶液
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)⇌Si(s)+2CO(g)
②Si(s)+2Cl2(g)⇌SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______ 种自旋方向;SiO2晶体中每个硅原子与______ 个氧原子直接相连.
(2)单质的还原性:碳______ 硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______ .
(3)反应②生成的化合物分子空间构型为;该分子为______ 分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______ b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______ (用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)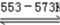 SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______ 、______ .
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)⇌Si(s)+2CO(g)
②Si(s)+2Cl2(g)⇌SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有
(2)单质的还原性:碳
(3)反应②生成的化合物分子空间构型为;该分子为
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a
(5)在t秒内,反应②中反应速率v(SiCl4)=
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)
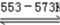 SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)⑤SiHCl3(g)+H2(g)
 Si(纯)+3HCl(g)
Si(纯)+3HCl(g)提高反应⑤中Si(纯)的产率,可采取的措施有:
您最近一年使用:0次



