名校
1 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。 (
( 或
或 )的萃取原理:
)的萃取原理: 。
。
回答下列问题:
(1)“高温氢化”时 不参与反应,固体产物为
不参与反应,固体产物为 、
、 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为________ ,实际生产中少量的 与空气接触会转化为
与空气接触会转化为________ ,所以为降低锂在固体残余物中的含量应用 “酸洗”。
“酸洗”。
(2)若“洗液”中 ,加入
,加入 固体后,为使沉淀
固体后,为使沉淀 中
中 元素含量不小于
元素含量不小于 元素总量的95%,则
元素总量的95%,则 “洗液”中至少需要加入
“洗液”中至少需要加入 的物质的量为
的物质的量为________  [忽略溶液体积变化,
[忽略溶液体积变化, ]。
]。
(3)“沉锰”过程中 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。 的离子方程式为
的离子方程式为________________ 。
②该工艺条件下, 开始沉淀的
开始沉淀的 为2,
为2, 开始沉淀的
开始沉淀的 为3。“沉锰”过程中应选择的最佳
为3。“沉锰”过程中应选择的最佳 为
为________ , 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是________ 。
(4)“反萃取”的目的是将有机层中 、
、 转移到水层,为使
转移到水层,为使 、
、 尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有________ 。
 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
 (
( 或
或 )的萃取原理:
)的萃取原理: 。
。回答下列问题:
(1)“高温氢化”时
 不参与反应,固体产物为
不参与反应,固体产物为 、
、 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 与空气接触会转化为
与空气接触会转化为 “酸洗”。
“酸洗”。(2)若“洗液”中
 ,加入
,加入 固体后,为使沉淀
固体后,为使沉淀 中
中 元素含量不小于
元素含量不小于 元素总量的95%,则
元素总量的95%,则 “洗液”中至少需要加入
“洗液”中至少需要加入 的物质的量为
的物质的量为 [忽略溶液体积变化,
[忽略溶液体积变化, ]。
]。(3)“沉锰”过程中
 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。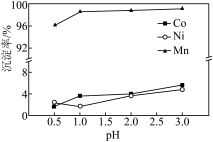
 的离子方程式为
的离子方程式为②该工艺条件下,
 开始沉淀的
开始沉淀的 为2,
为2, 开始沉淀的
开始沉淀的 为3。“沉锰”过程中应选择的最佳
为3。“沉锰”过程中应选择的最佳 为
为 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是(4)“反萃取”的目的是将有机层中
 、
、 转移到水层,为使
转移到水层,为使 、
、 尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
您最近一年使用:0次
2 . 某研究性学习小组为探究含 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。
已知:ⅰ. 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;
ⅱ.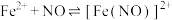 (棕色)。
(棕色)。
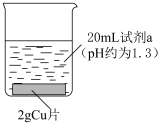
(1)Ⅰ、Ⅱ、Ⅲ溶液 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因________ 。
(2)小组同学取 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴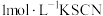 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向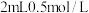
________ (填化学式)和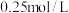
________ 的混合溶液中,加入2滴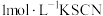 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的________ 。
(3)实验Ⅱ中 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为________ ,白色固体消失的离子方程式为________ ,由此对比实验Ⅰ和实验Ⅱ,推测 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是________ 。产生大量红褐色沉淀的原因是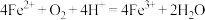 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。
(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了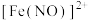 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。
综合以上实验, 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。实验装置 | 序号 | 试剂 | 实验现象 |
| Ⅰ | 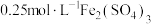 溶液 溶液 | 溶液逐渐变为蓝色。2天后, 片有较大量剩余,溶液仍为蓝色 片有较大量剩余,溶液仍为蓝色 |
Ⅱ | 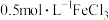 溶液 溶液 | 溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为 )。2天后,白色固体消失, )。2天后,白色固体消失, 片无剩余,溶液中产生大量红褐色沉淀 片无剩余,溶液中产生大量红褐色沉淀 | |
Ⅲ | 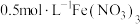 溶液 溶液 | 溶液逐渐变为绿色,实验过程中未见气泡产生。2天后, 片少量剩余,溶液中产生大量红褐色沉淀 片少量剩余,溶液中产生大量红褐色沉淀 |
 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;ⅱ.
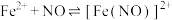 (棕色)。
(棕色)。(1)Ⅰ、Ⅱ、Ⅲ溶液
 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因(2)小组同学取
 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴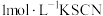 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向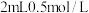
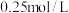
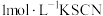 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的(3)实验Ⅱ中
 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是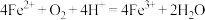 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了
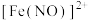 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。步骤 | 实验操作 | 实验现象 |
① | 向盛有 金属 金属 片的烧杯中加入 片的烧杯中加入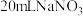 与 与 的混合溶液[ 的混合溶液[ 与约为1.3、 与约为1.3、 ] ] | 2天后溶液颜色无明显变化,铜片表面有细小气泡附着 |
② | 继续加入少量 | 溶液迅速变为浅棕色 |
 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
您最近一年使用:0次
解题方法
3 . 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图所示的实验。请据此回答下列问题。___________ 。
(2)浓硫酸和木炭粉发生的反应化学方程式___________ 。
(3)装置A中出现___________ 现象,证明气体产物中有 。
。
(4)为验证产物中是否含有 ,该同学思考如下:
,该同学思考如下:
①装置可证明产物中有 生成,现象是
生成,现象是___________ 。
②该同学认为,如果去掉装置B也能实现产物 的验证,该同学依据的实验现象是
的验证,该同学依据的实验现象是___________ 。
③在不影响实验检验结果的情况下,理论上以下试剂中可以用来代替装置B中的品红溶液的有___________ (填序号)。
a. 溶液 b.饱和
溶液 b.饱和 溶液 c.氯水 d.
溶液 c.氯水 d. 溶液
溶液
(5)D装置的作用是___________ 。

(2)浓硫酸和木炭粉发生的反应化学方程式
(3)装置A中出现
 。
。(4)为验证产物中是否含有
 ,该同学思考如下:
,该同学思考如下:①装置可证明产物中有
 生成,现象是
生成,现象是②该同学认为,如果去掉装置B也能实现产物
 的验证,该同学依据的实验现象是
的验证,该同学依据的实验现象是③在不影响实验检验结果的情况下,理论上以下试剂中可以用来代替装置B中的品红溶液的有
a.
 溶液 b.饱和
溶液 b.饱和 溶液 c.氯水 d.
溶液 c.氯水 d. 溶液
溶液(5)D装置的作用是
您最近一年使用:0次
解题方法
4 . 四氯化锡( )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
回答下列问题:
(1)“仪器a”的名称是___________ ,A中反应的离子方程式为___________ 。
(2)实验前应进行的操作是___________ ,实验开始时,应先点燃___________ (填“A”或“D”)处的酒精灯。
(3)若无“洗气瓶B”,可能会导致的问题是___________ 。
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是___________ 。
(5)“洗气瓶F”中所盛放的药品是___________ 。
 )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。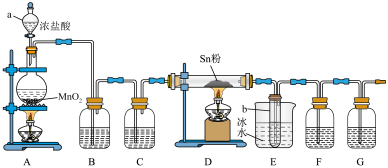
| 药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
| Sn | 银白色固体 | 231 | 2260 | 较活泼金属能与 、HCl等气体发生反应 、HCl等气体发生反应 |
 | 无色液体 | ﹣33 | 114 | 极易与水反应产生 溶胶 溶胶 |
(1)“仪器a”的名称是
(2)实验前应进行的操作是
(3)若无“洗气瓶B”,可能会导致的问题是
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是
(5)“洗气瓶F”中所盛放的药品是
您最近一年使用:0次
名校
5 . 香豆素类化合物是一类有机杂环化合物,一种香豆素衍生物的合成路线如下。
(1)G中除羟基和醚键外的含氧官能团为________ 。
(2)A→B的反应类型为________ 。
(3)B-C第一步的化学反应方程式为________ 。
(4)H-1的反应中加入 的作用是
的作用是________ 。
(5)F的同分异构体中,满足下列要求的有________ 种。
①含有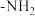 ;
;
②结构中含有六元环;
③1mol F与足量 反应,消耗2mol
反应,消耗2mol  。
。
其中核磁共振氢谱有6组峰,峰面积之比为4:2:2:2:2:1的结构简式为________ 。(写一种即可)
(6)以对甲基苯酚和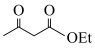 为原料,设计
为原料,设计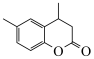 的合成路线
的合成路线_____ 。(其他无机试剂任选)
②
(1)G中除羟基和醚键外的含氧官能团为
(2)A→B的反应类型为
(3)B-C第一步的化学反应方程式为
(4)H-1的反应中加入
 的作用是
的作用是(5)F的同分异构体中,满足下列要求的有
①含有
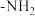 ;
;②结构中含有六元环;
③1mol F与足量
 反应,消耗2mol
反应,消耗2mol  。
。其中核磁共振氢谱有6组峰,峰面积之比为4:2:2:2:2:1的结构简式为
(6)以对甲基苯酚和
 为原料,设计
为原料,设计 的合成路线
的合成路线
您最近一年使用:0次
2024-05-30更新
|
271次组卷
|
3卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
名校
6 . 某研究小组试探究1,6-己二硫醇(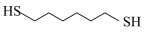 ,用HDT表示)与铜的反应历程。
,用HDT表示)与铜的反应历程。
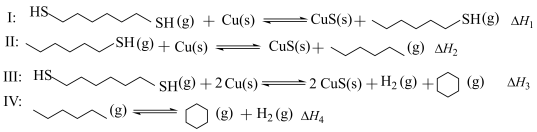
化学键 | C-H | C-C | H-H |
键能/ | 413 | 347 | 436 |
(2)温度一定时,在隔绝空气的条件下使HDT(g)以恒定的流速通过如甲图所示的反应器,仅发生反应Ⅰ、Ⅱ、Ⅲ,在反应器出口处实时检测各物质的相对含量如图乙所示。
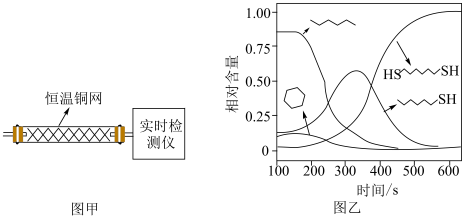
②推测
 在该实验条件下与Cu反应生成烃类产物的名称为
在该实验条件下与Cu反应生成烃类产物的名称为(3)向恒温刚性容器M中充入己烷(g)和HDT(g),初始总压为2.5Pa,己烷的体积分数为80%。容器M中只发生反应Ⅳ,达平衡时,己烷的转化率为50%,则反应Ⅳ的

(
 )
)
您最近一年使用:0次
2024-05-30更新
|
104次组卷
|
2卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
7 . 三氯甲苯(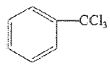 )可用于制取农药、染料等有机物,可利用甲苯的取代反应进行制备。
)可用于制取农药、染料等有机物,可利用甲苯的取代反应进行制备。
物质 | 熔点/℃ | 沸点/℃ | 密度/g· | 摩尔质量/g· |
甲苯 | -94.9 | 110.6 | 0.87 | 92 |
三氯甲苯 | -7.5 | 219.0 | 1.36 | 195.5 |
如图组装实验仪器,检验装置气密性后将138.0mL甲苯加入N中,__________,加热至100~110℃后通氯气反应1h。

(1)仪器N的名称是
(2)将甲苯加入三颈烧瓶后的操作是
(3)实验时,
(4)该实验采用
(5)反应结束后,混合溶液用
①蒸馏水 ②饱和
 溶液 ③饱和
溶液 ③饱和 溶液
溶液(6)粗产品经蒸馏后得138.0g三氯甲苯。该反应的产率最接近于
A.30% B.50% C.70%
您最近一年使用:0次
2024-05-30更新
|
253次组卷
|
3卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
名校
8 . 氧化镓(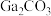 )是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、
)是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、 、
、 )为原料生产
)为原料生产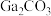 的工业流程如图所示:
的工业流程如图所示:
ⅱ. 对硝酸参与的氧化还原反应有催化作用。
对硝酸参与的氧化还原反应有催化作用。
回答下列问题:
(1)Ga元素的价电子排布式为_______ 。
(2)滤渣1的主要成分为_______ 。
(3)①“浸取”时GaAs发生反应的化学方程式_______ 。
②若取A、B两组样品分别进行“浸取”实验,向A中不断通入 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:___________ B(填>、=或<),其可能原因是___________ 。
(4)“沉镓”时的离子方程式为___________ ,需要控制硝酸用量的原因___________ 。
(5)查阅资料后发现,实际工业生产中,在“浸取”步骤除了加硝酸外,还需要加入 ,从绿色化学角度分析加入
,从绿色化学角度分析加入 的优点
的优点___________ 。
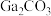 )是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、
)是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、 、
、 )为原料生产
)为原料生产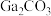 的工业流程如图所示:
的工业流程如图所示: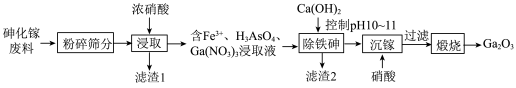
ⅱ.
 对硝酸参与的氧化还原反应有催化作用。
对硝酸参与的氧化还原反应有催化作用。回答下列问题:
(1)Ga元素的价电子排布式为
(2)滤渣1的主要成分为
(3)①“浸取”时GaAs发生反应的化学方程式
②若取A、B两组样品分别进行“浸取”实验,向A中不断通入
 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示: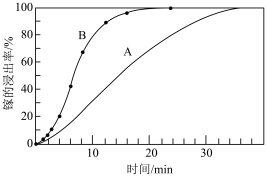
(4)“沉镓”时的离子方程式为
(5)查阅资料后发现,实际工业生产中,在“浸取”步骤除了加硝酸外,还需要加入
 ,从绿色化学角度分析加入
,从绿色化学角度分析加入 的优点
的优点
您最近一年使用:0次
2024-05-30更新
|
173次组卷
|
3卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
名校
9 . F为生产医药布洛芬的原料之一,其合成路线如下:
(1)B中官能团名称:___________ 。
(2) 的反应类型为:
的反应类型为:___________ 。
(3)F的手性碳原子有___________ 个。
(4)B的同分异构中满足下列条件的有___________ 种。
a.含有两个 b.可发生银镜反应 c.苯环上有三个取代基
b.可发生银镜反应 c.苯环上有三个取代基
其中核磁共振氢谱有五组峰,峰面积之比为 的结构简式为
的结构简式为___________ 。
(5)设计由 制备
制备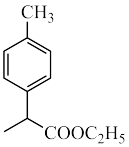 的合成路线(依据题中流程分析)。
的合成路线(依据题中流程分析)。___________ 。

(1)B中官能团名称:
(2)
 的反应类型为:
的反应类型为:(3)F的手性碳原子有
(4)B的同分异构中满足下列条件的有
a.含有两个
 b.可发生银镜反应 c.苯环上有三个取代基
b.可发生银镜反应 c.苯环上有三个取代基其中核磁共振氢谱有五组峰,峰面积之比为
 的结构简式为
的结构简式为(5)设计由
 制备
制备 的合成路线(依据题中流程分析)。
的合成路线(依据题中流程分析)。
您最近一年使用:0次
解题方法
10 . 一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料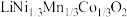 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于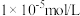 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: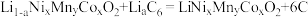 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料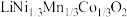 的工业流程如下:
的工业流程如下: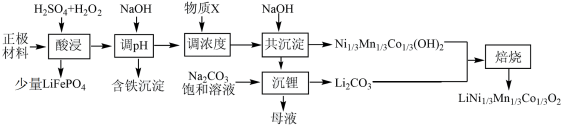

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  |  |  |  |
 | 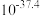 | 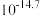 | 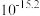 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是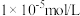 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
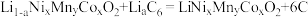 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

您最近一年使用:0次
2024-04-29更新
|
73次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题