一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料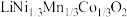 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于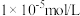 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: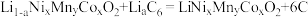 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料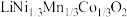 的工业流程如下:
的工业流程如下: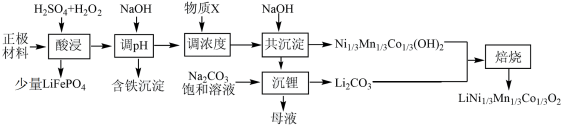

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  |  |  |  |
 | 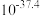 | 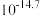 | 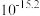 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是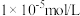 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
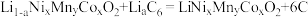 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

更新时间:2024-04-29 22:34:13
|
相似题推荐
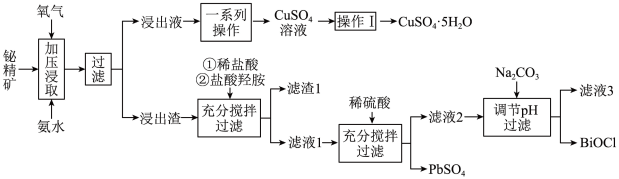
【推荐1】铋及其化合物在工业生产中用途广泛,如氯氧化铋(BiOCl)常用作电子设备、塑料助剂等。以下是一种用铋精矿(Bi2S3,含有FeS2、Cu2S、PbO2及不溶性杂质)制备BiOCl的一种方法,其流程如图:
① 开始沉淀
开始沉淀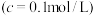 的pH为1.9,沉淀完全
的pH为1.9,沉淀完全 时的pH为3.2。
时的pH为3.2。
② 开始沉淀
开始沉淀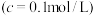 的pH为7.0,沉淀完全
的pH为7.0,沉淀完全 时的pH为9.0。
时的pH为9.0。
③pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:___________ 。
(2)“操作I”为___________ 。基态 的价层电子轨道表示式是
的价层电子轨道表示式是___________ 。
(3)分析盐酸羟胺((NH3OHCl)在流程中的作用是___________ (至少答一点)。
(4)滤液3中 的浓度为0.056g/L,“调pH”步骤中pH的范围为
的浓度为0.056g/L,“调pH”步骤中pH的范围为___________ 。
(5)写出流程中生成BiOCl的离子方程式:___________ 。
(6)铋化锂晶胞结构如图所示: ,B为
,B为___________ 。
②若晶胞的参数为apm,阿伏加德罗常数为 ,晶体的密度计算表达式为
,晶体的密度计算表达式为  。
。
①
 开始沉淀
开始沉淀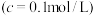 的pH为1.9,沉淀完全
的pH为1.9,沉淀完全 时的pH为3.2。
时的pH为3.2。②
 开始沉淀
开始沉淀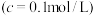 的pH为7.0,沉淀完全
的pH为7.0,沉淀完全 时的pH为9.0。
时的pH为9.0。③pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为
 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:(2)“操作I”为
 的价层电子轨道表示式是
的价层电子轨道表示式是(3)分析盐酸羟胺((NH3OHCl)在流程中的作用是
(4)滤液3中
 的浓度为0.056g/L,“调pH”步骤中pH的范围为
的浓度为0.056g/L,“调pH”步骤中pH的范围为(5)写出流程中生成BiOCl的离子方程式:
(6)铋化锂晶胞结构如图所示:
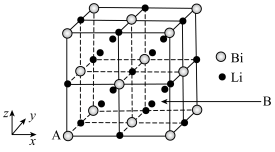
 ,B为
,B为②若晶胞的参数为apm,阿伏加德罗常数为
 ,晶体的密度计算表达式为
,晶体的密度计算表达式为  。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白:
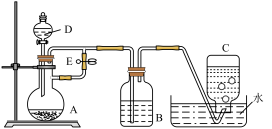
(1)B中盛有一定量的NaOH溶液,D仪器的名称________ ,A中反应的离子方程式为________ 。
(2)实验开始时应先将活塞E_____ (填“打开”或“关闭”), 在C中收到的气体主要为_______ ;当C瓶或A瓶中的气泡_________ 时,将活塞E_____ (填“打开”或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示,有几个写几个)是:_________________________ ;
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:____________ 。

(1)B中盛有一定量的NaOH溶液,D仪器的名称
(2)实验开始时应先将活塞E
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
您最近一年使用:0次
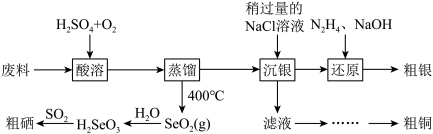
【推荐3】工业上以硒化银半导体废料(含 、Cu)为原料提取硒、铜、银,进而制备一种新型太阳能电池的材料。
、Cu)为原料提取硒、铜、银,进而制备一种新型太阳能电池的材料。
已知:25℃。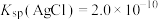 ,
,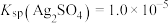 。
。
请回答下列问题:
(1)“酸溶”时,为提高废料中硒元素的浸出率可采取的措施是___________ (任写一种),写出废料中 转化为
转化为 的化学反应方程式
的化学反应方程式___________ 。
(2)制得的粗铜可通过电解法精炼,电解质溶液可以选择___________(填字母序号)。
(3)上述流程中,通入 发生氧化还原反应获得“粗硒”,该过程中氧化剂和还原剂的物质的量之比为
发生氧化还原反应获得“粗硒”,该过程中氧化剂和还原剂的物质的量之比为___________ 。
(4)“沉银”时,从平衡移动角度解释,加入稍过量 溶液的原因
溶液的原因___________ ,计算 转化成
转化成 的平衡常数
的平衡常数
___________ 。
(5)“还原”时,写出 与液态
与液态 、
、 溶液反应制取粗银的离子方程式
溶液反应制取粗银的离子方程式___________ 。
 、Cu)为原料提取硒、铜、银,进而制备一种新型太阳能电池的材料。
、Cu)为原料提取硒、铜、银,进而制备一种新型太阳能电池的材料。
已知:25℃。
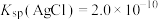 ,
,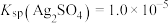 。
。请回答下列问题:
(1)“酸溶”时,为提高废料中硒元素的浸出率可采取的措施是
 转化为
转化为 的化学反应方程式
的化学反应方程式(2)制得的粗铜可通过电解法精炼,电解质溶液可以选择___________(填字母序号)。
A.稀 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
 发生氧化还原反应获得“粗硒”,该过程中氧化剂和还原剂的物质的量之比为
发生氧化还原反应获得“粗硒”,该过程中氧化剂和还原剂的物质的量之比为(4)“沉银”时,从平衡移动角度解释,加入稍过量
 溶液的原因
溶液的原因 转化成
转化成 的平衡常数
的平衡常数
(5)“还原”时,写出
 与液态
与液态 、
、 溶液反应制取粗银的离子方程式
溶液反应制取粗银的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】铂铼双金属催化剂是石油化工行业的高活性催化剂,使用时,催化剂表面的积炭和铂晶粒的烧结使催化剂逐渐失效。从失效催化剂(主要成分为Al2O3,含少量SiO2、Fe2O3、Pt、Re和积炭)中回收金属铼(Re)、铂(Pt)的工艺流程如下:

回答下列问题:
(1)铂铼双金属催化剂中A12O3的作用是__________________ 。
(2)利用空气“氧化焙烧”时,生成气体的分子式为______________ ,同时铼被氧化为酸性氧化物Re2O7。
(3)“碱焙烧”时,多种成分都能与NaOH反应,其中生成NaReO4的化学方程式为_______________ 。
(4)“滤渣1”回收铂时,先用王水溶解铂生成H2PtC16,再用氯化铵生成(NH4)2PtCl6沉淀,最后煅烧(NH4)2PtC16使其分解生成单质Pt和氮气等产物,该分解反应的化学方程式为_______________ 。
(5)“滤渣2”主要成分的化学式是_______________ 。
(6)“冷冻结晶”时析出含杂质的高铼酸钾(KReO4)晶体,可用_______________ (填方法的名称)提纯。
(7)用氢气高温还原KReO4的化学方程式为_______________ 。

回答下列问题:
(1)铂铼双金属催化剂中A12O3的作用是
(2)利用空气“氧化焙烧”时,生成气体的分子式为
(3)“碱焙烧”时,多种成分都能与NaOH反应,其中生成NaReO4的化学方程式为
(4)“滤渣1”回收铂时,先用王水溶解铂生成H2PtC16,再用氯化铵生成(NH4)2PtCl6沉淀,最后煅烧(NH4)2PtC16使其分解生成单质Pt和氮气等产物,该分解反应的化学方程式为
(5)“滤渣2”主要成分的化学式是
(6)“冷冻结晶”时析出含杂质的高铼酸钾(KReO4)晶体,可用
(7)用氢气高温还原KReO4的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】2022年3月,我国科研团队准确测定了嫦娥五号带回的月壤样品中40多种元素的含量。研究人员曾在月壤中发现了辉钼矿(主要成分为MoS2,含有少量杂质),可用于制备钼酸钠晶体(Na2MoO4·2H2O),生产工艺如图。回答下列问题:
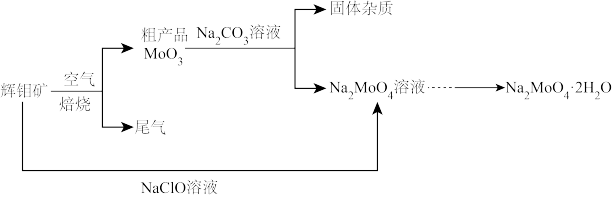
回答下列问题:
(1)焙烧时,采用逆流(空气从炉底进入,辉钼矿经粉碎后从炉顶进入)焙烧的目的是____ 。某些生产工艺在焙烧时加入CaCO3会更环保,其原因是____ (用化学方程式表示)。
(2)碱性条件下,也可将辉钼矿加入NaClO溶液中制得钼酸钠和硫酸盐,该反应的离子方程式为____ 。
(3)为得到高纯度的钼酸钠晶体,常需加入BaCl2固体除去Na2MoO4溶液中的SO 。若溶液中c(MoO
。若溶液中c(MoO )=0.40mol·L-1,c(SO
)=0.40mol·L-1,c(SO )=0.05mol·L-1,假设钼元素无损失,SO
)=0.05mol·L-1,假设钼元素无损失,SO 的最大去除率为
的最大去除率为____ %。[忽略溶液体积变化,已知:25℃,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。
(4)钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是____ (填字母)。
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。
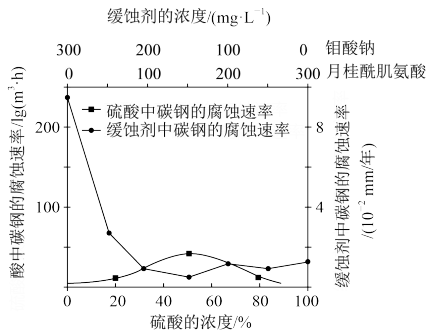
当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____ 。若缓蚀剂为钼酸钠一月桂酰肌氨酸(总浓度为300mg·L-1),缓蚀效果最好时,钼酸钠(M=206g·mol-1)的物质的量浓度为____ mol·L-1(保留2位有效数字)。

回答下列问题:
(1)焙烧时,采用逆流(空气从炉底进入,辉钼矿经粉碎后从炉顶进入)焙烧的目的是
(2)碱性条件下,也可将辉钼矿加入NaClO溶液中制得钼酸钠和硫酸盐,该反应的离子方程式为
(3)为得到高纯度的钼酸钠晶体,常需加入BaCl2固体除去Na2MoO4溶液中的SO
 。若溶液中c(MoO
。若溶液中c(MoO )=0.40mol·L-1,c(SO
)=0.40mol·L-1,c(SO )=0.05mol·L-1,假设钼元素无损失,SO
)=0.05mol·L-1,假设钼元素无损失,SO 的最大去除率为
的最大去除率为(4)钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】 对神经元有明显的保护作用,在医疗上可用于减轻急性低氧所致的某些神经电流变化。由含钴矿(
对神经元有明显的保护作用,在医疗上可用于减轻急性低氧所致的某些神经电流变化。由含钴矿( 元素主要以
元素主要以 、
、 的形式存在,还含有
的形式存在,还含有 、
、 、
、 、
、 、
、 、
、 元素)制取氯化钴晶体的一种工艺流程如下:
元素)制取氯化钴晶体的一种工艺流程如下:
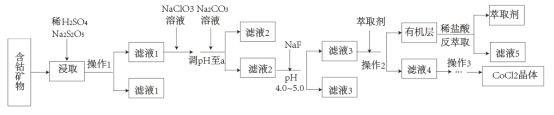
已知:①焦亚硫酸钠( )是食品中常见的还原剂。
)是食品中常见的还原剂。
②25℃时,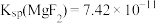 ,
,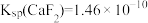 。
。
③部分金属阳离子形成氢氧化物的 见下表:
见下表:
回答下列问题:
(1)操作①的名称为___________ ,浸取时加入Na2S2O5的离子方程式为___________ 。
(2)滤液1中加入 用作氧化剂,
用作氧化剂, 在流程中还具有的作用是
在流程中还具有的作用是___________ 。
(3)加入 溶液调节
溶液调节 至
至 ,若
,若 的范围是3.2~4.0时,则加入
的范围是3.2~4.0时,则加入 溶液生成滤渣2的主要离子方程式为
溶液生成滤渣2的主要离子方程式为___________ 。
(4)滤渣3的主要成分为 和
和 ,则滤液3中
,则滤液3中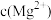 与
与 的比值为
的比值为___________ 。
(5)经过萃取和反萃取操作,溶液5中的阳离子主要含有 和
和 、
、 ,滤液4经过操作3可制备
,滤液4经过操作3可制备 晶体,操作3中包含3个基本实验操作,它们是
晶体,操作3中包含3个基本实验操作,它们是___________ 、___________ 、___________ 。
(6)上述流程中可循环使用的物质是___________ 。
(7)在上述新工艺中,用“稀硫酸和氯酸钠”代替原工艺中“盐酸与硝酸”,其主要优点是___________ 。
 对神经元有明显的保护作用,在医疗上可用于减轻急性低氧所致的某些神经电流变化。由含钴矿(
对神经元有明显的保护作用,在医疗上可用于减轻急性低氧所致的某些神经电流变化。由含钴矿( 元素主要以
元素主要以 、
、 的形式存在,还含有
的形式存在,还含有 、
、 、
、 、
、 、
、 、
、 元素)制取氯化钴晶体的一种工艺流程如下:
元素)制取氯化钴晶体的一种工艺流程如下:
已知:①焦亚硫酸钠(
 )是食品中常见的还原剂。
)是食品中常见的还原剂。②25℃时,
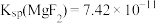 ,
,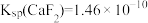 。
。③部分金属阳离子形成氢氧化物的
 见下表:
见下表: |  |  |  |  |  | 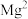 | |
开始沉淀 | 0.3 | 5.5 | 2.7 | 7.2 | 7.6 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 6.6 | 3.2 | 9.2 | 9.6 | 9.2 | 11.1 |
回答下列问题:
(1)操作①的名称为
(2)滤液1中加入
 用作氧化剂,
用作氧化剂, 在流程中还具有的作用是
在流程中还具有的作用是(3)加入
 溶液调节
溶液调节 至
至 ,若
,若 的范围是3.2~4.0时,则加入
的范围是3.2~4.0时,则加入 溶液生成滤渣2的主要离子方程式为
溶液生成滤渣2的主要离子方程式为(4)滤渣3的主要成分为
 和
和 ,则滤液3中
,则滤液3中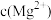 与
与 的比值为
的比值为(5)经过萃取和反萃取操作,溶液5中的阳离子主要含有
 和
和 、
、 ,滤液4经过操作3可制备
,滤液4经过操作3可制备 晶体,操作3中包含3个基本实验操作,它们是
晶体,操作3中包含3个基本实验操作,它们是(6)上述流程中可循环使用的物质是
(7)在上述新工艺中,用“稀硫酸和氯酸钠”代替原工艺中“盐酸与硝酸”,其主要优点是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上用钼精矿(主要成分是MoS2,含少量的PbS)制备钼酸钠晶体(Na2MoO4·2H2O)的流程如图所示。
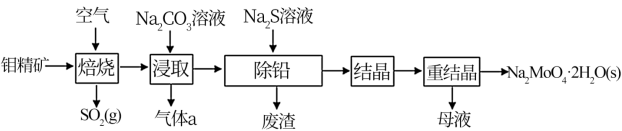
已知:“浸取”时PbO转化为Na2PbO2。
回答下列问题:
(1)“焙烧”时为了使钼精矿充分反应,可采取的措施是___________ (答出一条即可);“焙烧”时MoS2转化为MoO3,该反应中氧化剂和还原剂的物质的量之比为___________ ;“浸取”时生成气体a的电子式为___________ 。
(2)“除铅”过程中发生反应的离子方程式为___________ 。
(3)①结晶前需加入Ba(OH)2固体以除去 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率为87.5%,则Ksp(BaMoO4)=
的去除率为87.5%,则Ksp(BaMoO4)=___________ 。 [结晶前溶液中 c( MoO )= 0.40 mol/L,c(
)= 0.40 mol/L,c( )= 0.20 mol/L,Ksp( BaCO3)= 1×10-9,溶液体积变化可忽略]
)= 0.20 mol/L,Ksp( BaCO3)= 1×10-9,溶液体积变化可忽略]
②结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___________ 。
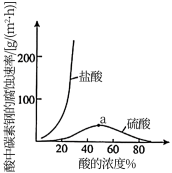
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在不同介质中的腐蚀速率实验结果如下图。
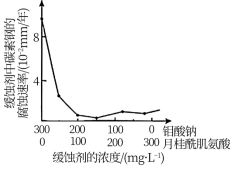
①若缓蚀剂钼酸钠-月桂酰肌氨酸的总浓度为300 mg/L,则缓蚀效果最好时钼酸钠( M=206 g/ mol)的物质的量浓度为___________ mol/L(保留3位有效数字)。
②a点前,随着酸的浓度增大,碳素钢在盐酸中的腐蚀速率明显比在硫酸中腐蚀速率快,其原因可能是___________ ,请设计实验证明上述结论___________ 。

已知:“浸取”时PbO转化为Na2PbO2。
回答下列问题:
(1)“焙烧”时为了使钼精矿充分反应,可采取的措施是
(2)“除铅”过程中发生反应的离子方程式为
(3)①结晶前需加入Ba(OH)2固体以除去
 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率为87.5%,则Ksp(BaMoO4)=
的去除率为87.5%,则Ksp(BaMoO4)= )= 0.40 mol/L,c(
)= 0.40 mol/L,c( )= 0.20 mol/L,Ksp( BaCO3)= 1×10-9,溶液体积变化可忽略]
)= 0.20 mol/L,Ksp( BaCO3)= 1×10-9,溶液体积变化可忽略]②结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在不同介质中的腐蚀速率实验结果如下图。


①若缓蚀剂钼酸钠-月桂酰肌氨酸的总浓度为300 mg/L,则缓蚀效果最好时钼酸钠( M=206 g/ mol)的物质的量浓度为
②a点前,随着酸的浓度增大,碳素钢在盐酸中的腐蚀速率明显比在硫酸中腐蚀速率快,其原因可能是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
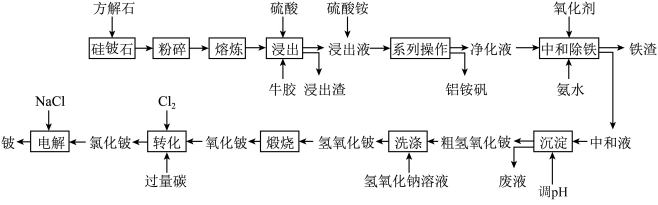
【推荐2】铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。素有“中国铍业”之称的某厂改进国外以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺,以硅铍石(主要成分为  )为原料提取铍,具体流程如图:
)为原料提取铍,具体流程如图:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②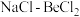 熔融可离子化(生成铍氯配离子)。
熔融可离子化(生成铍氯配离子)。
③铝铵矾在不同温度下的溶解度如下表:
回答下列问题:
(1)绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为_______ ;流程中“系列操作”为_______ 。
(2)将“中和液”沉淀时,调节溶液的pH不能过大或过小。pH过大时发生反应的离子方程式为_______ 。
(3)已知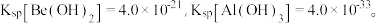 若
若 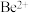 浓度为
浓度为  的中和液开始沉淀时,溶液中 c(Al3+)=
的中和液开始沉淀时,溶液中 c(Al3+)=_______ mol/L
(4)若在实验室洗涤粗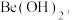 操作为
操作为_______ 。
(5)氧化铍转化为氯化铍的化学方程式为_______ 。
(6)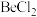 的电子式为
的电子式为_______ ;工业上电解 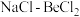 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为_______ 电解时需加入氯化钠的作用是_______ 。
 )为原料提取铍,具体流程如图:
)为原料提取铍,具体流程如图:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②
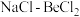 熔融可离子化(生成铍氯配离子)。
熔融可离子化(生成铍氯配离子)。③铝铵矾在不同温度下的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/含 | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
回答下列问题:
(1)绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为
(2)将“中和液”沉淀时,调节溶液的pH不能过大或过小。pH过大时发生反应的离子方程式为
(3)已知
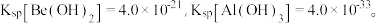 若
若 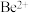 浓度为
浓度为  的中和液开始沉淀时,溶液中 c(Al3+)=
的中和液开始沉淀时,溶液中 c(Al3+)=(4)若在实验室洗涤粗
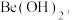 操作为
操作为(5)氧化铍转化为氯化铍的化学方程式为
(6)
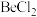 的电子式为
的电子式为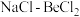 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
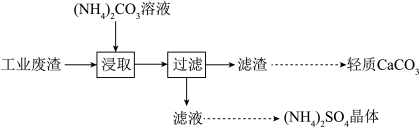
(1)室温下,反应CaSO4(s)+ (aq)⇌CaCO3(s)+
(aq)⇌CaCO3(s)+ (aq)达到平衡,则溶液中
(aq)达到平衡,则溶液中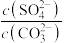 =
=________ [Ksp(CaSO4)=4.8×10−5,Ksp(CaCO3)=3×10−9]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为________ ;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________ 。
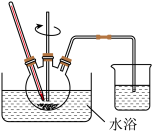
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是________ ;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________ 。
(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:______ [已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。

(1)室温下,反应CaSO4(s)+
 (aq)⇌CaCO3(s)+
(aq)⇌CaCO3(s)+ (aq)达到平衡,则溶液中
(aq)达到平衡,则溶液中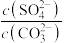 =
=(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是

(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:
您最近一年使用:0次
【推荐1】现有X、Y、Z、W、R五种原子序数依次增大的短周期元素。已知X为最轻的元素;Y的一种同位素常用于文物年代的测定;Z原子的最外层电子数是内层电子总数的3倍;W的族序数与其周期序数相同;R的一种氧化物具有漂白性,其漂白原理和NaClO不同。请回答下列问题:
(1)Y在周期表中的位置为_______ 。
(2)W和R形成的最简单化合物与水反应的化学方程式为_______ 。
(3)X、Z的单质和氢氧化钠溶液能形成电池,该电池工作时的正极反应式是_______ 。
(4)工业上常用电解熔融的Z和W形成的化合物的方法冶炼W单质,W单质在_______ (填“阴极”或“阳极”)得到,阳极石墨随工作时间的延长会被逐渐消耗,其原因是_______ 。
(5)X、Z、W可形成化合物M,常温下,M的酸性电离常数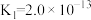 ,则M溶于NaOH溶液的反应的平衡常数
,则M溶于NaOH溶液的反应的平衡常数
_______ 。
(1)Y在周期表中的位置为
(2)W和R形成的最简单化合物与水反应的化学方程式为
(3)X、Z的单质和氢氧化钠溶液能形成电池,该电池工作时的正极反应式是
(4)工业上常用电解熔融的Z和W形成的化合物的方法冶炼W单质,W单质在
(5)X、Z、W可形成化合物M,常温下,M的酸性电离常数
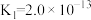 ,则M溶于NaOH溶液的反应的平衡常数
,则M溶于NaOH溶液的反应的平衡常数
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,甲、乙可化合生成离子化合物丙。试回答下列问题:
(1)W元素在周期表中的位置是_________ ;甲的空间构型为___________ 。
(2)丙的水溶液呈酸性,用离子方程式表示其原因____________________________ 。
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式_________________ ;X、Y组成的液态化合物Y2X416克与足量丁反应生成Y2和液态水,放出Q kJ的热量,请写出该反应的热化学方程式___________
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为____________________ 。
(1)W元素在周期表中的位置是
(2)丙的水溶液呈酸性,用离子方程式表示其原因
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】短周期主族元素X、Y、Z、Q、R的原子序数依次增大,其中X的单质是密度最小的气体,Z是同周期中原子半径最大的元素,Y与Q同主族,且Q的原子序数是Y的两倍。回答下列问题:
(1)Z的原子结构示意图为__________ ,R在元素周期表中的位置是______________ 。
(2)Z的最高价氧化物对应水化物所含化学键类型是_______________ 。Q、R的最高价氧化物对应的水化物酸性较强的是__________ (填化学式)。
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为_______ 。将Q的低价氧化物通入T可以生成一种强酸,反应的化学方程式为___________________ 。
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为______________________ 。
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g) 4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=
4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=_______ ;A在平衡混合物中的体积分数为________ ;从反应开始至平衡时,以C的浓度变化表示该反应的平均速率v(C)=_____________ 。
(1)Z的原子结构示意图为
(2)Z的最高价氧化物对应水化物所含化学键类型是
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g)
 4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=
4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=
您最近一年使用:0次



