铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。素有“中国铍业”之称的某厂改进国外以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺,以硅铍石(主要成分为  )为原料提取铍,具体流程如图:
)为原料提取铍,具体流程如图:
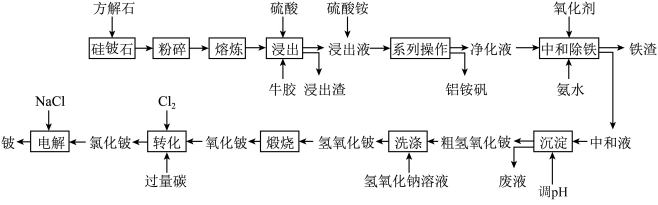
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②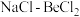 熔融可离子化(生成铍氯配离子)。
熔融可离子化(生成铍氯配离子)。
③铝铵矾在不同温度下的溶解度如下表:
回答下列问题:
(1)绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为_______ ;流程中“系列操作”为_______ 。
(2)将“中和液”沉淀时,调节溶液的pH不能过大或过小。pH过大时发生反应的离子方程式为_______ 。
(3)已知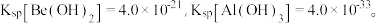 若
若 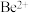 浓度为
浓度为  的中和液开始沉淀时,溶液中 c(Al3+)=
的中和液开始沉淀时,溶液中 c(Al3+)=_______ mol/L
(4)若在实验室洗涤粗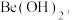 操作为
操作为_______ 。
(5)氧化铍转化为氯化铍的化学方程式为_______ 。
(6)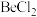 的电子式为
的电子式为_______ ;工业上电解 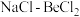 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为_______ 电解时需加入氯化钠的作用是_______ 。
 )为原料提取铍,具体流程如图:
)为原料提取铍,具体流程如图:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②
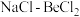 熔融可离子化(生成铍氯配离子)。
熔融可离子化(生成铍氯配离子)。③铝铵矾在不同温度下的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/含 | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
回答下列问题:
(1)绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为
(2)将“中和液”沉淀时,调节溶液的pH不能过大或过小。pH过大时发生反应的离子方程式为
(3)已知
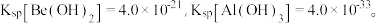 若
若 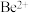 浓度为
浓度为  的中和液开始沉淀时,溶液中 c(Al3+)=
的中和液开始沉淀时,溶液中 c(Al3+)=(4)若在实验室洗涤粗
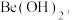 操作为
操作为(5)氧化铍转化为氯化铍的化学方程式为
(6)
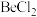 的电子式为
的电子式为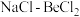 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为
更新时间:2022-06-02 16:06:59
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】一种从废旧锂电池(主要含LiCoO2,及少量Al、Cu)中制备钴酸锂的工艺流程如下:
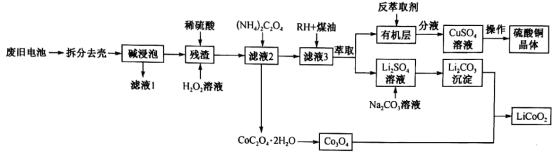
(1)碱浸泡用来除去废旧电池中的_________ ,为提高该物质的去除率可采取的措施有_______ (任写两条)。
(2)向“残渣”中加入稀硫酸和H2O2,放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:_________ 。
(3)设溶液中c(Co2+)=0.1mol⋅L-1,为沉淀Co2+,向“滤液2”中加入 (NH4)2C2O4,而不用Na2C2O4。利用如下数据说明原因:________ 。[已知:25℃时0.1mol/L (NH4)2C2O4溶液pH约为6.4;0.1mol⋅L-1 Na2C2O4溶液pH约为8.35;Ksp[Co(OH)2]=6.0×10−13]
(4)H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是______ 、_____ ;向有机层中加入反萃取剂
________ (填化学式)可将Cu2+反萃取至水层。

(5)已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是________ 。

(1)碱浸泡用来除去废旧电池中的
(2)向“残渣”中加入稀硫酸和H2O2,放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:
(3)设溶液中c(Co2+)=0.1mol⋅L-1,为沉淀Co2+,向“滤液2”中加入 (NH4)2C2O4,而不用Na2C2O4。利用如下数据说明原因:
(4)H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是

(5)已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是
您最近一年使用:0次
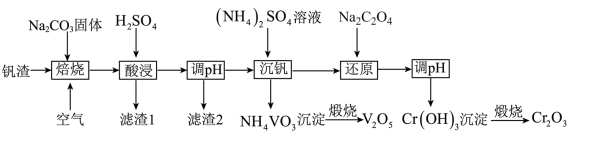
【推荐2】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________ 和_______ 。
(2)滤渣1中主要含______ 。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______ 。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______ ,NH4VO3煅烧过程中的化学方程式是______ 。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________ 。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____ ,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______ (保留两位有效数字)。
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为
(2)滤渣1中主要含
(3)“沉钒”时的离子方程式是
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】镍冶炼厂产出的铜镍合金(含有FeS、NiS等杂质)中含有大量的贵金属,一种绿色环保工艺可实现铜、镍有价金属的分步浸出,便于后续贵金属的富集,并获得硫酸铜结晶产品,其流程如下。

已知:i.“滤渣”的主要成分为Cu、CuS,还含有少量Ni、NiS。
ⅱ.常温下,溶液中 金属离子形成氢氧化物沉淀的pH如下表所示:
金属离子形成氢氧化物沉淀的pH如下表所示:
请回答下列有关问题:
(1)基态Ni原子价电子排布式为_______ ;“水雾化”时,将铜镍合金雾化为铜镍合金粉,其目的是_______ 。
(2)“浸镍”过程中,镍的浸出率随硫酸铜溶液的浓度、反应温度及反应时间的变化曲线如下图所示,则实验过程中的最佳实验条件为_______ 。

(3)“浸铜”过程在高温高压条件下进行,写出滤渣被氧化生成 的两个化学方程式
的两个化学方程式_______ 、_______ 。
(4)操作X的步骤为_______ 、洗涤、干燥。
(5)“氧化”过程,判断离子已完全转化的实验操作是_______ 。
(6)常温下,“调pH”时,若溶液中 浓度为
浓度为 时,为使杂质离子沉淀完全(已知:当离子浓度不大于
时,为使杂质离子沉淀完全(已知:当离子浓度不大于 认为沉淀完全),则需控制溶液的pH范围是
认为沉淀完全),则需控制溶液的pH范围是_______ 。

已知:i.“滤渣”的主要成分为Cu、CuS,还含有少量Ni、NiS。
ⅱ.常温下,溶液中
 金属离子形成氢氧化物沉淀的pH如下表所示:
金属离子形成氢氧化物沉淀的pH如下表所示:| 离子 |  |  |  |
| 开始沉淀pH | 7.2 | 7.5 | 2.2 |
请回答下列有关问题:
(1)基态Ni原子价电子排布式为
(2)“浸镍”过程中,镍的浸出率随硫酸铜溶液的浓度、反应温度及反应时间的变化曲线如下图所示,则实验过程中的最佳实验条件为

(3)“浸铜”过程在高温高压条件下进行,写出滤渣被氧化生成
 的两个化学方程式
的两个化学方程式(4)操作X的步骤为
(5)“氧化”过程,判断离子已完全转化的实验操作是
(6)常温下,“调pH”时,若溶液中
 浓度为
浓度为 时,为使杂质离子沉淀完全(已知:当离子浓度不大于
时,为使杂质离子沉淀完全(已知:当离子浓度不大于 认为沉淀完全),则需控制溶液的pH范围是
认为沉淀完全),则需控制溶液的pH范围是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】SbCl3可用于红外光谱分析用溶剂、显像管生产等。以某矿渣(主要成分为Sb2O3,含有少量CuO、As2O3等杂质)为原料制备SbCl3的工艺流程如图所示:
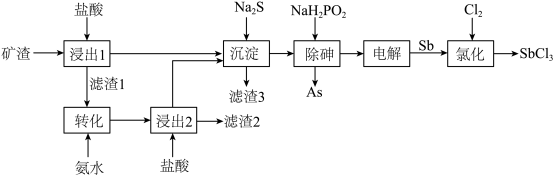
已知:①Sb属于第VA族元素,主要化合价为+3、+5价。
②常温下,Ksp(CuS)=6.3×10-36,Ksp(Sb2S3)=1.5×10-93。
③As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
④次磷酸(H3PO2)为一元中强酸,具有强还原性。
回答下列问题:
(1)基态As的简化电子排布式为___________ ;As、P、Cl三种元素的电负性从大到小的顺序为___________ 。
(2)“滤渣1”的主要成分是SbOCl,为了提高锑的利用率,将滤渣1用氨水浸取使其转化为Sb2O3,写出该反应的离子方程式:___________ 。
(3)已知“沉淀”阶段溶液中c(Sb3+)起始=0.01mol·L-1.当“沉淀”后溶液中c(Cu2+)=6.3×10-6mol·L-1时,该阶段是否有Sb2S3沉淀生成?___________ (通过计算说明,简要写出计算过程,不考虑溶液体积的变化)。
(4)“除砷”时,NaH2PO2的氧化产物为H3PO4。
①NaH2PO2的化学名称为___________ 。H3PO4中磷原子的杂化类型为___________ 。
②“除砷”过程中生成As的反应的化学方程式是___________ 。
(5)“电解”SbCl3溶液时,被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2,则电解方程式为___________ 。

已知:①Sb属于第VA族元素,主要化合价为+3、+5价。
②常温下,Ksp(CuS)=6.3×10-36,Ksp(Sb2S3)=1.5×10-93。
③As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
④次磷酸(H3PO2)为一元中强酸,具有强还原性。
回答下列问题:
(1)基态As的简化电子排布式为
(2)“滤渣1”的主要成分是SbOCl,为了提高锑的利用率,将滤渣1用氨水浸取使其转化为Sb2O3,写出该反应的离子方程式:
(3)已知“沉淀”阶段溶液中c(Sb3+)起始=0.01mol·L-1.当“沉淀”后溶液中c(Cu2+)=6.3×10-6mol·L-1时,该阶段是否有Sb2S3沉淀生成?
(4)“除砷”时,NaH2PO2的氧化产物为H3PO4。
①NaH2PO2的化学名称为
②“除砷”过程中生成As的反应的化学方程式是
(5)“电解”SbCl3溶液时,被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2,则电解方程式为
您最近一年使用:0次
【推荐2】随着可燃冰开采领域的不断扩大,我国已处于世界绝对领先地位。将甲烷((CH4)催化转化为有价值的化学工业品一直是我国化学工作 者的研究热点。最近徐君团队研发出了一种Au在ZSM-5分子筛上催化氧化甲烷生产CH3OH和CH3COOH的技术,该技术涉及的反应如下:
反应Ⅰ 2CH4(g)+O2(g) 2CH3OH(g) △H1= -251.0kJ·mol-1;
2CH3OH(g) △H1= -251.0kJ·mol-1;
反应Ⅱ 2CH4(g)+2O2(g) CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
请回答下列问题:
(1)部分化学键的键能数据如下表所示:
则C-O的键能为_______ kJ·mol-1。
(2)反应II在热力学上进行的趋势很大,原因为_______ 。除降低温度外,能同时提高CH3OH和CH3COOH的平衡产率的措施为_______ (任答一条)。
(3)T℃下,向含有少量Au-ZSM-5分子筛催化剂的体积为VL的刚性密闭容器中充入1molCH4和2molO2发生反应I和反应II。达到平衡时测得CH4的物质的量为a mol, CH3COOH(g)的物质 的量为b mol,此时O2(g)的浓度为_______ mol·L-1 (用含a、b、v的代数式表示,要求化简,下同),该温度下反应II的平衡常数为_______ 。
(4)徐君教授研究后发现在Au-ZSM-5分子筛催化剂表面,反应I中O2的解离过程和CH4的活化过程的机理如下图所示(·代表吸附态):
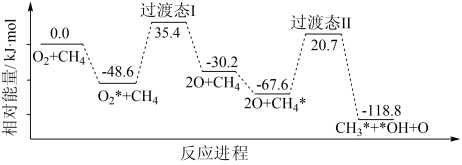
该反应进程中,O2的解离是_______ (填“吸热”或“放热”)的反应,该过程的反应速率_______ (填“大于”或“小于”)CH4的活化反应的反应速率。
(5)以CH4和O2为基本原料,采用电解法也可以制备CH3COOH,其装置如下图所示:
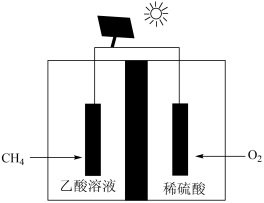
通入CH4的电极反应式为_______ 该装置工作时发生的能量转化形式为_______ (不考虑热能的转化)。
反应Ⅰ 2CH4(g)+O2(g)
 2CH3OH(g) △H1= -251.0kJ·mol-1;
2CH3OH(g) △H1= -251.0kJ·mol-1;反应Ⅱ 2CH4(g)+2O2(g)
 CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。请回答下列问题:
(1)部分化学键的键能数据如下表所示:
| 化学键 | O=O | C-H | O-H |
| 键能E/kJ·mol-1 | 498 | 414 | 390.8 |
则C-O的键能为
(2)反应II在热力学上进行的趋势很大,原因为
(3)T℃下,向含有少量Au-ZSM-5分子筛催化剂的体积为VL的刚性密闭容器中充入1molCH4和2molO2发生反应I和反应II。达到平衡时测得CH4的物质的量为a mol, CH3COOH(g)的物质 的量为b mol,此时O2(g)的浓度为
(4)徐君教授研究后发现在Au-ZSM-5分子筛催化剂表面,反应I中O2的解离过程和CH4的活化过程的机理如下图所示(·代表吸附态):

该反应进程中,O2的解离是
(5)以CH4和O2为基本原料,采用电解法也可以制备CH3COOH,其装置如下图所示:

通入CH4的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】回答下列问题
(1)尿素 中,第二周期元素第一电离能由大到小排序为
中,第二周期元素第一电离能由大到小排序为___________ 。其中C和N的杂化方式分别为___________ 、___________ 。
(2)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下,电解池中隔膜仅阻止气体通过,阴阳两极均为情性电极。完成下列表格。
(3)CO和 的沸点比较:CO
的沸点比较:CO___________  (选填编号)。
(选填编号)。
A.> B.<
(4)如图1,每条折线表示元素周期表第ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,据图可知,用相应的化学式表示第五周期的四种氢化物的沸点由高到低排序为___________ ,其中属于非极性分子的化学式是___________ 。

(5)分子中的大 健可用符号
健可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 健可表示为
健可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为___________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。图2为金刚石的晶胞,其中原子坐标参数A为(0,0,0),B为( ,0,
,0, ),C为(
),C为( ,
, ,0)。则原子坐标参数D为
,0)。则原子坐标参数D为___________ 。
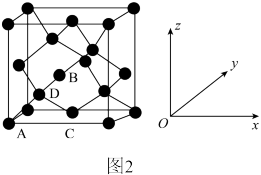
②晶胞参数,描述晶胞的大小和形状。已知金刚石的晶胞参数为apm,用含a的代数式表示晶胞中两个碳原子之间的最短距离为___________ cm。
(1)尿素
 中,第二周期元素第一电离能由大到小排序为
中,第二周期元素第一电离能由大到小排序为(2)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下,电解池中隔膜仅阻止气体通过,阴阳两极均为情性电极。完成下列表格。
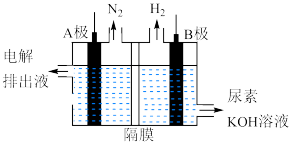 | 选填“阴”或“阳” | 电极式 | |
| A极 | |||
| B极 |
 的沸点比较:CO
的沸点比较:CO (选填编号)。
(选填编号)。A.> B.<
(4)如图1,每条折线表示元素周期表第ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,据图可知,用相应的化学式表示第五周期的四种氢化物的沸点由高到低排序为

(5)分子中的大
 健可用符号
健可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 健可表示为
健可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。图2为金刚石的晶胞,其中原子坐标参数A为(0,0,0),B为(
 ,0,
,0, ),C为(
),C为( ,
, ,0)。则原子坐标参数D为
,0)。则原子坐标参数D为
②晶胞参数,描述晶胞的大小和形状。已知金刚石的晶胞参数为apm,用含a的代数式表示晶胞中两个碳原子之间的最短距离为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________ ,
H2SO4溶解Al2O3的离子方程式为:_____________________ 。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:______________ 。
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:________________________ ,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________ 。
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:___________________ 。
②步骤Ⅳ中加入MnSO4的目的是:__________________________ 。
(5)步骤Ⅴ中“一系列操作”是__________________ 、_________________ 。
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:
H2SO4溶解Al2O3的离子方程式为:
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:
②当Al3+开始沉淀时,Fe3+的浓度约为:
(4)已知:一定条件下,MnO
 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:
②步骤Ⅳ中加入MnSO4的目的是:
(5)步骤Ⅴ中“一系列操作”是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】以废旧锂离子电池正极材料(主要成分为镍钴锰酸锂,还有少量镁铝合金和含铁化合物)为原料,回收Ni2+、Co2+、Mn2+的过程可表示为:
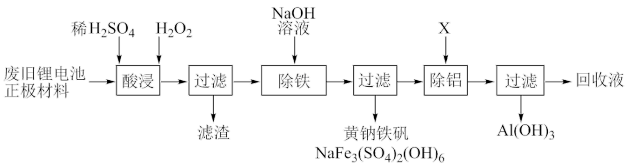
已知:Ksp(MnF2)=5×10-3 Ksp(MgF2)=8×10-11
(1)“酸浸”时,三价镍、三价钴、四价锰转化为Ni2+、Co2+、Mn2+进入溶液。该过程中H2O2的作用是_______ 。保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率如图所示。60℃时浸出率达到最大,可能的原因是_______ 。

(2)“除铁”生成黄钠铁矾沉淀时需控制溶液的pH为1.5~1.8。该过程中需不断加入NaOH溶液,其作用是_______ 。
(3)物质X可调节溶液的pH,X为_______ (填序号)。
A.NH4Cl B.(NH4)2SO4 C.NH4HCO3
(4)“除铝”后的滤液中含有Mg2+,可以用MnF2除去。结合反应的平衡常数解释用MnF2能除去Mg2+的原因是_______ 。
(5)回收液可用于合成锂离子电池正极材料,合成前需测定其中Co2+等离子的浓度。
测定原理:用过量标准K3[Fe(CN)6]溶液氧化经预处理的回收液样品中的Co2+,再用标准CoSO4溶液滴定过量的K3[Fe(CN)6]。
反应方程式为:Co2++[Fe(CN)6]3-=Co3++[Fe(CN)6]4-。
测定过程:取预处理后的回收液样品20.00mL,向其中加入20.00mL0.0520mol·L-1
K3[Fe(CN)6]溶液,充分反应;再用0.0500mol·L-1CoSO4溶液滴定反应后的溶液,消耗CoSO4溶液12.00mL。
数据分析:计算预处理后的回收液样品中Co2+的物质的量浓度_______ 。(写出计算过程)

已知:Ksp(MnF2)=5×10-3 Ksp(MgF2)=8×10-11
(1)“酸浸”时,三价镍、三价钴、四价锰转化为Ni2+、Co2+、Mn2+进入溶液。该过程中H2O2的作用是

(2)“除铁”生成黄钠铁矾沉淀时需控制溶液的pH为1.5~1.8。该过程中需不断加入NaOH溶液,其作用是
(3)物质X可调节溶液的pH,X为
A.NH4Cl B.(NH4)2SO4 C.NH4HCO3
(4)“除铝”后的滤液中含有Mg2+,可以用MnF2除去。结合反应的平衡常数解释用MnF2能除去Mg2+的原因是
(5)回收液可用于合成锂离子电池正极材料,合成前需测定其中Co2+等离子的浓度。
测定原理:用过量标准K3[Fe(CN)6]溶液氧化经预处理的回收液样品中的Co2+,再用标准CoSO4溶液滴定过量的K3[Fe(CN)6]。
反应方程式为:Co2++[Fe(CN)6]3-=Co3++[Fe(CN)6]4-。
测定过程:取预处理后的回收液样品20.00mL,向其中加入20.00mL0.0520mol·L-1
K3[Fe(CN)6]溶液,充分反应;再用0.0500mol·L-1CoSO4溶液滴定反应后的溶液,消耗CoSO4溶液12.00mL。
数据分析:计算预处理后的回收液样品中Co2+的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】三氯三(四氢呋喃)合铬(III)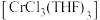 可催化烯烃加聚,制备的方法如下:
可催化烯烃加聚,制备的方法如下:
已知:① 易潮解,易升华,高温下易被氧气氧化。
易潮解,易升华,高温下易被氧气氧化。
② 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
③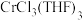 摩尔质量为
摩尔质量为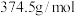 。
。
④四氢呋喃(THF)结构简式: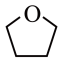
I.制备无水 :
:
某化学小组用 和
和 (沸点
(沸点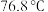 )在高温下制备无水
)在高温下制备无水 ,同时生成
,同时生成 气体,实验装置如图所示:
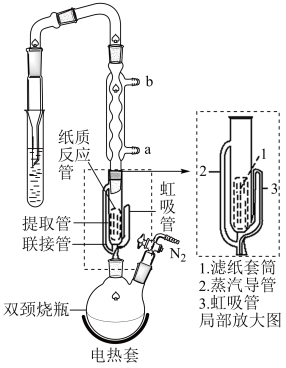
气体,实验装置如图所示:

(1)装置乙名称为___________ ;装置D中粗导管的作用是___________ 。
(2)实验装置合理的连接顺序为A→C→F→___________ →D___________ →B(填装置字母标号,可重复使用)。
(3)尾气处理时发生反应的离子方程式:___________ 。
II.合成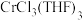 :
:
实验室在非水体系中合成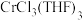 原理为:
原理为: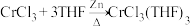
实验操作:
①填装反应物:称取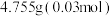 无水
无水 和
和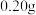 锌粉放入滤纸套筒内,双颈烧瓶中加入
锌粉放入滤纸套筒内,双颈烧瓶中加入 无水
无水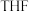 (四氢呋喃,过量)。
(四氢呋喃,过量)。
②合成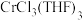 :先通入一段时间
:先通入一段时间 后,然后在球形冷凝管中通入冷却水,加热THF至沸腾,THF蒸气通过联接管进入提取管中,在冷凝管中冷凝回流到滤纸套筒中进行反应,当滤纸套筒中的液面高于虹吸管最高处时,发生虹吸现象,滤纸套筒中的液体流入双颈烧瓶,从而实现了
后,然后在球形冷凝管中通入冷却水,加热THF至沸腾,THF蒸气通过联接管进入提取管中,在冷凝管中冷凝回流到滤纸套筒中进行反应,当滤纸套筒中的液面高于虹吸管最高处时,发生虹吸现象,滤纸套筒中的液体流入双颈烧瓶,从而实现了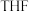 与
与 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。
③分离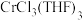 :回流
:回流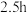 ,再通入
,再通入 冷却至室温。取下双颈烧瓶,在通风橱中蒸发THF至有较多固体析出,冷却、抽滤、干燥称量,得产品
冷却至室温。取下双颈烧瓶,在通风橱中蒸发THF至有较多固体析出,冷却、抽滤、干燥称量,得产品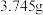 。
。
(4)球形冷凝管进水口:___________ (填“a”或“b”)。
(5)该反应不能使用明火加热的原因___________ 。
(6)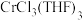 在THF中能否溶解
在THF中能否溶解___________ (填“能”或“否”)。
(7)已知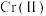 对该反应有催化作用,推断加入
对该反应有催化作用,推断加入 粉发生反应的化学方程式为:
粉发生反应的化学方程式为:___________ 。
(8)产品产率为___________ 。(结果保留3位有效数字)
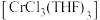 可催化烯烃加聚,制备的方法如下:
可催化烯烃加聚,制备的方法如下:已知:①
 易潮解,易升华,高温下易被氧气氧化。
易潮解,易升华,高温下易被氧气氧化。②
 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。③
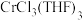 摩尔质量为
摩尔质量为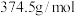 。
。④四氢呋喃(THF)结构简式:

I.制备无水
 :
:某化学小组用
 和
和 (沸点
(沸点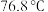 )在高温下制备无水
)在高温下制备无水 ,同时生成
,同时生成 气体,实验装置如图所示:
气体,实验装置如图所示:
(1)装置乙名称为
(2)实验装置合理的连接顺序为A→C→F→
(3)尾气处理时发生反应的离子方程式:
II.合成
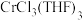 :
:实验室在非水体系中合成
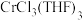 原理为:
原理为: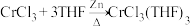

实验操作:
①填装反应物:称取
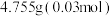 无水
无水 和
和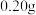 锌粉放入滤纸套筒内,双颈烧瓶中加入
锌粉放入滤纸套筒内,双颈烧瓶中加入 无水
无水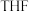 (四氢呋喃,过量)。
(四氢呋喃,过量)。②合成
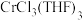 :先通入一段时间
:先通入一段时间 后,然后在球形冷凝管中通入冷却水,加热THF至沸腾,THF蒸气通过联接管进入提取管中,在冷凝管中冷凝回流到滤纸套筒中进行反应,当滤纸套筒中的液面高于虹吸管最高处时,发生虹吸现象,滤纸套筒中的液体流入双颈烧瓶,从而实现了
后,然后在球形冷凝管中通入冷却水,加热THF至沸腾,THF蒸气通过联接管进入提取管中,在冷凝管中冷凝回流到滤纸套筒中进行反应,当滤纸套筒中的液面高于虹吸管最高处时,发生虹吸现象,滤纸套筒中的液体流入双颈烧瓶,从而实现了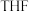 与
与 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。③分离
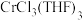 :回流
:回流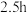 ,再通入
,再通入 冷却至室温。取下双颈烧瓶,在通风橱中蒸发THF至有较多固体析出,冷却、抽滤、干燥称量,得产品
冷却至室温。取下双颈烧瓶,在通风橱中蒸发THF至有较多固体析出,冷却、抽滤、干燥称量,得产品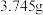 。
。(4)球形冷凝管进水口:
(5)该反应不能使用明火加热的原因
(6)
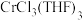 在THF中能否溶解
在THF中能否溶解(7)已知
 对该反应有催化作用,推断加入
对该反应有催化作用,推断加入 粉发生反应的化学方程式为:
粉发生反应的化学方程式为:(8)产品产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】铜是人类最早使用 金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
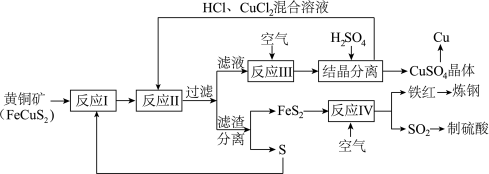
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中Fe的化合价__________ 。
(2)写出一条能使反应I充分进行的措施是_______________________________ 。
(3)反应III的离子方程式为_________________________________ 。向反应III后的溶液中加入稀硫酸结晶分离的具体操作为 ____________________ 。
(4)反应IV的化学方程式为____________________________________ 。反应IV中,也可以氨水吸收尾气SO2再制成化学肥料,写出氨水吸收SO2的化学方程式_________________
(5)该流程中,可循环利用的物质除CuCl2外,还有___________________ (填化学式)。
 金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中Fe的化合价
(2)写出一条能使反应I充分进行的措施是
(3)反应III的离子方程式为
(4)反应IV的化学方程式为
(5)该流程中,可循环利用的物质除CuCl2外,还有
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】I彩色水泥墙含氯化亚钴可作晴雨表。下表为几种氯化亚钻的晶体颜色:
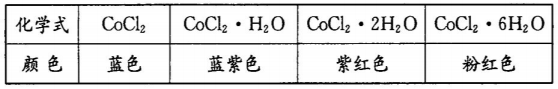
淋雨时彩色水泥墙的颜色为________ 。
Ⅱ从含钻废料(含CoO、Co2O3及金属Al、Li)中制取粗CoO的流程如下:
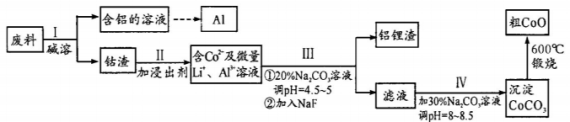
(1)步骤I产生的气体是________ (填化学式,下同),从含铝溶液中沉淀铝可通入的气体是________ 。
(2)步骤Ⅲ中除去A13+的离子方程式为________ ,步骤Ⅳ中Na2CO3溶液的作用是________ (用离子方程式表示)。
(3)为了获得高纯度的钴粉,从环保角度考虑,还原Co2O3的试剂为________ (填序号)。
A.铝 B.木炭 C氢气 D.一氧化碳
(4)实验室制备氯化亚钴晶体并测其化学式的流程如下:

①步骤Ⅱ“系列操作”中洗涤晶体不用蒸馏水而用酒精,目的是________ 。
②用灼烧一称重法测定氯化亚钴晶体中结晶水含量时,需要在氯化氢氛围中灼烧结晶水合物,请结合方程式解释这样做的原因________ 。
③已知几种物质在20℃时的Ksp如下表:

某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是________ (填编号)。
A KCl B KSCN C K2S D K2CrO4
若取样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用c mol / L AgNO3溶液滴定至终点消耗标准溶液bmL,则x的表达式为________ 。

淋雨时彩色水泥墙的颜色为
Ⅱ从含钻废料(含CoO、Co2O3及金属Al、Li)中制取粗CoO的流程如下:

(1)步骤I产生的气体是
(2)步骤Ⅲ中除去A13+的离子方程式为
(3)为了获得高纯度的钴粉,从环保角度考虑,还原Co2O3的试剂为
A.铝 B.木炭 C氢气 D.一氧化碳
(4)实验室制备氯化亚钴晶体并测其化学式的流程如下:

①步骤Ⅱ“系列操作”中洗涤晶体不用蒸馏水而用酒精,目的是
②用灼烧一称重法测定氯化亚钴晶体中结晶水含量时,需要在氯化氢氛围中灼烧结晶水合物,请结合方程式解释这样做的原因
③已知几种物质在20℃时的Ksp如下表:

某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是
A KCl B KSCN C K2S D K2CrO4
若取样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用c mol / L AgNO3溶液滴定至终点消耗标准溶液bmL,则x的表达式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】形状记忆陶瓷目前尚处于研究阶段,其中一种形状记忆陶瓷的主要原材料是纳米级ZrO2,用锆石(ZrSiO4,含少量FeO、Al2O3和SiO2)制备纳米级ZrO2的流程设计如图:

查阅资料知:Ksp[Fe(OH)3]=1.0×10-38 ,回答下列问题。
(1)锆石“粉碎过筛”的目的是_______ 。
(2)“酸浸”过程中发生的氧化还原反应的离子方程式为_______ 。滤渣1的主要成分是_______ 。若室温下Ksp[Cu(CN)2]=4×10-11,则为了使溶液中的c(Cu2+)≤1×10-5mol/L,则溶液中CN—的浓度不能低于_______ 。
(3)在空气中焙烧Zr(OH)4可以得到纳米ZrO2,若在实验室中焙烧Zr(OH)4主要使用的陶瓷仪器是_______ ,工业生产中常常用无水乙醇洗涤Zr(OH)4,除了可以使纳米级ZrO2纯度更高、颗粒更细外,还可以_______ 。
(4)酸浸时,得到的溶质主要是ZrOCl2,而不是预想中的ZrCl4,说明ZrCl4很容易水解,则ZrCl4水解产生ZrOCl2的化学方程式是_______ 。
(5)若锆石中含有ZrSiO4的质量分数是54.9%,在制备ZrO2的过程中损失10%的锆元素,则1kg锆石理论上能够制得ZrO2的质量是_______ g。
(6)除Fe3+也可以用合适的萃取剂,Fe3+的萃取率与pH的关系如图所示,pH>1.7后,随pH增大,Fe3+萃取率下降的原因是_______ 。


查阅资料知:Ksp[Fe(OH)3]=1.0×10-38 ,回答下列问题。
(1)锆石“粉碎过筛”的目的是
(2)“酸浸”过程中发生的氧化还原反应的离子方程式为
(3)在空气中焙烧Zr(OH)4可以得到纳米ZrO2,若在实验室中焙烧Zr(OH)4主要使用的陶瓷仪器是
(4)酸浸时,得到的溶质主要是ZrOCl2,而不是预想中的ZrCl4,说明ZrCl4很容易水解,则ZrCl4水解产生ZrOCl2的化学方程式是
(5)若锆石中含有ZrSiO4的质量分数是54.9%,在制备ZrO2的过程中损失10%的锆元素,则1kg锆石理论上能够制得ZrO2的质量是
(6)除Fe3+也可以用合适的萃取剂,Fe3+的萃取率与pH的关系如图所示,pH>1.7后,随pH增大,Fe3+萃取率下降的原因是

您最近一年使用:0次



