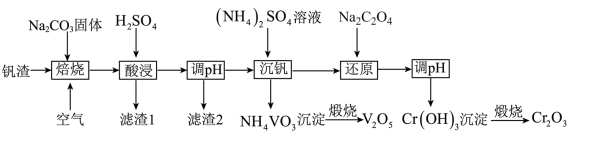
某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________ 和_______ 。
(2)滤渣1中主要含______ 。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______ 。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______ ,NH4VO3煅烧过程中的化学方程式是______ 。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________ 。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____ ,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______ (保留两位有效数字)。
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为
(2)滤渣1中主要含
(3)“沉钒”时的离子方程式是
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
更新时间:2020-05-05 00:11:09
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
【推荐1】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或溶液,从而实现Cl-、SO 和NO
和NO 的相互分离。相应的实验过程可用如图表示:
的相互分离。相应的实验过程可用如图表示:
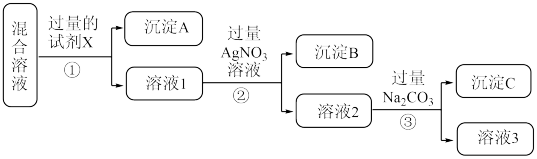
请回答下列问题:
(1)写出实验流程中下列物质的化学式。
试剂X:______ ,沉淀A:______ ,沉淀B:______ 。
(2)上述实验流程中加入过量Na2CO3的目的是______________________________ 。
(3)按此实验方案得到的溶液3中肯定含有____________ (填化学式)杂质,除去该杂质应向溶液3中加入________ 溶液,该反应的离子方程式为______________________________________ 。
 和NO
和NO 的相互分离。相应的实验过程可用如图表示:
的相互分离。相应的实验过程可用如图表示:
请回答下列问题:
(1)写出实验流程中下列物质的化学式。
试剂X:
(2)上述实验流程中加入过量Na2CO3的目的是
(3)按此实验方案得到的溶液3中肯定含有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】 主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为
主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为 ,含少量
,含少量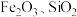 及铝、镁、钙等金属元素的氧化物)制取
及铝、镁、钙等金属元素的氧化物)制取 的工艺流程如图所示。
的工艺流程如图所示。 等。
等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的 如下表:
如下表:
回答下列问题:
(1)“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是___________ (写出一种即可)。
(2)加入 的作用是还原
的作用是还原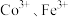 ,写出
,写出 的与
的与 反应的离子方程式
反应的离子方程式___________ 。“氧化”过程中被氧化的离子是___________ 。
(3)滤渣2的主要成分为___________ (写化学式),检验铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,___________ 。
(4)已知某温度下 。该温度下,沉淀除杂时加入足量的
。该温度下,沉淀除杂时加入足量的 溶液可将
溶液可将 沉淀除去,若所得滤液中
沉淀除去,若所得滤液中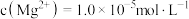 ,则滤液中
,则滤液中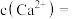
___________ 。
(5) 在空气中充分煅烧,除得到产品外还生成了
在空气中充分煅烧,除得到产品外还生成了 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
 主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为
主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为 ,含少量
,含少量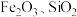 及铝、镁、钙等金属元素的氧化物)制取
及铝、镁、钙等金属元素的氧化物)制取 的工艺流程如图所示。
的工艺流程如图所示。
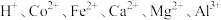 等。
等。②部分阳离子以氢氧化物形式完全沉淀时溶液的
 如下表:
如下表:| 沉淀物 |  |  |  |  |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 |
(1)“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是
(2)加入
 的作用是还原
的作用是还原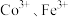 ,写出
,写出 的与
的与 反应的离子方程式
反应的离子方程式(3)滤渣2的主要成分为
(4)已知某温度下
 。该温度下,沉淀除杂时加入足量的
。该温度下,沉淀除杂时加入足量的 溶液可将
溶液可将 沉淀除去,若所得滤液中
沉淀除去,若所得滤液中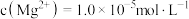 ,则滤液中
,则滤液中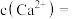
(5)
 在空气中充分煅烧,除得到产品外还生成了
在空气中充分煅烧,除得到产品外还生成了 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
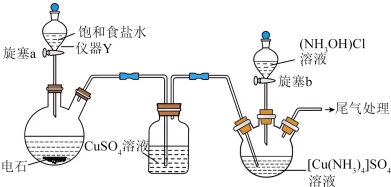
【推荐3】乙炔亚铜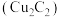 是一种难溶于水的暗红色固体,是一种对热和冲击敏感的高爆炸药。某研究性学习小组利用电石(含少量
是一种难溶于水的暗红色固体,是一种对热和冲击敏感的高爆炸药。某研究性学习小组利用电石(含少量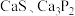 )通过如图实验装置制备少量
)通过如图实验装置制备少量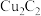 :
: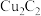 的原理为
的原理为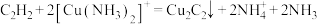 ;
;
② 在水溶液中为无色离子。
在水溶液中为无色离子。
(1)仪器 的名称为
的名称为___________ ;装置组装后,首先进行的操作是___________ 。
(2) 溶液的作用是
溶液的作用是___________ 。
(3)实验进行过程中先打开旋塞___________ ,待观察到___________ 的现象时,再打开旋塞___________ 。逸出的尾气中含有 ,三口烧瓶中
,三口烧瓶中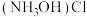 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)有同学提出 可能会影响
可能会影响 的生成速率。为证实该设想设计下表实验
的生成速率。为证实该设想设计下表实验
①通过实验Ⅰ和Ⅱ说明 越小,
越小, 的生成速率越慢,则
的生成速率越慢,则 和
和 的关系是
的关系是___________ 。
②实验测得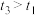 ,其可能原因是
,其可能原因是___________ 。
③实验Ⅳ中 选用
选用___________ (填化学式)进行实验,可能可以说明 越大,
越大, 的生成速率越快。
的生成速率越快。
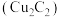 是一种难溶于水的暗红色固体,是一种对热和冲击敏感的高爆炸药。某研究性学习小组利用电石(含少量
是一种难溶于水的暗红色固体,是一种对热和冲击敏感的高爆炸药。某研究性学习小组利用电石(含少量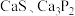 )通过如图实验装置制备少量
)通过如图实验装置制备少量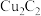 :
:
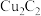 的原理为
的原理为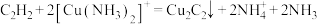 ;
;②
 在水溶液中为无色离子。
在水溶液中为无色离子。(1)仪器
 的名称为
的名称为(2)
 溶液的作用是
溶液的作用是(3)实验进行过程中先打开旋塞
 ,三口烧瓶中
,三口烧瓶中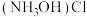 发生反应的离子方程式为
发生反应的离子方程式为(4)有同学提出
 可能会影响
可能会影响 的生成速率。为证实该设想设计下表实验
的生成速率。为证实该设想设计下表实验| 实验序号 | 与电石反应的试剂 | 收集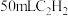 所需时间 所需时间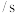 |
| Ⅰ | 蒸馏水 |  |
| Ⅱ |  氢氧化钠溶液 氢氧化钠溶液 |  |
| Ⅲ | 硫酸溶液( 稀释) 稀释) |  |
| Ⅳ | X | 待测 |
 越小,
越小, 的生成速率越慢,则
的生成速率越慢,则 和
和 的关系是
的关系是②实验测得
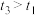 ,其可能原因是
,其可能原因是③实验Ⅳ中
 选用
选用 越大,
越大, 的生成速率越快。
的生成速率越快。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:

(1)请写出一种能提高“酸浸”速率的措施:________________________ ;滤渣I的成分是____________ (填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
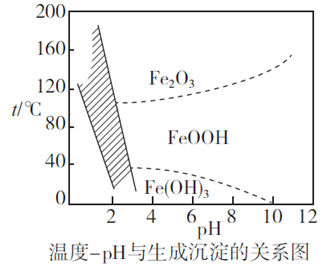
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________ (填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________ 。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________ mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________ 。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________ 。
②该镀镍试剂的化学式为________________________________ 。

(1)请写出一种能提高“酸浸”速率的措施:
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:

①若控制温度40℃、pH=8,则滤渣II的主要成分为
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=
(4)加入有机萃取剂的作用是
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要
②该镀镍试剂的化学式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备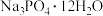 和
和 的流程如图所示:
的流程如图所示:
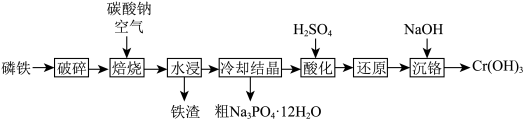
已知:水浸后溶液的主要成分为 和
和 ;
; 的
的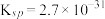 回答下列问题:
回答下列问题:
(1)“破碎”的目的为________________________________________________________ 。
(2)“焙烧”时,应将原料加到________ 坩埚中(填“陶瓷”或“钢制”),原因是_____________ (结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________ 。
(3)进一步提纯粗磷酸钠晶体的方法为________________ 。
(4)“酸化”时发生反应的离子方程式为________________________________________________ 。
(5)“沉铬”时,加NaOH调节至pH为________ 时,铬离子刚好沉淀完全。(已知: ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
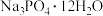 和
和 的流程如图所示:
的流程如图所示:
已知:水浸后溶液的主要成分为
 和
和 ;
; 的
的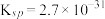 回答下列问题:
回答下列问题:(1)“破碎”的目的为
(2)“焙烧”时,应将原料加到
(3)进一步提纯粗磷酸钠晶体的方法为
(4)“酸化”时发生反应的离子方程式为
(5)“沉铬”时,加NaOH调节至pH为
 ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】以燃煤烟气(含SO2、O2等)和软锰矿粉(主要成分为MnO2,含少量Fe、Al的氧化物杂质)为原料可制备高纯度锰的氧化物。
(1)向一定量软锰矿浊液中匀速通入燃煤烟气,反应装置如图1所示,溶液中H2SO4和MnSO4的浓度随吸收时间的变化如图2所示。


①MnO2和SO2反应的化学方程式为___________ ;采用水浴降温的目的是___________ 。
②在吸收反应的过程中,H2SO4的生成速率逐渐加快,其主要原因是___________ 。
(2)向吸收液中滴加NaOH溶液,调节pH除杂,已知溶液中c(Mn2+)=0.2mol/L,若要使溶液中c(Fe2+)、c(Al3+)降低到10-6mol/L,需要控制pH范围为___________ 。{已知:室温下Ksp[Al(OH)3]=10-33、Ksp[Fe(OH)3]=3×10-39、Ksp[Mn(OH)2]=2×10-13}
(3)向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀,___________ 得到碳酸锰。
(4)将MnCO3边通O2边加热,在750K~850K时,得到稳定的氧化物产品甲,此时残留固体的质量为原样品质量的75.7%,在900K~1000K时,得到稳定的氧化物产品乙,此时残留固体的质量为原样品质量的68.7%,甲的化学式为___________ ,乙的化学式为___________ 。
(1)向一定量软锰矿浊液中匀速通入燃煤烟气,反应装置如图1所示,溶液中H2SO4和MnSO4的浓度随吸收时间的变化如图2所示。


①MnO2和SO2反应的化学方程式为
②在吸收反应的过程中,H2SO4的生成速率逐渐加快,其主要原因是
(2)向吸收液中滴加NaOH溶液,调节pH除杂,已知溶液中c(Mn2+)=0.2mol/L,若要使溶液中c(Fe2+)、c(Al3+)降低到10-6mol/L,需要控制pH范围为
(3)向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀,
(4)将MnCO3边通O2边加热,在750K~850K时,得到稳定的氧化物产品甲,此时残留固体的质量为原样品质量的75.7%,在900K~1000K时,得到稳定的氧化物产品乙,此时残留固体的质量为原样品质量的68.7%,甲的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某化学兴趣小组设计了研究溴苯制备原理并检验产物的实验,部分物质数据如下:苯密度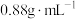 ,沸点
,沸点 ℃:溴苯密度
℃:溴苯密度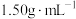 ,沸点
,沸点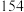 ℃。请回答下列问题:
℃。请回答下列问题:
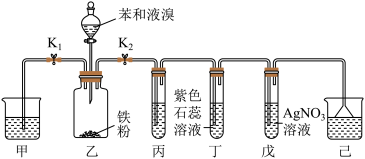
I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。_______ 。
(2)溴苯的制备需在无水条件下进行,原因是_______ 。
(3)装置丙中应该盛装_______ (填试剂名称)。能够证明该反应为取代反应的实验现象为_______ ;若撤去装置丙,_______ (填“能”或“不能”)证明该反应为取代反应。
Ⅱ.溴苯的精制如下图所示: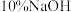 溶液洗涤时,反应的离子方程式为
溶液洗涤时,反应的离子方程式为_______ 。
(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为_______ (填操作名称)。
(6)若实验时使用 苯,最终精制得到
苯,最终精制得到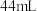 溴苯,则溴苯的产率为
溴苯,则溴苯的产率为_______ (保留两位有效数字)。
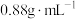 ,沸点
,沸点 ℃:溴苯密度
℃:溴苯密度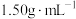 ,沸点
,沸点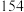 ℃。请回答下列问题:
℃。请回答下列问题:I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。
(2)溴苯的制备需在无水条件下进行,原因是
(3)装置丙中应该盛装
Ⅱ.溴苯的精制如下图所示:
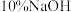 溶液洗涤时,反应的离子方程式为
溶液洗涤时,反应的离子方程式为(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为
(6)若实验时使用
 苯,最终精制得到
苯,最终精制得到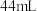 溴苯,则溴苯的产率为
溴苯,则溴苯的产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】I.一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.某同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷.

(1)无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为__________________________
(2)装置B的主要作用是____________________
(3)收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L﹣1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L﹣1盐酸标准液对吸收液进行返滴定(发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为_______ mol.
(已知:2CH3Cl+3O2 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
II. 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O==Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)实验室进行“过滤”操作使用的玻璃仪器除烧杯外主要有____________________________________ 。
(2)流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是________________________________________ 。

(1)无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为
(2)装置B的主要作用是
(3)收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L﹣1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L﹣1盐酸标准液对吸收液进行返滴定(发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为
(已知:2CH3Cl+3O2
 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)II. 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O==Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)实验室进行“过滤”操作使用的玻璃仪器除烧杯外主要有
(2)流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
您最近一年使用:0次
【推荐3】工业上常用炼钢残渣(主要含FeO•V2O3,还有少量铁粉、SiO2、Al2O3等杂质)为原料提取金属钒,其工艺流程如图所示:

已知:焙烧后铁全部转化为+3价氧化物。
(1)“研磨”的目的是______ ,“磁选”后分离出的X为______ 。
(2)“焙烧”过程中,若转移电子数为2.5NA,则被氧化的FeO•V2O3为______ mol。
(3)“酸浸”时,生成V2O5的离子方程式为______ 。
(4)若“沉钒”前溶液中c(VO )=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH
)=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH )=
)=______ mol•L-1(已知:常温下,Ksp(NH4VO3)=1.6×10-3)。“沉钒”过程中,加入稀H2SO4,其目的是______ 。
(5)检验NH4VO3沉淀是否洗净的操作是______ 。
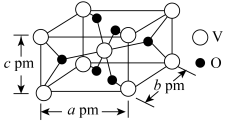
(6)一种含钒的氧化物晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,则该晶体密度为______ g•cm-3 (列出计算式即可)。

已知:焙烧后铁全部转化为+3价氧化物。
(1)“研磨”的目的是
(2)“焙烧”过程中,若转移电子数为2.5NA,则被氧化的FeO•V2O3为
(3)“酸浸”时,生成V2O5的离子方程式为
(4)若“沉钒”前溶液中c(VO
 )=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH
)=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH )=
)=(5)检验NH4VO3沉淀是否洗净的操作是
(6)一种含钒的氧化物晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,则该晶体密度为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣(主要含铁酸镓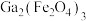 、铁酸锌
、铁酸锌 、
、 、
、 )制备GaN的工艺流程如下:
)制备GaN的工艺流程如下:

已知:①常温下,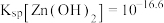 ,
, ,
, 。
。
②Ga与Al同主族,化学性质相似。
③ 、
、 的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1)基态镓的电子排布式为________ ,GaN晶胞结构与金刚石类似,其中N原子的轨道杂化类型为________ 。
(2)提高“酸溶”时溶出率的方法有________ (任写2种)。
(3)酸浸时 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(4)“酸浸”所得浸出液中 、
、 浓度分别为
浓度分别为 、
、 。常温下,为尽可能多地提取
。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,“调pH”时需用CaO调节pH的范围为
,“调pH”时需用CaO调节pH的范围为________ (假设调pH时溶液体积不变);“酸溶”所得滤渣的主要成分是________ (填化学式)。
(5)“脱铁”和“反萃取”时,所用盐酸的浓度
________ ,
________ (选填上表中盐酸的浓度)。
(6)“沉镓”时,若加入NaOH的量过多,会导致 的沉淀率降低,原因是
的沉淀率降低,原因是________ (用离子方程式表示)。
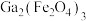 、铁酸锌
、铁酸锌 、
、 、
、 )制备GaN的工艺流程如下:
)制备GaN的工艺流程如下:
已知:①常温下,
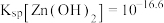 ,
, ,
, 。
。②Ga与Al同主族,化学性质相似。
③
 、
、 的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。盐酸浓度/ | 反萃取率/% | |
 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)基态镓的电子排布式为
(2)提高“酸溶”时溶出率的方法有
(3)酸浸时
 发生反应的化学方程式为
发生反应的化学方程式为(4)“酸浸”所得浸出液中
 、
、 浓度分别为
浓度分别为 、
、 。常温下,为尽可能多地提取
。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,“调pH”时需用CaO调节pH的范围为
,“调pH”时需用CaO调节pH的范围为(5)“脱铁”和“反萃取”时,所用盐酸的浓度


(6)“沉镓”时,若加入NaOH的量过多,会导致
 的沉淀率降低,原因是
的沉淀率降低,原因是
您最近一年使用:0次
【推荐2】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂( )做电极材料。对
)做电极材料。对 废旧电极(含杂质
废旧电极(含杂质 、石墨粉)回收并获得高纯
、石墨粉)回收并获得高纯 的工业流程图如下:
的工业流程图如下:
(1)过程ⅰ研磨粉碎的目的是___________ 。
(2)过程ⅱ加入足量 溶液的目的是除去
溶液的目的是除去 ,相关离子方程式为
,相关离子方程式为___________ 。
(3)过程ⅲ采用不同氧化剂分别进行实验,均采用 含量为3.7%的原料,控制
含量为3.7%的原料,控制 为3.5,浸取1.5h后,实验结果如下表所示:
为3.5,浸取1.5h后,实验结果如下表所示:
①实验2中, 能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为
能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为___________ 。
②过程ⅱ最终选择 作为氧化剂,原因是
作为氧化剂,原因是___________ 。
③过程ⅲ得到的浸出液循环两次的目的是___________ 。
(4)浸出液中存在大量 和
和 。结合
。结合平衡移动 原理,解释过程ⅳ得到磷酸铁晶体的原因___________ 。
(5)对比过程ⅳ和ⅴ,说明过程ⅳ不用饱和 溶液的原因:
溶液的原因:___________ 。
(6)过程ⅵ的操作为:将 粗品加水溶解,蒸发结晶至有大量固体析出,
粗品加水溶解,蒸发结晶至有大量固体析出,___________ 。
 )做电极材料。对
)做电极材料。对 废旧电极(含杂质
废旧电极(含杂质 、石墨粉)回收并获得高纯
、石墨粉)回收并获得高纯 的工业流程图如下:
的工业流程图如下:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程ⅰ研磨粉碎的目的是
(2)过程ⅱ加入足量
 溶液的目的是除去
溶液的目的是除去 ,相关离子方程式为
,相关离子方程式为(3)过程ⅲ采用不同氧化剂分别进行实验,均采用
 含量为3.7%的原料,控制
含量为3.7%的原料,控制 为3.5,浸取1.5h后,实验结果如下表所示:
为3.5,浸取1.5h后,实验结果如下表所示:| 序号 | 酸 | 氧化剂 | 浸出液中 浓度( 浓度(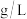 ) ) | 滤渣中 含量/% 含量/% |
| 实验1 |  |  | 9.02 | 0.10 |
| 实验2 |  |  | 9.05 | 0.08 |
| 实验3 |  |  | 7.05 | 0.93 |
 能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为
能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为②过程ⅱ最终选择
 作为氧化剂,原因是
作为氧化剂,原因是③过程ⅲ得到的浸出液循环两次的目的是
(4)浸出液中存在大量
 和
和 。结合
。结合(5)对比过程ⅳ和ⅴ,说明过程ⅳ不用饱和
 溶液的原因:
溶液的原因:(6)过程ⅵ的操作为:将
 粗品加水溶解,蒸发结晶至有大量固体析出,
粗品加水溶解,蒸发结晶至有大量固体析出,
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】铬酰氯( )可在有机合成中作氯化剂。某兴趣小组用
)可在有机合成中作氯化剂。某兴趣小组用 与HCl反应制备液态
与HCl反应制备液态 ,实验装置如图。
,实验装置如图。
① 的沸点是117℃,易挥发、易水解。
的沸点是117℃,易挥发、易水解。
② 水解反应:
水解反应: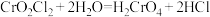
请回答:
(1)仪器X的名称是___________ 。
(2)完善虚框内的装置排序:____ 。
____→C→____→____→____→尾气处理装置
(3)尾气处理装置中最合理的是___________ 。___________ 。
(5)下列说法正确的是___________
(6)取1.60g 产品,控制pH值为6.5-10.5,滴加
产品,控制pH值为6.5-10.5,滴加 溶液至沉淀出现砖红色时,停止滴加,将沉淀经过滤、洗涤、干燥后称量为2.87g。产品的纯度为
溶液至沉淀出现砖红色时,停止滴加,将沉淀经过滤、洗涤、干燥后称量为2.87g。产品的纯度为___________ 。(结果保留3位有效数字)。
 )可在有机合成中作氯化剂。某兴趣小组用
)可在有机合成中作氯化剂。某兴趣小组用 与HCl反应制备液态
与HCl反应制备液态 ,实验装置如图。
,实验装置如图。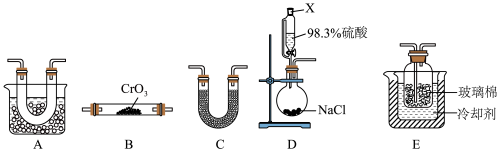
①
 的沸点是117℃,易挥发、易水解。
的沸点是117℃,易挥发、易水解。②
 水解反应:
水解反应: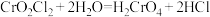
请回答:
(1)仪器X的名称是
(2)完善虚框内的装置排序:
____→C→____→____→____→尾气处理装置
(3)尾气处理装置中最合理的是
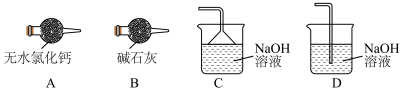
(5)下列说法正确的是___________
| A.该实验操作须在通风橱中进行 |
| B.浓硫酸在反应前可预冷却至0℃左右,以防止反应速率过快 |
| C.加入过量NaCl固体,有利于产生过量的氯化氢,可以提高铬酰氯的产率 |
| D.装置C中可盛放碱石灰 |
(6)取1.60g
 产品,控制pH值为6.5-10.5,滴加
产品,控制pH值为6.5-10.5,滴加 溶液至沉淀出现砖红色时,停止滴加,将沉淀经过滤、洗涤、干燥后称量为2.87g。产品的纯度为
溶液至沉淀出现砖红色时,停止滴加,将沉淀经过滤、洗涤、干燥后称量为2.87g。产品的纯度为
您最近一年使用:0次



