已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,甲、乙可化合生成离子化合物丙。试回答下列问题:
(1)W元素在周期表中的位置是_________ ;甲的空间构型为___________ 。
(2)丙的水溶液呈酸性,用离子方程式表示其原因____________________________ 。
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式_________________ ;X、Y组成的液态化合物Y2X416克与足量丁反应生成Y2和液态水,放出Q kJ的热量,请写出该反应的热化学方程式___________
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为____________________ 。
(1)W元素在周期表中的位置是
(2)丙的水溶液呈酸性,用离子方程式表示其原因
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为
10-11高一·山西忻州·阶段练习 查看更多[1]
(已下线)2012届山西省忻州一中高三第一次四校联考化学试卷
更新时间:2016-12-09 02:06:12
|
相似题推荐
【推荐1】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式_______________________________________ 。

(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
请回答下列问题:
①试比较K1、K2的大小,K1_________ K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的平衡常数K为
N2(g)+3H2(g)的平衡常数K为______ 。当测得NH3、N2、H2的浓度分别为3 mol • L−1、2 mol • L−1、1 mol • L−1时,则该反应的v正(N2)____ v逆(N2)(填”>”“=“或”<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
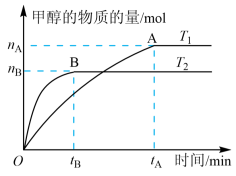
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______ mol·L−1·min−1。
②图示的温度T1______ T2(填写“>”、“<”或“=”)。
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。
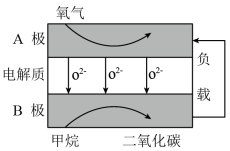
①B电极的反应式为_____________________________________ 。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L−1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________ (标准状况)。
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式

(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的平衡常数K为
N2(g)+3H2(g)的平衡常数K为(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=
②图示的温度T1
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L−1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】丙烯腈(C3H3N)是一种重要的化工原料,以丙烯(C3H6)、NH3、O2为原料,选择合适的催化剂合成丙烯腈的主要反应如下:
反应Ⅰ:
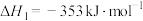
反应Ⅱ: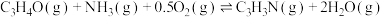
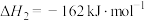
反应Ⅲ: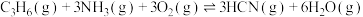

(1) ℃时,向恒压容器中充入0.2mol
℃时,向恒压容器中充入0.2mol  、0.6mol
、0.6mol  和0.6mol
和0.6mol  ,发生反应Ⅲ,达到平衡时,放出94.1kJ能量;若向相同容器中充入1.5mol HCN(g)和3mol
,发生反应Ⅲ,达到平衡时,放出94.1kJ能量;若向相同容器中充入1.5mol HCN(g)和3mol  (g),达平衡时吸收235.25kJ能量,则
(g),达平衡时吸收235.25kJ能量,则
_______  ;两种情况下反应物的转化率
;两种情况下反应物的转化率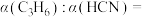
_______ 。
(2)200℃,160Pa时,向恒压容器中充入 、
、 和
和 的混和气体制取丙烯腈,发生上述三个反应。平衡后,测得
的混和气体制取丙烯腈,发生上述三个反应。平衡后,测得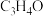 (g)、
(g)、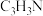 (g)、HCN(g)的体积分数分别为6%、10%、6%,其中三种反应物的体积分数相等。则
(g)、HCN(g)的体积分数分别为6%、10%、6%,其中三种反应物的体积分数相等。则 (g)的体积分数为
(g)的体积分数为_______ ,丙烯腈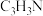 (g)的产率为
(g)的产率为_______ (保留3位有效数字),反应Ⅱ的
_______ 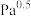 。(已知:
。(已知: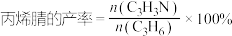 )
)
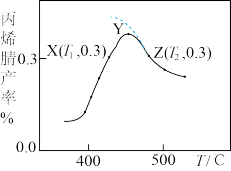
(3)反应时间相同、反应物起始投料相同时,丙烯腈产率与反应温度的关系如图所示(图中虚线表示相同条件下丙烯腈平衡产率随温度的变化)。Y点丙烯腈产率比X点高的原因是_______ 。Z点正反应速率_______ X点正反应速率(填“>”、“<”或“无法比较”),理由是_______ 。
反应Ⅰ:

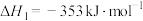
反应Ⅱ:
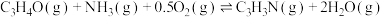
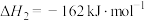
反应Ⅲ:
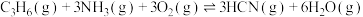

(1)
 ℃时,向恒压容器中充入0.2mol
℃时,向恒压容器中充入0.2mol  、0.6mol
、0.6mol  和0.6mol
和0.6mol  ,发生反应Ⅲ,达到平衡时,放出94.1kJ能量;若向相同容器中充入1.5mol HCN(g)和3mol
,发生反应Ⅲ,达到平衡时,放出94.1kJ能量;若向相同容器中充入1.5mol HCN(g)和3mol  (g),达平衡时吸收235.25kJ能量,则
(g),达平衡时吸收235.25kJ能量,则
 ;两种情况下反应物的转化率
;两种情况下反应物的转化率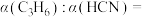
(2)200℃,160Pa时,向恒压容器中充入
 、
、 和
和 的混和气体制取丙烯腈,发生上述三个反应。平衡后,测得
的混和气体制取丙烯腈,发生上述三个反应。平衡后,测得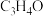 (g)、
(g)、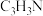 (g)、HCN(g)的体积分数分别为6%、10%、6%,其中三种反应物的体积分数相等。则
(g)、HCN(g)的体积分数分别为6%、10%、6%,其中三种反应物的体积分数相等。则 (g)的体积分数为
(g)的体积分数为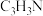 (g)的产率为
(g)的产率为
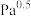 。(已知:
。(已知: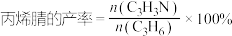 )
)(3)反应时间相同、反应物起始投料相同时,丙烯腈产率与反应温度的关系如图所示(图中虚线表示相同条件下丙烯腈平衡产率随温度的变化)。Y点丙烯腈产率比X点高的原因是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】研究CO2的转化可实现碳的循环利用。在反应器内CO2和H2在催化剂作用下可发生如下反应:
I.

Ⅱ.

(1)反应I的历程如图所示,其中吸附在催化剂表面上的物种用*标注。

下列说法不正确的是_______。
(2)若反应Ⅱ的正、逆反应速率分别表示为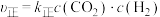 ,
,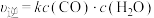 ,
, 、
、 分别为正、逆反应速率常数,c为物质的量浓度。
分别为正、逆反应速率常数,c为物质的量浓度。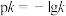 ,如图中有表示反应Ⅱ的正、逆反应速率常数随温度
,如图中有表示反应Ⅱ的正、逆反应速率常数随温度 变化的图像,若A、B、C、D点的纵坐标分别为
变化的图像,若A、B、C、D点的纵坐标分别为 、
、 、
、 、
、 ,则温度
,则温度 时反应Ⅱ的化学平衡常数
时反应Ⅱ的化学平衡常数
_______ 。

(3)在恒压条件下,CO2和H2发生反应I、反应Ⅱ,反应相同时间,测得不同温度下CO2的转化率和CH3OH的选择性如下图中实验值所示。图中平衡值表示相同条件下平衡状态CO2的转化率和CH3OH的选择性随温度的变化[CH3OH的选择性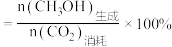 ]
]

① 时,测得反应器出口气体中全部含碳物质的物质的量之比
时,测得反应器出口气体中全部含碳物质的物质的量之比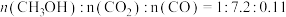 ,则该温度下CO2转化率
,则该温度下CO2转化率
_______ 。(结果保留1位小数)。
② 甲醇的平衡选择性随温度升高而降低的原因可能是
甲醇的平衡选择性随温度升高而降低的原因可能是_______ 。
③ 时,甲醇产率的实验值是
时,甲醇产率的实验值是_______ 。
(4)若只考虑反应I,在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O,甲醇产率先增大后减小的原因是_______ ;请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线_______ 。

I.


Ⅱ.


(1)反应I的历程如图所示,其中吸附在催化剂表面上的物种用*标注。

下列说法不正确的是_______。
A.该反应的 ,能低温自发 ,能低温自发 |
B.该历程中最小能垒(活化能)步骤的化学方程式为: |
| C.催化剂可以降低反应活化能和反应热,但对反应物的转化率无影响 |
D.最后一步是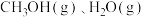 从催化剂表面的解吸过程, 从催化剂表面的解吸过程,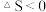 |
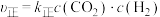 ,
,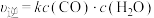 ,
, 、
、 分别为正、逆反应速率常数,c为物质的量浓度。
分别为正、逆反应速率常数,c为物质的量浓度。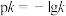 ,如图中有表示反应Ⅱ的正、逆反应速率常数随温度
,如图中有表示反应Ⅱ的正、逆反应速率常数随温度 变化的图像,若A、B、C、D点的纵坐标分别为
变化的图像,若A、B、C、D点的纵坐标分别为 、
、 、
、 、
、 ,则温度
,则温度 时反应Ⅱ的化学平衡常数
时反应Ⅱ的化学平衡常数

(3)在恒压条件下,CO2和H2发生反应I、反应Ⅱ,反应相同时间,测得不同温度下CO2的转化率和CH3OH的选择性如下图中实验值所示。图中平衡值表示相同条件下平衡状态CO2的转化率和CH3OH的选择性随温度的变化[CH3OH的选择性
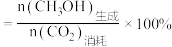 ]
]
①
 时,测得反应器出口气体中全部含碳物质的物质的量之比
时,测得反应器出口气体中全部含碳物质的物质的量之比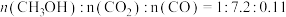 ,则该温度下CO2转化率
,则该温度下CO2转化率
②
 甲醇的平衡选择性随温度升高而降低的原因可能是
甲醇的平衡选择性随温度升高而降低的原因可能是③
 时,甲醇产率的实验值是
时,甲醇产率的实验值是(4)若只考虑反应I,在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O,甲醇产率先增大后减小的原因是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】某工业废催化剂主要成份为: 和
和 ,还有少量的
,还有少量的 和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示:
和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示:_______ (填化学式)。
(2)水浸渣的主要成份是_______ (填化学式)。
(3)“沉淀”的化学式_______ 。生成该沉淀的化学方程式_______ 。
(4)“沉钒”中需要加入过量的浓 ,结合离子方程式说明原因是
,结合离子方程式说明原因是_______ 。写出生成 的化学方程式
的化学方程式_______ 。
(5)淀粉水解液中_______ (填化学式)起还原作用,用焦亚硫酸钠( )溶液代替淀粉水解液效果相同,写出反应的离子方程式
)溶液代替淀粉水解液效果相同,写出反应的离子方程式_______ 。
(6)利用生物燃料电池原理研究室温下氨的合成,电池工作时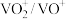 在电极与酶之间传递电子,示意图如图所示。
在电极与酶之间传递电子,示意图如图所示。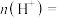
_______ mol。
 和
和 ,还有少量的
,还有少量的 和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示:
和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示: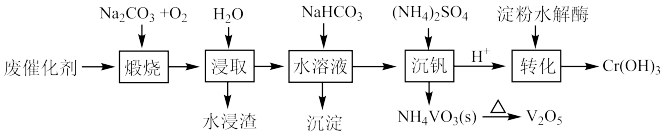
(2)水浸渣的主要成份是
(3)“沉淀”的化学式
(4)“沉钒”中需要加入过量的浓
 ,结合离子方程式说明原因是
,结合离子方程式说明原因是 的化学方程式
的化学方程式(5)淀粉水解液中
 )溶液代替淀粉水解液效果相同,写出反应的离子方程式
)溶液代替淀粉水解液效果相同,写出反应的离子方程式(6)利用生物燃料电池原理研究室温下氨的合成,电池工作时
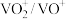 在电极与酶之间传递电子,示意图如图所示。
在电极与酶之间传递电子,示意图如图所示。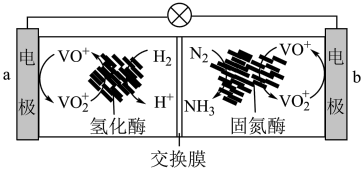
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】应用电化学原理,回答下列问题。
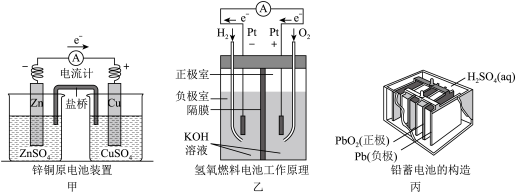
(1)甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是_______ 。
(2)乙中正极反应式为_______ ,若将H2换成CH4,则负极反应式为_______ 。
(3)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池_______ 极相连接。充电时该电极反应式_______ 。
(4)若用铅蓄电池作为电源电解硝酸银溶液500毫升,电路中转移0.2 mol电子,则溶液中氢离子浓度_______ (忽略溶液体积变化)。

(1)甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是
(2)乙中正极反应式为
(3)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池
(4)若用铅蓄电池作为电源电解硝酸银溶液500毫升,电路中转移0.2 mol电子,则溶液中氢离子浓度
您最近一年使用:0次
【推荐3】石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并利用。
(1)热分解法: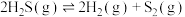
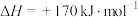 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会___________ (填“增大”、“减小”或“不变”)。
(2)氧化法: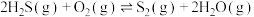
已知: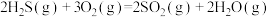
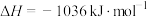
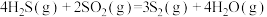
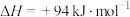
无催化剂条件下,混合加热 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。
①用氧化法处理 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为___________ kJ。
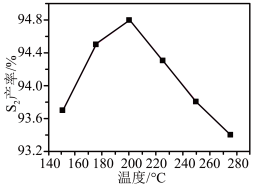
②其他条件相同时, 产率随温度的变化如图所示。随着温度升高,
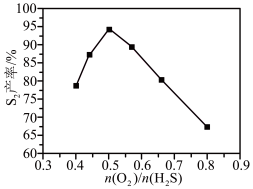
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是___________ 。
③其他条件相同时, (g)产率随
(g)产率随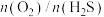 值的变化如图所示。
值的变化如图所示。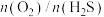 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是___________ 。
(3)微电池法:利用电化学原理去除天然气中的 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
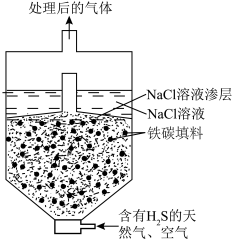
①写出负极的电极反应式___________ 。
②一段时间后,单位时间内 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是___________ 。
(4)硫酸钙吸收法:如图为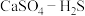 反应体系在不同温度、不同
反应体系在不同温度、不同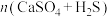 物质的量比的物相变化图。
物质的量比的物相变化图。
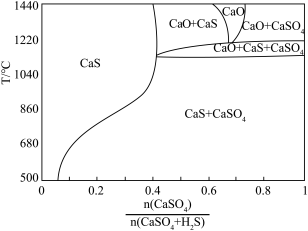
①用斜线在图中画出 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域___________ 。
②若不通入 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律___________ 。
(1)热分解法:
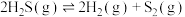
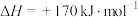 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会(2)氧化法:
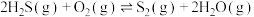
已知:
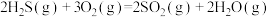
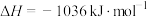
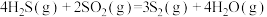
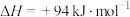
无催化剂条件下,混合加热
 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。①用氧化法处理
 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为②其他条件相同时,
 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是
③其他条件相同时,
 (g)产率随
(g)产率随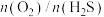 值的变化如图所示。
值的变化如图所示。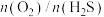 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是
(3)微电池法:利用电化学原理去除天然气中的
 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
①写出负极的电极反应式
②一段时间后,单位时间内
 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是(4)硫酸钙吸收法:如图为
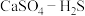 反应体系在不同温度、不同
反应体系在不同温度、不同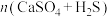 物质的量比的物相变化图。
物质的量比的物相变化图。
①用斜线在图中画出
 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域②若不通入
 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。

(1)元素③④⑤的氢化物的稳定性由强到弱的顺序是____________________ (用氢化物的化学式表示)。
(2)元素③一般在化合物中显________ 价,但在与______ 形成化合物时,所显示的价态正好相反。
(3)M、N两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式:____________________________________ 。
(4)X、Y、Z代表原子序数依次增大的三种短周期元素。在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;X、Y、Z三种元素有的是上表中编号①~⑤的元素,有的不是,请在上表中用元素符号标出不是①~⑤元素的相应位置。___________
(5)某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中的A位置包含________ (填数字)种元素。C位置中的元素是否全部是金属元素________ (填“是”或“否”)。


(1)元素③④⑤的氢化物的稳定性由强到弱的顺序是
(2)元素③一般在化合物中显
(3)M、N两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式:
(4)X、Y、Z代表原子序数依次增大的三种短周期元素。在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;X、Y、Z三种元素有的是上表中编号①~⑤的元素,有的不是,请在上表中用元素符号标出不是①~⑤元素的相应位置。
(5)某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中的A位置包含

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是_______ ,H的元素符号是_______ ,B在元素周期表中的位置是(周期、族)_______ 。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是_______ .化合物F2A2的电子式是:_______ ,构成该物质的化学键类型为_______ 。
(3)用电子式表示A的简单氢化物的形成过程如下:_______ ;G的氢化物的结构式为_______ 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式_______ 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:_______ 。
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10[ | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5[ | +7 | +1 | +5 | +3 | +6 | +1 | |
| ﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
(1)D的元素名称是
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)用电子式表示A的简单氢化物的形成过程如下:
(4)一定条件下,IA2气体与足量的A单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
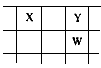
(1)五种元素形成的单质,其中固态时属于原子晶体的是________ (填化学式);常用作强氧化剂的是________ 、________ (填化学式)。
(2)这五种元素中,原子半径最大的是________ (填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________ (用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________ (用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________ 。
(4)Z与Q反应生成的化合物属于________ 化合物;电解该化合物的饱和溶液,阳极的电极反应式为________ ;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________ 。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________ 。

(1)五种元素形成的单质,其中固态时属于原子晶体的是
(2)这五种元素中,原子半径最大的是
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程
(4)Z与Q反应生成的化合物属于
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】下图表示各物质之间的转化关系。已知:
Ⅰ. A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ. G、X、Y、Z是单质,其他是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
Ⅲ. B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数B中是28%,组成B的金属元素原子核外的K层和M层电子数相同。
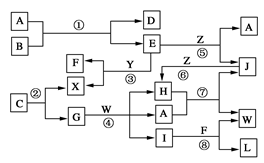
请按要求填空:
(1)写出下列物质的电子式:A______________ ,X______________ 。
(2)上述反应中属于工业上制取硝酸的反应有(填写反应代号)_______________ 。
(3)写出下列物质的化学式:B______________ ,C______________ 。
(4)反应④的化学方程式为______________________ 。
(5)保持容器的温度和体积不变,在反应③刚好完全反应时,反应前后容器的压强之比为__________ 。
Ⅰ. A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ. G、X、Y、Z是单质,其他是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
Ⅲ. B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数B中是28%,组成B的金属元素原子核外的K层和M层电子数相同。

请按要求填空:
(1)写出下列物质的电子式:A
(2)上述反应中属于工业上制取硝酸的反应有(填写反应代号)
(3)写出下列物质的化学式:B
(4)反应④的化学方程式为
(5)保持容器的温度和体积不变,在反应③刚好完全反应时,反应前后容器的压强之比为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】已知A、B、C、D是短周期元素的气态单质,其中A是黄绿色的气体单质,C在空气中含量最高,D是最轻的气体;E是一种最常用的金属;Y是一种常见的液态物质,Z是唯一显碱性的气体; M是一种红棕色的有毒气体;I为红褐色难溶于水的固体。有关的转化关系如下图所示(反应条件均已略去)。
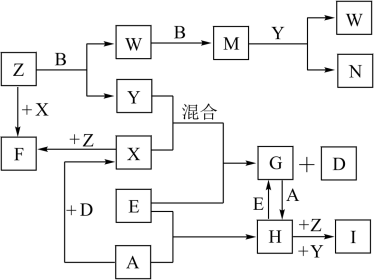
回答下列问题:
(1)A的组成元素在元素周期表的位置为_____________ ;
(2)F中化学键的类型是_____________ 、_____________ ;
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为______________________________ ;
(4)I为红褐色难溶于水的固体,与“84消毒液”的有效成分(NaClO) ,在浓碱溶液中发生反应生成了高效环保的净水剂高铁酸钠,请写出此反应的离子方程式___________ 。
(5)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为
_________ g。

回答下列问题:
(1)A的组成元素在元素周期表的位置为
(2)F中化学键的类型是
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为
(4)I为红褐色难溶于水的固体,与“84消毒液”的有效成分(NaClO) ,在浓碱溶液中发生反应生成了高效环保的净水剂高铁酸钠,请写出此反应的离子方程式
(5)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】已知 A、B、C、D、E 是五种短周期的主族元素,它们的原子序数依次增大, A 是所有元素中原子半径最小的元素,B、C 组成的某一种化合物能引起温室效应;常温下, 金属 D 单质投入水中能与水剧烈反应;E 的单质在常温下是一种有色的气体。请按要求回答下列几个问题:
(1)B、D 的元素名称分别为:_____ 、_____ ;
(2)E 的最高价氧化物对应的水化物的化学式为:_____ ;
(3)C 离子的结构示意图为:_____ ;
(4)B、C、D 三种元素的原子半径从大到小的顺序为_____ (用元素符号表示);
(5)B、E 的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____ (用对应的化学式表示)
(6) 写出 C、D 两种元素组成的阴、阳离子个数比为 1:2 且既含离子键又含有非极性共价键的化合物的电子式:_____ 。
(1)B、D 的元素名称分别为:
(2)E 的最高价氧化物对应的水化物的化学式为:
(3)C 离子的结构示意图为:
(4)B、C、D 三种元素的原子半径从大到小的顺序为
(5)B、E 的最高价氧化物对应水化物的酸性从强到弱的顺序为:
(6) 写出 C、D 两种元素组成的阴、阳离子个数比为 1:2 且既含离子键又含有非极性共价键的化合物的电子式:
您最近一年使用:0次



