解题方法
1 . 某学习小组利用二氧化锰与浓盐酸反应制取纯净、干燥的氯气,装置如下图所示。请回答下列问题:
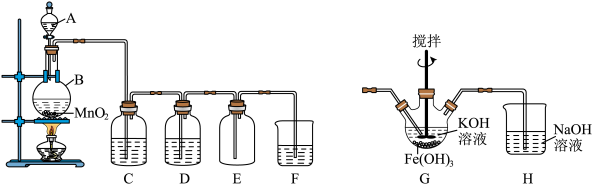
(1)仪器A的名称是___________ ,该反应原理用离子反应方程表示为___________ 。
(2)装置C内盛放的试剂是___________ 。
(3)D中溶液的作用是___________ 。
(4)F装置吸收氯气,可得漂白液的有效成分:___________ (填化学式);漂白粉长时间暴露在空气中会变质,请结合化学方程式解释其原因:___________ 。
(5)反应结束后,能证明仪器B内的溶液中含有Cl-的试剂是___________ (填化学式)。
(6)高铁酸钾(K2FeO4)是一种高效低污染的水处理剂,其制备原理是将B中产生的Cl2通入G装置,产物有K2FeO4、KCl和H2O。若消耗3个Cl2分子,共转移___________ 个电子。则G装置中的反应化学方程式为___________ 。

(1)仪器A的名称是
(2)装置C内盛放的试剂是
(3)D中溶液的作用是
(4)F装置吸收氯气,可得漂白液的有效成分:
(5)反应结束后,能证明仪器B内的溶液中含有Cl-的试剂是
(6)高铁酸钾(K2FeO4)是一种高效低污染的水处理剂,其制备原理是将B中产生的Cl2通入G装置,产物有K2FeO4、KCl和H2O。若消耗3个Cl2分子,共转移
您最近一年使用:0次
名校
解题方法
2 . 某小组研究了铜片与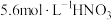 反应的速率,实验现象记录如下表。
反应的速率,实验现象记录如下表。
为探究影响该反应速率的主要因素,小组进行如下实验。
实验Ⅰ:监测上述反应过程中溶液温度的变化,所得曲线如下图: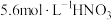 ,结果显示:Cu(NO3)2、NO对Cu和HNO3反应速率的影响均不明显,NO2能明显加快该反应的速率。
,结果显示:Cu(NO3)2、NO对Cu和HNO3反应速率的影响均不明显,NO2能明显加快该反应的速率。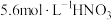 ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有NO
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有NO 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:___________ 。
(2)实验Ⅰ的结论:温度升高___________ (填“是”或“不是”)反应速率加快的主要原因。
(3)实验Ⅱ的目的是:___________ 。
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验Ⅱ、Ⅲ,在下图方框内填入相应的微粒符号,以补全催化机理。①_________ ;②_________ 。 ___________ (请写出操作和现象)。
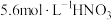 反应的速率,实验现象记录如下表。
反应的速率,实验现象记录如下表。| 实验 | 时间段 | 现象 |
| 0~15min | 铜片表面出现极少气泡 |
| 15~25min | 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 25~30min | 铜片表面均匀冒出大量气泡 | |
| 30~50min | 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
实验Ⅰ:监测上述反应过程中溶液温度的变化,所得曲线如下图:

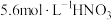 ,结果显示:Cu(NO3)2、NO对Cu和HNO3反应速率的影响均不明显,NO2能明显加快该反应的速率。
,结果显示:Cu(NO3)2、NO对Cu和HNO3反应速率的影响均不明显,NO2能明显加快该反应的速率。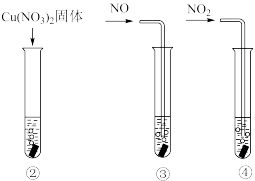
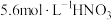 ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有NO
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有NO 。
。(1)根据表格中的现象,描述该反应的速率随时间的变化情况:
(2)实验Ⅰ的结论:温度升高
(3)实验Ⅱ的目的是:
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验Ⅱ、Ⅲ,在下图方框内填入相应的微粒符号,以补全催化机理。①

您最近一年使用:0次
2023-10-17更新
|
208次组卷
|
12卷引用:湖北省荆门市龙泉中学、巴东一中2019-2020学年高二10月联考化学试题
湖北省荆门市龙泉中学、巴东一中2019-2020学年高二10月联考化学试题【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题北京二中2020-2021学年高二上学期10月月考化学试题北京市第十二中学2020-2021学年高二上学期期末考试化学试题云南省马关县第一中学2021-2022学年高二下学期开学考试化学试题云南省文山州广南县第二中学校2021-2022学年高二上学期12月考试化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市第二十二中学2023-2024学年高二上学期10月月考化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第一六一中学2023-2024学年高二上学期10月月考化学试题江西省南昌市第十九中学2023-2024学年高二上学期第一次月考化学试卷
解题方法
3 . 回答下列问题:
I.化石燃料燃烧过程中形成 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为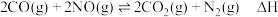 。回答下列问题:
。回答下列问题:
(1)已知: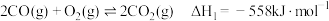
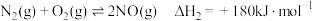
则
___________
(2)向某刚性容器中加入 、
、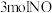 和催化剂,测得平衡时
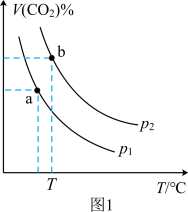
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是___________ (填标号)。
A.断裂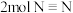 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D. 的体积分数不再变化
的体积分数不再变化
②压强
___________  (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
___________  。
。
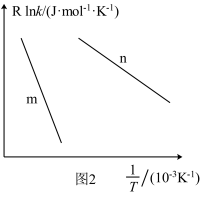
(3)已知Arrhenius经验公式为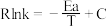 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是___________ (填“m”或“n”)。
Ⅱ. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。
(4) 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为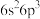 ,其在元素周期表中的位置为
,其在元素周期表中的位置为___________ 。
(5)写出 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式___________ 。
I.化石燃料燃烧过程中形成
 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为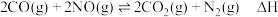 。回答下列问题:
。回答下列问题:(1)已知:
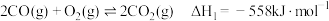
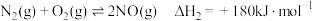
则

(2)向某刚性容器中加入
 、
、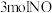 和催化剂,测得平衡时
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是
A.断裂
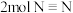 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D.
 的体积分数不再变化
的体积分数不再变化②压强

 (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
 。
。(3)已知Arrhenius经验公式为
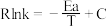 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
Ⅱ.
 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。(4)
 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为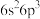 ,其在元素周期表中的位置为
,其在元素周期表中的位置为(5)写出
 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式
您最近一年使用:0次
4 . W是一种高分子功能材料。一种合成W的路线如图。
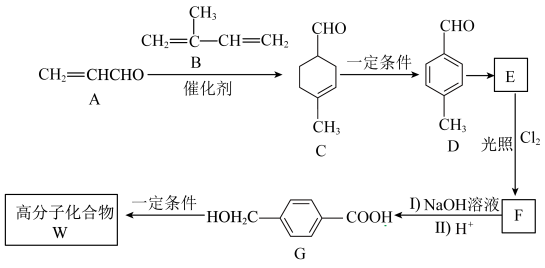
回答下列问题:
(1)A→C的反应类型为___________ ,D的化学名称是___________ ;
(2)C中所含官能团的名称是___________ 。
(3)B是一种天然高分子材料单体,写出该高分子化合物的结构简式___________ ;
(4)已知E的分子式为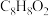 ,则E的结构简式为
,则E的结构简式为___________ 。
(5)F→G中第Ⅰ步反应的化学方程式为___________ 。
(6)G的同分异构体中能同时满足以下三个条件的有___________ 种。
①能与 溶液发生显色反应 ②能与
溶液发生显色反应 ②能与 溶液反应产生气体 ③苯环上有三个取代基
溶液反应产生气体 ③苯环上有三个取代基
(7)W的结构简式为___________ 。

回答下列问题:
(1)A→C的反应类型为
(2)C中所含官能团的名称是
(3)B是一种天然高分子材料单体,写出该高分子化合物的结构简式
(4)已知E的分子式为
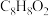 ,则E的结构简式为
,则E的结构简式为(5)F→G中第Ⅰ步反应的化学方程式为
(6)G的同分异构体中能同时满足以下三个条件的有
①能与
 溶液发生显色反应 ②能与
溶液发生显色反应 ②能与 溶液反应产生气体 ③苯环上有三个取代基
溶液反应产生气体 ③苯环上有三个取代基(7)W的结构简式为
您最近一年使用:0次
解题方法
5 . 钨精矿分解渣具有较高的回收利用价值,以钨精矿分解渣为二次资源综合回收锰、铁的工艺流程如下:
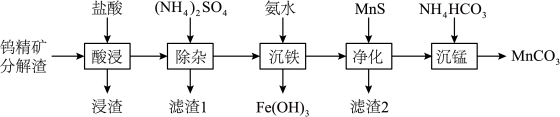
已知:钨精矿分解渣的主要化学成分及含量
① 不溶于水、不与除氢氟酸外的无机酸反应。
不溶于水、不与除氢氟酸外的无机酸反应。
② 、
、
(1)将钨精矿分解渣预先粉碎的目的是___________ 。
(2)“浸渣”的主要成分为___________ 。
(3)“除杂”时加入 的目的是
的目的是___________ ;相较于 ,该步选择
,该步选择 的优点是
的优点是___________ 。
(4)用沉淀溶解平衡原理解释“净化”时选择 的原因
的原因___________ 。
(5)“沉锰”时发生反应的离子方程式为___________ 。
(6)取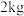 钨精矿分解渣按图中流程进行操作,最终得到
钨精矿分解渣按图中流程进行操作,最终得到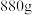 含锰元素质量分数为45%的
含锰元素质量分数为45%的 ,则整个过程中锰元素的回收率为
,则整个过程中锰元素的回收率为___________ 。

已知:钨精矿分解渣的主要化学成分及含量
| 名称 |  |  |  |  |  |  | 其它 |
| 含量 | 34.8% | 26.1% | 7.6% | 8.8% | 0.75% | 0.66% |
 不溶于水、不与除氢氟酸外的无机酸反应。
不溶于水、不与除氢氟酸外的无机酸反应。②
 、
、
(1)将钨精矿分解渣预先粉碎的目的是
(2)“浸渣”的主要成分为
(3)“除杂”时加入
 的目的是
的目的是 ,该步选择
,该步选择 的优点是
的优点是(4)用沉淀溶解平衡原理解释“净化”时选择
 的原因
的原因(5)“沉锰”时发生反应的离子方程式为
(6)取
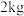 钨精矿分解渣按图中流程进行操作,最终得到
钨精矿分解渣按图中流程进行操作,最终得到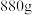 含锰元素质量分数为45%的
含锰元素质量分数为45%的 ,则整个过程中锰元素的回收率为
,则整个过程中锰元素的回收率为
您最近一年使用:0次
6 . 硫酸羟胺 为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺 为白色片状晶体,易溶于水、甲醇等,受热易分解。
为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)仪器a的作用为___________ ,三颈烧瓶中的试剂是___________
(2)装置A中反应的主要化学方程式为___________ 。
(3)开始实验时,应最先打开___________ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
(4)流程中步骤Ⅰ的化学方程式是___________ 。
(5)分离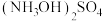 和
和 操作:①向二者混合溶液中加入氨水,生成
操作:①向二者混合溶液中加入氨水,生成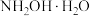 ,②再加入甲醇,加入甲醇的目的是
,②再加入甲醇,加入甲醇的目的是___________ ③过滤,将滤液进行___________ (填“常压”或“减压”)蒸馏,④接着加入硫酸,得到硫酸羟胺产品,写出发生反应的化学方程式___________
(6)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入 的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸
的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸 ,
, 气体全部逸出。将所得溶液冷却后,用
气体全部逸出。将所得溶液冷却后,用 酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=___________ mol。
 为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺
 为白色片状晶体,易溶于水、甲醇等,受热易分解。
为白色片状晶体,易溶于水、甲醇等,受热易分解。回答下列问题:
(1)仪器a的作用为
(2)装置A中反应的主要化学方程式为
(3)开始实验时,应最先打开
 ”“
”“ ”或“
”或“ ”)。
”)。(4)流程中步骤Ⅰ的化学方程式是
(5)分离
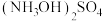 和
和 操作:①向二者混合溶液中加入氨水,生成
操作:①向二者混合溶液中加入氨水,生成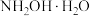 ,②再加入甲醇,加入甲醇的目的是
,②再加入甲醇,加入甲醇的目的是(6)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入
 的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸
的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸 ,
, 气体全部逸出。将所得溶液冷却后,用
气体全部逸出。将所得溶液冷却后,用 酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
您最近一年使用:0次
解题方法
7 . 从海水中可以获得淡水、食盐并可提取镁和溴等物质。
实验(一)海水提溴:空气吹出法是工业规模提溴的常用方法,其流程如图:

(1)步骤④反应的离子方程式为_____ 。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,转移电子的物质的量为_____ mol。
实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:

已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
(2)“适量O2”中能代替O2的最佳物质是_____ 。
(3)步骤X中,萃取后分液漏斗内观察到的现象是_____ 。
(4)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为_____ ,其中操作Z的名称是_____ 。
实验(一)海水提溴:空气吹出法是工业规模提溴的常用方法,其流程如图:

(1)步骤④反应的离子方程式为
实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:

已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
(2)“适量O2”中能代替O2的最佳物质是
(3)步骤X中,萃取后分液漏斗内观察到的现象是
(4)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 乙烯是来自石油的重要的化工原料,乙烯的产量通常用来衡量一个国家的石油化工发展水平。

完成下列填空:
(1)反应②、③产物的官能团名称分别为_____ 、_____ 。
(2)反应①、⑥的反应类型分别为_____ 、_____ 。
(3)反应①和反应②的反应方程式分别为_____ 、_____ 。
(4)反应④得到的产物聚乙烯用来制造塑料,其单体是乙烯,而乙烯的同系物丙烯也可以通过聚合反应得高聚物,也可以用来制塑料,该有机物最多有_____ 个原子共平面,其聚合反应方程式是_____ 。
(5)石油通过分馏、裂化都可以得到C4H10,C4H10一氯取代物有_____ 种。

完成下列填空:
(1)反应②、③产物的官能团名称分别为
(2)反应①、⑥的反应类型分别为
(3)反应①和反应②的反应方程式分别为
(4)反应④得到的产物聚乙烯用来制造塑料,其单体是乙烯,而乙烯的同系物丙烯也可以通过聚合反应得高聚物,也可以用来制塑料,该有机物最多有
(5)石油通过分馏、裂化都可以得到C4H10,C4H10一氯取代物有
您最近一年使用:0次
解题方法
9 . 某兴趣小组设计如图所示装置制取SO2,研究其性质,并进一步探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。

(1)仪器G的名称是_____ 。
(2)装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置D中反应的化学方程式为_____ 。证明SO2具有漂白性的实验现象是_____ 。
(3)为了实现绿色化学的目标,某同学设计装置F来代替装置A,若选用装置F制取O2可选用的物质是_____ 。
(4)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
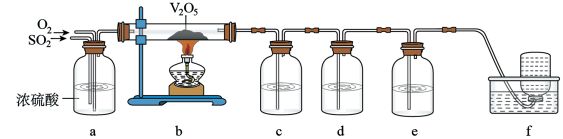
供选择试剂:品红溶液、蒸馏水、0.5mol/LBaCl2溶液、酸性KMnO4溶液。
①c中应选用的试剂是_____ ,e中试剂的作用是_____ ,f中收集的气体是_____ 。
②若b中反应已充分进行,c,d,e,f都有预期的现象,写出b中发生反应的化学方程式:_____ 。

(1)仪器G的名称是
(2)装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置D中反应的化学方程式为
(3)为了实现绿色化学的目标,某同学设计装置F来代替装置A,若选用装置F制取O2可选用的物质是
(4)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。

供选择试剂:品红溶液、蒸馏水、0.5mol/LBaCl2溶液、酸性KMnO4溶液。
①c中应选用的试剂是
②若b中反应已充分进行,c,d,e,f都有预期的现象,写出b中发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . 工业烟气中常含有NOx(NO、NO2)。用NaClO溶液将NOx氧化为 ,实现烟气中NOx的脱除。
,实现烟气中NOx的脱除。
(1)NOx在大气中会形成酸雨。形成酸雨的过程中,NO表现___________ 性。
(2)向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。

已知:NOx脱除率=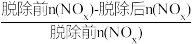 ×100%
×100%
①不用盐酸调节NaClO溶液初始pH的原因是___________ 。
②将pH=3.5时NaClO溶液脱除NO的离子方程式(可逆 )为___________ 。
③pH<5.5时,分析NOx脱除率随溶液初始pH升高而增大的可能原因:___________ 。
(3)用CrO3分别将脱除前后的NOx全部转化为NO2,并用库仑仪测定NO2的量,可计算NOx脱除率。库仑仪工作的原理和装置如下:

检测前,电解质溶液中的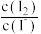 保持定值时,电解池不工作。NO2进入电解池后与I-反应,库仑仪便立即自动进行电解到
保持定值时,电解池不工作。NO2进入电解池后与I-反应,库仑仪便立即自动进行电解到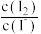 又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。
又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。
①NO2在电解池中被I-还原为NO的离子方程式为___________ 。
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。NOx脱除率是___________ 。
③测量结束后,电解池中还检测到少量 和
和 ,这将导致NO2测定结果
,这将导致NO2测定结果___________ (填“偏高”或“偏低”),需进行校正。
 ,实现烟气中NOx的脱除。
,实现烟气中NOx的脱除。(1)NOx在大气中会形成酸雨。形成酸雨的过程中,NO表现
(2)向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。

已知:NOx脱除率=
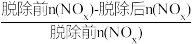 ×100%
×100%①不用盐酸调节NaClO溶液初始pH的原因是
②将pH=3.5时NaClO溶液脱除NO的离子方程式(
③pH<5.5时,分析NOx脱除率随溶液初始pH升高而增大的可能原因:
(3)用CrO3分别将脱除前后的NOx全部转化为NO2,并用库仑仪测定NO2的量,可计算NOx脱除率。库仑仪工作的原理和装置如下:

检测前,电解质溶液中的
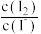 保持定值时,电解池不工作。NO2进入电解池后与I-反应,库仑仪便立即自动进行电解到
保持定值时,电解池不工作。NO2进入电解池后与I-反应,库仑仪便立即自动进行电解到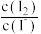 又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。
又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。①NO2在电解池中被I-还原为NO的离子方程式为
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。NOx脱除率是
③测量结束后,电解池中还检测到少量
 和
和 ,这将导致NO2测定结果
,这将导致NO2测定结果
您最近一年使用:0次




