名校
解题方法
1 . 晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1) 可写成
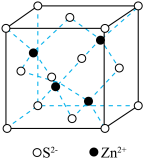
可写成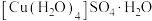 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为___________ ,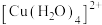 中配位原子是
中配位原子是___________ 。 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。___________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为___________ 。
(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为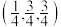 ,则原子2和4的原子分数坐标为
,则原子2和4的原子分数坐标为___________ 、___________ 。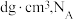 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 的晶胞中
的晶胞中 的配位数为
的配位数为___________ ; 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为___________  (用代数式表示)。
(用代数式表示)。
(1)
 可写成
可写成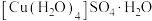 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为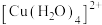 中配位原子是
中配位原子是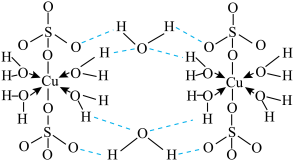
 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。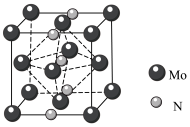
 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被
 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为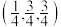 ,则原子2和4的原子分数坐标为
,则原子2和4的原子分数坐标为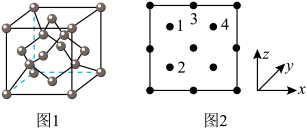
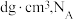 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 的晶胞中
的晶胞中 的配位数为
的配位数为 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
名校
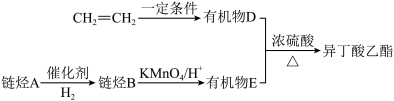
2 . 异丁酸乙酯是一种食品香精原料,可以用乙烯、链烃A为原料进行合成,在下列转化关系中部分反应物和产物已略去。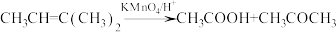
(1)链烃A有支链且只有一个官能团,其相对分子质量在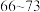 之间,
之间,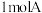 完全燃烧消耗
完全燃烧消耗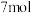 氧气,则A的结构简式为
氧气,则A的结构简式为___________ 。
(2)用系统命名法命名链烃B的名称为___________ 。
(3)有机物D和有机物E反应生成异丁酸乙酯的化学方程式为___________ 。
(4)链烃B转化生成有机物E的反应类型是___________ ;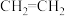 转化生成有机物D的反应类型是
转化生成有机物D的反应类型是___________ 。
(5)G是A的一种同分异构体,它的核磁共振氢谱只有一组峰(不考虑立体异构),则G的结构简式为___________ 。
(6)链烃F与链烃B互为同系物,其分子中比B多一个碳原子,且分子中存在一个手性碳原子,链烃F的结构简式为___________ 。
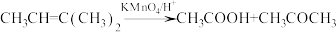
(1)链烃A有支链且只有一个官能团,其相对分子质量在
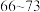 之间,
之间,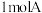 完全燃烧消耗
完全燃烧消耗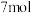 氧气,则A的结构简式为
氧气,则A的结构简式为(2)用系统命名法命名链烃B的名称为
(3)有机物D和有机物E反应生成异丁酸乙酯的化学方程式为
(4)链烃B转化生成有机物E的反应类型是
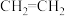 转化生成有机物D的反应类型是
转化生成有机物D的反应类型是(5)G是A的一种同分异构体,它的核磁共振氢谱只有一组峰(不考虑立体异构),则G的结构简式为
(6)链烃F与链烃B互为同系物,其分子中比B多一个碳原子,且分子中存在一个手性碳原子,链烃F的结构简式为
您最近一年使用:0次
3 . 填空
(1)实验室用如图所示装置验证 可作为呼吸面具的供氧剂(C中放
可作为呼吸面具的供氧剂(C中放 ),下列说法正确的是 。
),下列说法正确的是 。

Ⅱ.A~H为中学化学中常见的物质,其转化关系如图所示,其中“○”代表化合物,“□”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体,F为金属单质。请回答下列问题:

(2)G的化学式为___________ ,每生成1个G转移电子___________ 个。
(3)反应①②③④中___________ (填序号)属于氧化还原反应。
(4)写出下列反应的化学方程式。
A→B+C+D:____________________ ,
F+C:______________________________________ 。
(1)实验室用如图所示装置验证
 可作为呼吸面具的供氧剂(C中放
可作为呼吸面具的供氧剂(C中放 ),下列说法正确的是 。
),下列说法正确的是 。
A.A为气体发生装置,D为收集装置,利用向上排空气法收集 |
B.C中只发生反应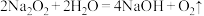 ,现象是固体从淡黄色慢慢变白色 ,现象是固体从淡黄色慢慢变白色 |
C.A的锥形瓶和B中盛放的试剂可有多种选择,且均可用 溶液 溶液 |
D.D为除杂装置,盛放的是 溶液 溶液 |
Ⅱ.A~H为中学化学中常见的物质,其转化关系如图所示,其中“○”代表化合物,“□”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体,F为金属单质。请回答下列问题:

(2)G的化学式为
(3)反应①②③④中
(4)写出下列反应的化学方程式。
A→B+C+D:
F+C:
您最近一年使用:0次
4 . 某无色透明溶液中可能大量存在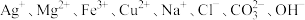 和
和 中的几种.请回答下列问题:
中的几种.请回答下列问题:
(1)不做任何实验就可以判断原溶液中不存在的离子为_______ .
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不溶解,说明原溶液中一定存在的离子是___________________________ ;有关反应的离子方程式为____________________________ .
(3)取(2)中的滤液,逐滴加入过量 溶液,出现白色沉淀,说明原溶液中一定含有
溶液,出现白色沉淀,说明原溶液中一定含有_____________________ ;该过程发生反应的离子方程式为:___________________________ .
(4)该溶液还可能存在的离子是_____________________ .
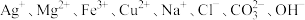 和
和 中的几种.请回答下列问题:
中的几种.请回答下列问题:(1)不做任何实验就可以判断原溶液中不存在的离子为
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不溶解,说明原溶液中一定存在的离子是
(3)取(2)中的滤液,逐滴加入过量
 溶液,出现白色沉淀,说明原溶液中一定含有
溶液,出现白色沉淀,说明原溶液中一定含有(4)该溶液还可能存在的离子是
您最近一年使用:0次
5 . 一种从废钼钴催化剂中回收有价金属的工艺流程如图甲所示:
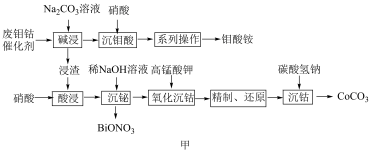
已知:I.废钼钴催化剂的主要成分如表。
II.“酸浸”所得溶液中主要含有H+、Bi3+、Co2+等阳离子。
回答下列问题:
(1)钼酸铵 中Mo元素的化合价为
中Mo元素的化合价为_______ ,其所含非金属元素的电负性由大到小排序为_______ 。
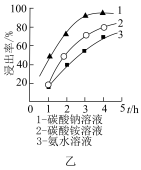
(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为_______ 。
(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为_______ 。
(4)“沉铋”时,反应的离子方程式为_______ 。
(5)“氧化沉钴”时调节溶液 ,反应生成
,反应生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
(6)若通过该流程处理1kg废钼钴催化剂,得到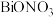 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近_____ (填标号)(Bi元素的回收率 )。
)。
A.70% B.80% C.90%

已知:I.废钼钴催化剂的主要成分如表。
| 主要成分 |  |  |  |
| 质量分数 | 44.61% | 6.67% | 13.98% |
回答下列问题:
(1)钼酸铵
 中Mo元素的化合价为
中Mo元素的化合价为(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为

(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为
(4)“沉铋”时,反应的离子方程式为
(5)“氧化沉钴”时调节溶液
 ,反应生成
,反应生成 和
和 ,其离子方程式为
,其离子方程式为(6)若通过该流程处理1kg废钼钴催化剂,得到
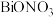 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近 )。
)。A.70% B.80% C.90%
您最近一年使用:0次
解题方法
6 . 我国的能源以煤炭为主,燃煤烟气中 、
、 等有害气体的排放会污染环境,用
等有害气体的排放会污染环境,用 还原脱除
还原脱除 将其转化为单质硫,对工业生产具有重要的意义。
将其转化为单质硫,对工业生产具有重要的意义。
(1) 与
与 的反应为
的反应为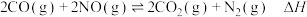
已知: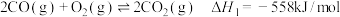
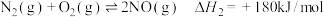
则
________
(2)在某温度时,进行 还原脱除
还原脱除 :
: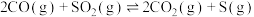 。
。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是________ 。
A. B.
B. 与
与 的浓度之比不再改变
的浓度之比不再改变
C.容器内的压强不再改变 D.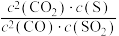 的值不再改变
的值不再改变
②若控制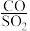 进料比(物质的量)为
进料比(物质的量)为 ,反应达平衡时,混合气体中
,反应达平衡时,混合气体中 的体积分数为
的体积分数为 ,则该反应在此温度下的平衡常数为
,则该反应在此温度下的平衡常数为___________ 。
(3)在600℃时,发生如下系列反应( 、
、 、
、 为平衡常数),测得不同
为平衡常数),测得不同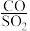 进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为
进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为 )。
)。
反应I: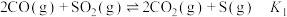
反应II:
反应III: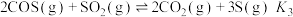
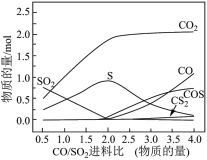
①该条件下,为减少有毒物质 的产生,同时脱除SO2,实际生产中应控
的产生,同时脱除SO2,实际生产中应控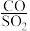 制进料比为
制进料比为___________ 。
②根据图中曲线,可判断
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)SO2—空气质子交换膜燃料电池也可用于处理SO2,其原理如下图。

①写出a极的电极反应式___________ 。
②若用该电池处理标准状况下SO2含量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为_______ ( 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、 等有害气体的排放会污染环境,用
等有害气体的排放会污染环境,用 还原脱除
还原脱除 将其转化为单质硫,对工业生产具有重要的意义。
将其转化为单质硫,对工业生产具有重要的意义。(1)
 与
与 的反应为
的反应为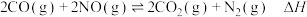
已知:
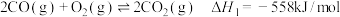
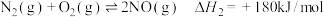
则

(2)在某温度时,进行
 还原脱除
还原脱除 :
: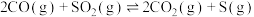 。
。①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是
A.
 B.
B. 与
与 的浓度之比不再改变
的浓度之比不再改变C.容器内的压强不再改变 D.
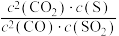 的值不再改变
的值不再改变②若控制
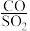 进料比(物质的量)为
进料比(物质的量)为 ,反应达平衡时,混合气体中
,反应达平衡时,混合气体中 的体积分数为
的体积分数为 ,则该反应在此温度下的平衡常数为
,则该反应在此温度下的平衡常数为(3)在600℃时,发生如下系列反应(
 、
、 、
、 为平衡常数),测得不同
为平衡常数),测得不同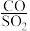 进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为
进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为 )。
)。反应I:
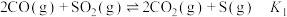
反应II:

反应III:
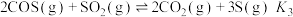

①该条件下,为减少有毒物质
 的产生,同时脱除SO2,实际生产中应控
的产生,同时脱除SO2,实际生产中应控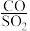 制进料比为
制进料比为②根据图中曲线,可判断

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)SO2—空气质子交换膜燃料电池也可用于处理SO2,其原理如下图。

①写出a极的电极反应式
②若用该电池处理标准状况下SO2含量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为
 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
您最近一年使用:0次
7 . Ⅰ.现有以下物质:① 溶液;②蔗糖;③
溶液;②蔗糖;③ 固体;④熔融
固体;④熔融 ;⑤
;⑤ 胶体;⑥
胶体;⑥ ;⑦
;⑦ ;⑧
;⑧ ;⑨石墨。
;⑨石墨。
(1)以上物质中属于电解质的是_______ (填标号,下同);属于非电解质的是________ 。
(2)以上物质属于纯净物且能导电的是________ 。
Ⅱ.某学生用 的标准
的标准 溶液滴定未知浓度的盐酸,其操作可分为如下几步:
溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入 溶液至“0”刻度线以上
溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(3)以上步骤有错误的是___________ (填标号)。
(4)滴定终点的现象为___________ ;
(5)用标准 溶液滴定时,应将标准
溶液滴定时,应将标准 溶液注入
溶液注入_______ 中(从图中选填“甲”或“乙”)。

(6)下列操作会引起实验结果偏大的是___________(填标号)。
 溶液;②蔗糖;③
溶液;②蔗糖;③ 固体;④熔融
固体;④熔融 ;⑤
;⑤ 胶体;⑥
胶体;⑥ ;⑦
;⑦ ;⑧
;⑧ ;⑨石墨。
;⑨石墨。(1)以上物质中属于电解质的是
(2)以上物质属于纯净物且能导电的是
Ⅱ.某学生用
 的标准
的标准 溶液滴定未知浓度的盐酸,其操作可分为如下几步:
溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,并注入
 溶液至“0”刻度线以上
溶液至“0”刻度线以上②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(3)以上步骤有错误的是
(4)滴定终点的现象为
(5)用标准
 溶液滴定时,应将标准
溶液滴定时,应将标准 溶液注入
溶液注入
(6)下列操作会引起实验结果偏大的是___________(填标号)。
| A.在锥形瓶装液前,留有少量蒸馏水 |
| B.滴定前,滴定管尖嘴有气泡,滴定后无气泡 |
| C.滴定终点俯视读数 |
| D.用滴定管量取待测液时,开始时正确读数,后俯视读数 |
您最近一年使用:0次
名校
8 . 绿矾 是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:
是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:

查询资料,得有关物质的数据如下表
(1)检验制得的绿矾晶体中是否含有 ,最好选用的试剂为___________。
,最好选用的试剂为___________。
(2)操作II中,通入硫化氢至饱和的目的是___________ ,在溶液中用硫酸酸化至 的目的是
的目的是___________ 。
(3)操作IV的顺序依次为___________ 、冷却结晶、过滤、洗涤、干燥。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________ 。
(5)测定绿矾产品中 含量的方法是:
含量的方法是:
a.称取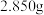 绿矾产品,溶解,在
绿矾产品,溶解,在 容量瓶中定容;
容量瓶中定容;
b.量取 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
c.用硫酸酸化的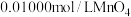 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为
溶液体积的平均值为 。
。
①判断此滴定实验达到终点的方法是___________ 。
②计算上述样品中 的质量分数为
的质量分数为___________ 。(结果保留一位小数)
 是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:
是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:
查询资料,得有关物质的数据如下表
 时 时 | 饱和 溶液 溶液 |  沉淀完全 沉淀完全 |  开始沉淀 开始沉淀 |  沉淀完全 沉淀完全 |
 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有
 ,最好选用的试剂为___________。
,最好选用的试剂为___________。A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D.新制氯水 |
(2)操作II中,通入硫化氢至饱和的目的是
 的目的是
的目的是(3)操作IV的顺序依次为
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②
(5)测定绿矾产品中
 含量的方法是:
含量的方法是:a.称取
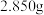 绿矾产品,溶解,在
绿矾产品,溶解,在 容量瓶中定容;
容量瓶中定容;b.量取
 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;c.用硫酸酸化的
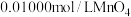 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为
溶液体积的平均值为 。
。①判断此滴定实验达到终点的方法是
②计算上述样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
9 . 完成下列问题。
(1)氯化铝水溶液呈酸性的原因是(用离子方程式表示)___________ ,把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是___________ ;(填化学式)教材课后习题中介绍了用 脱水制备无水氯化物的知识。请写出:将
脱水制备无水氯化物的知识。请写出:将 与
与 混合加热的反应式:
混合加热的反应式:___________ 。
(2)在 时,
时, 的①
的① 、②
、② 、③
、③ 溶液中,
溶液中, 由小到大的顺序是
由小到大的顺序是___________ 。(填序号)
(3)部分弱酸的电离平衡常数如表:
①在相同浓度的 和HC1O的溶液中,溶液导电能力:
和HC1O的溶液中,溶液导电能力:
___________  。(用“>”“<”或“=”填空)
。(用“>”“<”或“=”填空)
②将少量 气体通入
气体通入 溶液中,写出该反应离子方程式:
溶液中,写出该反应离子方程式:___________ 。
(4)某浓度的氨水中存在平衡: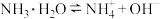 ,如想增大
,如想增大 的浓度而不增大
的浓度而不增大 的浓度,应采取的措施是
的浓度,应采取的措施是___________ (填字母)。
a.适当升高温度 b.加入 固体 c.通入
固体 c.通入 d.加入少量浓盐酸
d.加入少量浓盐酸
(1)氯化铝水溶液呈酸性的原因是(用离子方程式表示)
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是 脱水制备无水氯化物的知识。请写出:将
脱水制备无水氯化物的知识。请写出:将 与
与 混合加热的反应式:
混合加热的反应式:(2)在
 时,
时, 的①
的① 、②
、② 、③
、③ 溶液中,
溶液中, 由小到大的顺序是
由小到大的顺序是(3)部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
电离平衡常数/ | 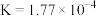 | 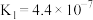  |  |
 和HC1O的溶液中,溶液导电能力:
和HC1O的溶液中,溶液导电能力:
 。(用“>”“<”或“=”填空)
。(用“>”“<”或“=”填空)②将少量
 气体通入
气体通入 溶液中,写出该反应离子方程式:
溶液中,写出该反应离子方程式:(4)某浓度的氨水中存在平衡:
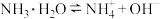 ,如想增大
,如想增大 的浓度而不增大
的浓度而不增大 的浓度,应采取的措施是
的浓度,应采取的措施是a.适当升高温度 b.加入
 固体 c.通入
固体 c.通入 d.加入少量浓盐酸
d.加入少量浓盐酸
您最近一年使用:0次
名校
10 . 某溶液中只含有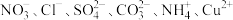 和
和 中的某几种离子,且离子数目均相等。某实验兴趣小组同学取
中的某几种离子,且离子数目均相等。某实验兴趣小组同学取 该溶液,平均分成2份,进行以下操作:
该溶液,平均分成2份,进行以下操作:
Ⅰ.①第一份溶液中加入过量 溶液,加热,产生
溶液,加热,产生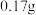 氨气,同时产生蓝色沉淀
氨气,同时产生蓝色沉淀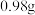 ,过滤、洗涤、干燥、灼烧,得到一定量黑色固体。
,过滤、洗涤、干燥、灼烧,得到一定量黑色固体。
②向上述滤液中加入足量 溶液,过滤,洗涤、干燥,得到
溶液,过滤,洗涤、干燥,得到 沉淀,加入足量的盐酸沉淀质量不变。
沉淀,加入足量的盐酸沉淀质量不变。
Ⅱ.第二份溶液中加入过量的 溶液,取上层清液加入足量
溶液,取上层清液加入足量 溶液,得到白色沉淀,经过滤、洗涤、干燥后加入稀硝酸沉淀不溶解且沉淀质量没有变化。
溶液,得到白色沉淀,经过滤、洗涤、干燥后加入稀硝酸沉淀不溶解且沉淀质量没有变化。
已知: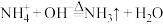
由上述分析可知:
(1)该溶液一定不存在的离子为___________ (填离子符号)。
(2)操作Ⅰ中②“不溶于盐酸的沉淀”为___________ (填化学式)。
(3)溶液中可能存在的离子为___________ (填离子符号),检验阳离子存在的实验方法称为___________ ;可能存在阴离子是否需要检验,请说明理由___________ 。
(4)常用氨气检验液氯管道是否发生泄漏,反应原理: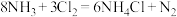 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为___________ 。
(5)在操作Ⅱ中,加入过量的 溶液的目的是
溶液的目的是___________ 。
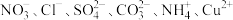 和
和 中的某几种离子,且离子数目均相等。某实验兴趣小组同学取
中的某几种离子,且离子数目均相等。某实验兴趣小组同学取 该溶液,平均分成2份,进行以下操作:
该溶液,平均分成2份,进行以下操作:Ⅰ.①第一份溶液中加入过量
 溶液,加热,产生
溶液,加热,产生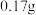 氨气,同时产生蓝色沉淀
氨气,同时产生蓝色沉淀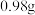 ,过滤、洗涤、干燥、灼烧,得到一定量黑色固体。
,过滤、洗涤、干燥、灼烧,得到一定量黑色固体。②向上述滤液中加入足量
 溶液,过滤,洗涤、干燥,得到
溶液,过滤,洗涤、干燥,得到 沉淀,加入足量的盐酸沉淀质量不变。
沉淀,加入足量的盐酸沉淀质量不变。Ⅱ.第二份溶液中加入过量的
 溶液,取上层清液加入足量
溶液,取上层清液加入足量 溶液,得到白色沉淀,经过滤、洗涤、干燥后加入稀硝酸沉淀不溶解且沉淀质量没有变化。
溶液,得到白色沉淀,经过滤、洗涤、干燥后加入稀硝酸沉淀不溶解且沉淀质量没有变化。已知:
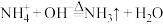
由上述分析可知:
(1)该溶液一定不存在的离子为
(2)操作Ⅰ中②“不溶于盐酸的沉淀”为
(3)溶液中可能存在的离子为
(4)常用氨气检验液氯管道是否发生泄漏,反应原理:
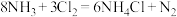 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为(5)在操作Ⅱ中,加入过量的
 溶液的目的是
溶液的目的是
您最近一年使用:0次



