名校
1 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸溶液是常用的消毒剂,可利用一氧化二氯(Cl2O)与水反应得到。实验室可用Cl2与潮湿的Na2CO3反应制取Cl2O,反应装置如下图所示(夹持装置已省略)。
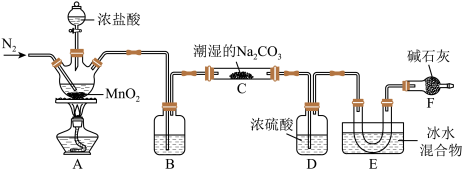
已知:常温常压下,Cl2O为棕黄色气体,熔点为―116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。
(1)仪器组装完成、加药品前应进行的实验操作为_______ 。
(2)装置A中发生反应的化学方程式为_______ 。
(3)E装置中冰水混合物的作用_______ 。
(4)F装置除了吸收多余的氯气外,还有_______ 作用。
(5)下列有关该实验的说法中不正确的是_______ (填标号)。
a.实验室也可用KMnO4与浓盐酸反应制备氯气
b.B中试剂是浓硫酸,目的是干燥氯气
c.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险
d.从装置E中逸出气体的主要成分是Cl2O
(6)装置C中Cl2与潮湿的Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式_______ 。
(7)反应结束后,设计实验方案验证装置C生成的产物中另一种盐X中的阴离子:_______ 。

已知:常温常压下,Cl2O为棕黄色气体,熔点为―116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。
(1)仪器组装完成、加药品前应进行的实验操作为
(2)装置A中发生反应的化学方程式为
(3)E装置中冰水混合物的作用
(4)F装置除了吸收多余的氯气外,还有
(5)下列有关该实验的说法中不正确的是
a.实验室也可用KMnO4与浓盐酸反应制备氯气
b.B中试剂是浓硫酸,目的是干燥氯气
c.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险
d.从装置E中逸出气体的主要成分是Cl2O
(6)装置C中Cl2与潮湿的Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式
(7)反应结束后,设计实验方案验证装置C生成的产物中另一种盐X中的阴离子:
您最近一年使用:0次
名校
2 . 现有中学化学常见的金属单质A、B、C和气体甲、乙、丙、丁以及物质D、E、F、G、H、X,其中气体乙为黄绿色气体。它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
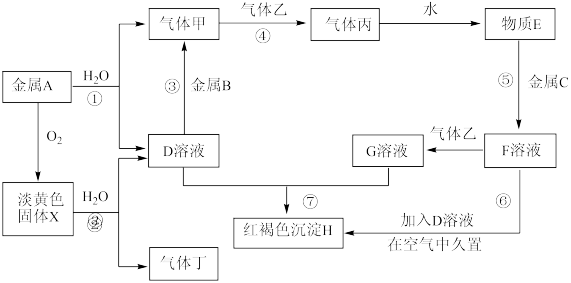
请根据以上信息完成下列各题:
(1)金属B中的元素在元素周期表中的位置为_______ 。
(2)在反应①、②、④、⑤、⑦中,不属于氧化还原反应的是_______ (填编号)。
(3)标准状况下,3.9g的固体X与足量的水反应得到200mLD溶液,反应过程中生成气体丁的体积为_______ mL,D溶液中溶质的物质的量浓度为_______  。
。
(4)写出反应③的离子方程式:_______ ,该反应的氧化剂是_______ 。
(5)写出反应④的化学方程式:_______ ,反应过程⑥中的实验现象为_______ 。

请根据以上信息完成下列各题:
(1)金属B中的元素在元素周期表中的位置为
(2)在反应①、②、④、⑤、⑦中,不属于氧化还原反应的是
(3)标准状况下,3.9g的固体X与足量的水反应得到200mLD溶液,反应过程中生成气体丁的体积为
 。
。(4)写出反应③的离子方程式:
(5)写出反应④的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 铁黄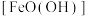 是一种不溶于水的黄色固体,可用作制造黄色颜料,也是制备饮水处理剂一高铁酸钾的原料。一种以工厂废料(含
是一种不溶于水的黄色固体,可用作制造黄色颜料,也是制备饮水处理剂一高铁酸钾的原料。一种以工厂废料(含 、
、 、
、 、CuO)为原料生产铁黄
、CuO)为原料生产铁黄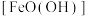 的工艺流程如图所示。
的工艺流程如图所示。
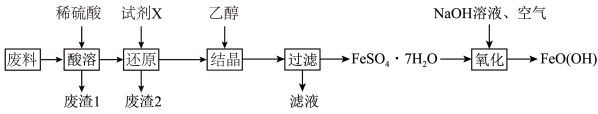
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
回答下列问题:
(1)铁黄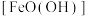 中铁元素化合价为
中铁元素化合价为_______ 。
(2)“酸溶”时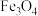 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“废渣1”的主要成分是_______ 。
(4)“还原”时会加入过量的试剂X,“试剂X”宜选择的是_______(填标号)。
(5)“废渣2”的主要成分是_______ 。检验“过滤”的“滤液”中是否含有 所用的试剂为
所用的试剂为_______ (填化学式)溶液。
(6)“氧化”时,理论上氯气氧化性更强,但通常不用氯气代替空气,除考虑成本因素外,另一原因是_______ 。
(7)由 氧化为
氧化为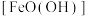 的离子方程式为
的离子方程式为_______ 。
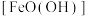 是一种不溶于水的黄色固体,可用作制造黄色颜料,也是制备饮水处理剂一高铁酸钾的原料。一种以工厂废料(含
是一种不溶于水的黄色固体,可用作制造黄色颜料,也是制备饮水处理剂一高铁酸钾的原料。一种以工厂废料(含 、
、 、
、 、CuO)为原料生产铁黄
、CuO)为原料生产铁黄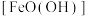 的工艺流程如图所示。
的工艺流程如图所示。
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。回答下列问题:
(1)铁黄
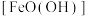 中铁元素化合价为
中铁元素化合价为(2)“酸溶”时
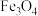 发生反应的离子方程式为
发生反应的离子方程式为(3)“废渣1”的主要成分是
(4)“还原”时会加入过量的试剂X,“试剂X”宜选择的是_______(填标号)。
| A.双氧水 | B.铁粉 | C.氯水 | D.金属铜 |
 所用的试剂为
所用的试剂为(6)“氧化”时,理论上氯气氧化性更强,但通常不用氯气代替空气,除考虑成本因素外,另一原因是
(7)由
 氧化为
氧化为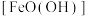 的离子方程式为
的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 1869年门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系。元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是现代长式元素周期表的一部分,数字①~⑩代表十种元素,请按题目要求回答下列问题(以下问题均用相应的化学符号 表达):

(1)元素周期表中元素种类最多的族是_______ 。
(2)元素⑤的一种核素可以用来考古断代,该核素的符号为_______ 。画出元素⑩所形成简单离子的结构示意图:_______ 。
(3)在这10种元素中,原子半径最小的元素是_______ ;金属性最强的元素对应的单质与水反应的化学方程式为_______ 。
(4)元素③④⑦⑩的简单离子半径的由大到小的顺序为_______ ;比较元素⑨⑩的简单氢化物的还原性:_______ >_______ 。
(5)元素②的最高价氧化物对应的水化物的电子式为_______ ,其与元素⑧的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(6)由元素①⑥⑩三种元素形成的盐中所含化学键的类型有_______ 。

(1)元素周期表中元素种类最多的族是
(2)元素⑤的一种核素可以用来考古断代,该核素的符号为
(3)在这10种元素中,原子半径最小的元素是
(4)元素③④⑦⑩的简单离子半径的由大到小的顺序为
(5)元素②的最高价氧化物对应的水化物的电子式为
(6)由元素①⑥⑩三种元素形成的盐中所含化学键的类型有
您最近一年使用:0次
5 . 汽车尾气中含有CO和NO等,可以用不同的方法净化处理,防止空气污染。回答下列问题:
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。
①该反应在常温下能自发进行,则该反应的△H_______ 0(填“>”或“<”)。
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:
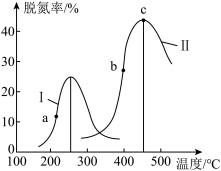
a点的v逆_______ b点的v正(填“>”“<”或“=”')。c点_______ (填“一定”或“不一定”)是平衡状态。
③对于反应2CO(g)+2NO(g) 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=_______ 。
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是_______ (填标号)。
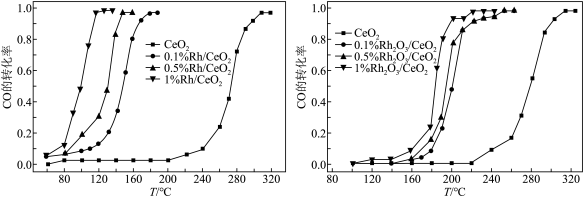
A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是__________ ,为了避免尿素过多造成的影响,可接一个氧化催化器,则氧化催化器中反应的化学方程式为_______ 。
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。①该反应在常温下能自发进行,则该反应的△H
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:

a点的v逆
③对于反应2CO(g)+2NO(g)
 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是

A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g)
 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
您最近一年使用:0次
6 . 硫化氢的转化是资源利用和环境保护的重要研究课题。电化学溶解—沉淀法是一种回收利用 的方法。回答下列问题:
的方法。回答下列问题:
(1)电化学溶解—沉淀法的工艺原理如图所示,反应器中的反应为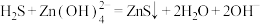 。
。

已知: 在过量的强碱溶液中以
在过量的强碱溶液中以 形式存在。
形式存在。
①碳钢连接直流电源的_______ (填“正极”或“负极”)。
②电解槽中阳极的电极反应式为_______ 。
③电化学溶解—沉淀法工艺的总反应化学方程式为_______ 。
(2)电化学溶解—沉淀法工艺过程中,电解液、出料液、反应器中反应液等都属于同一平衡体系。该体系中主要含有 、
、 、
、 、
、 、
、 、
、 等,体系中各种含锌离子总浓度随溶液pH变化的关系曲线如图所示。
等,体系中各种含锌离子总浓度随溶液pH变化的关系曲线如图所示。
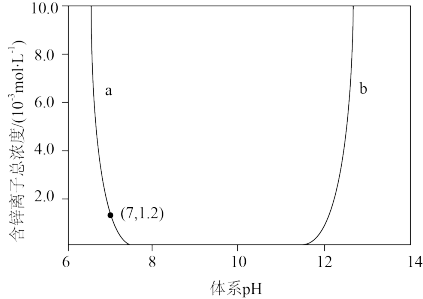
①pH=10,体系中的锌主要以_______ 形式存在。
②曲线b代表_______ 与pH关系。
③列出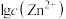 和pH之间的数学关系式(
和pH之间的数学关系式( ):
):_______ 。
 的方法。回答下列问题:
的方法。回答下列问题:(1)电化学溶解—沉淀法的工艺原理如图所示,反应器中的反应为
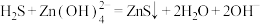 。
。
已知:
 在过量的强碱溶液中以
在过量的强碱溶液中以 形式存在。
形式存在。①碳钢连接直流电源的
②电解槽中阳极的电极反应式为
③电化学溶解—沉淀法工艺的总反应化学方程式为
(2)电化学溶解—沉淀法工艺过程中,电解液、出料液、反应器中反应液等都属于同一平衡体系。该体系中主要含有
 、
、 、
、 、
、 、
、 、
、 等,体系中各种含锌离子总浓度随溶液pH变化的关系曲线如图所示。
等,体系中各种含锌离子总浓度随溶液pH变化的关系曲线如图所示。
①pH=10,体系中的锌主要以
②曲线b代表
③列出
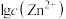 和pH之间的数学关系式(
和pH之间的数学关系式( ):
):
您最近一年使用:0次
7 . 废旧磷酸铁锂电池回收对于减少环境污染与缓解锂资源压力有关重要的意义。磷酸铁锂电池( )正极废料中主要含有Li、Fe、P、C等元素,从正极废料中选择性提锂制备电池级碳酸锂,工艺流程如下所示:
)正极废料中主要含有Li、Fe、P、C等元素,从正极废料中选择性提锂制备电池级碳酸锂,工艺流程如下所示:
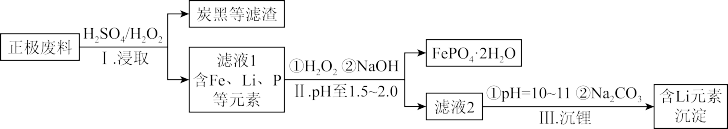
(1) 中Fe的化合价为
中Fe的化合价为_______ 。
(2)过程II中加入 的目的是
的目的是_______ 。
(3)过程III“沉锂”的离子方程式为_______ 。
(4)回收过程中,首先结晶的 晶粒较小,会夹带大量的锂元素,导致锂回收率较低,原因可能是
晶粒较小,会夹带大量的锂元素,导致锂回收率较低,原因可能是_______ 。
(5)过程I中,用过氧化氢作为浸出的氧化剂,浸出液与正极废料固体比例关系(液固比)对锂浸出率有一定影响。在pH为2.5时,研究液固比对锂选择性浸出效果的影响,如下表1所示。
表1.不同液固比条件下锂的选择性浸出
浸出过程中,最优液固比为3~5,理由是_______ 。
(6)沉淀得到的碳酸锂中一般含有未被彻底洗涤的 、Si、
、Si、 及其他微量杂质,要得到电池级别的碳酸锂还需要通过碳化法精制。已知碳酸氢锂溶液加热分解可以得到高纯的碳酸锂,精制的基本思路与反应方程式如下:
及其他微量杂质,要得到电池级别的碳酸锂还需要通过碳化法精制。已知碳酸氢锂溶液加热分解可以得到高纯的碳酸锂,精制的基本思路与反应方程式如下:
第一步:利用粗制的碳酸锂和 反应,生成可溶的
反应,生成可溶的 ,将Si等不溶的杂质通过过滤去除;
,将Si等不溶的杂质通过过滤去除;
反应的方程式:
第二步:_______ ;(写出具体的操作步骤和目的),反应的方程式:_______ 。
 )正极废料中主要含有Li、Fe、P、C等元素,从正极废料中选择性提锂制备电池级碳酸锂,工艺流程如下所示:
)正极废料中主要含有Li、Fe、P、C等元素,从正极废料中选择性提锂制备电池级碳酸锂,工艺流程如下所示:
(1)
 中Fe的化合价为
中Fe的化合价为(2)过程II中加入
 的目的是
的目的是(3)过程III“沉锂”的离子方程式为
(4)回收过程中,首先结晶的
 晶粒较小,会夹带大量的锂元素,导致锂回收率较低,原因可能是
晶粒较小,会夹带大量的锂元素,导致锂回收率较低,原因可能是(5)过程I中,用过氧化氢作为浸出的氧化剂,浸出液与正极废料固体比例关系(液固比)对锂浸出率有一定影响。在pH为2.5时,研究液固比对锂选择性浸出效果的影响,如下表1所示。
表1.不同液固比条件下锂的选择性浸出
| 液固比 | 3 | 5 | 7.5 | 10 |
| 锂浸出率 | 97.9% | 98.3% | 98.1% | 98.4% |
| 浸出液中锂离子浓度 | 12.4g/L | 7.8g/L | 5.5g/L | 3.8g/L |
| 铁浸出率 | 0.02%以下 | |||
浸出过程中,最优液固比为3~5,理由是
(6)沉淀得到的碳酸锂中一般含有未被彻底洗涤的
 、Si、
、Si、 及其他微量杂质,要得到电池级别的碳酸锂还需要通过碳化法精制。已知碳酸氢锂溶液加热分解可以得到高纯的碳酸锂,精制的基本思路与反应方程式如下:
及其他微量杂质,要得到电池级别的碳酸锂还需要通过碳化法精制。已知碳酸氢锂溶液加热分解可以得到高纯的碳酸锂,精制的基本思路与反应方程式如下:第一步:利用粗制的碳酸锂和
 反应,生成可溶的
反应,生成可溶的 ,将Si等不溶的杂质通过过滤去除;
,将Si等不溶的杂质通过过滤去除;反应的方程式:

第二步:
您最近一年使用:0次
8 . 焦磷酸钙(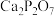 )在工业上主要用作牙膏磨料、食品添加剂,少量用作涂料、填料及电材荧光体。其相对分子质量为254,白色粉末状晶体,不溶于水和醇,可溶于稀盐酸和稀硝酸。实验室可通过如下反应进行制备:
)在工业上主要用作牙膏磨料、食品添加剂,少量用作涂料、填料及电材荧光体。其相对分子质量为254,白色粉末状晶体,不溶于水和醇,可溶于稀盐酸和稀硝酸。实验室可通过如下反应进行制备:



已知:焦磷酸钠与氯化钙在90℃左右进行反应,若温度低,可能生成焦磷酸钙的四水物或二水物。
实验步骤:
I. 的制备
的制备
取5mL 85%磷酸(密度1.7 )于200mL烧杯中,加入70mL水,混合均匀。加热至60℃,缓缓加入10g无水碳酸钠,搅拌,调pH至7,然后在搅拌条件下逐滴加入
)于200mL烧杯中,加入70mL水,混合均匀。加热至60℃,缓缓加入10g无水碳酸钠,搅拌,调pH至7,然后在搅拌条件下逐滴加入
饱和 溶液。使pH达到8.2~10.0。
溶液。使pH达到8.2~10.0。
II. 制备
制备
将pH达到8.2~10.0的料液,转移至蒸发皿中,加热蒸发并不断搅拌。干涸后,将蒸发皿移入马弗炉中,控制温度为200~240℃继续加热一段时间后,冷却称重。
III.焦磷酸钙的制备
将称重后的焦磷酸钠配制成10%的水溶液,加热至90℃,在搅拌下慢慢注入15% 至沉淀完全。静置,倾析法倾去上层清液。沉淀物每次用100mL洗涤剂洗涤三次,洗涤液用倾析法除去,然后抽滤,烘干。冷却后称重得焦磷酸钙8.5g。
至沉淀完全。静置,倾析法倾去上层清液。沉淀物每次用100mL洗涤剂洗涤三次,洗涤液用倾析法除去,然后抽滤,烘干。冷却后称重得焦磷酸钙8.5g。
请回答下列问题:
(1)第I步中使pH达到8.2~10.0,可用酸碱指示剂上_______ (填名称)确定pH的大致范围,确定的方法是_______ 。
(2)第I步中为使pH=9.9,可使用_______ (填标号)进行测定。
A.广泛pH试纸 B.pH计
(3)第II步中不断搅拌的理由是_______ 。
(4)第III步洗涤时使用的洗涤剂是沸水,其原因是_______ 。
(5)第III步中用到的实验装置有_______ (填标号)。
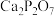 )在工业上主要用作牙膏磨料、食品添加剂,少量用作涂料、填料及电材荧光体。其相对分子质量为254,白色粉末状晶体,不溶于水和醇,可溶于稀盐酸和稀硝酸。实验室可通过如下反应进行制备:
)在工业上主要用作牙膏磨料、食品添加剂,少量用作涂料、填料及电材荧光体。其相对分子质量为254,白色粉末状晶体,不溶于水和醇,可溶于稀盐酸和稀硝酸。实验室可通过如下反应进行制备:


已知:焦磷酸钠与氯化钙在90℃左右进行反应,若温度低,可能生成焦磷酸钙的四水物或二水物。
实验步骤:
I.
 的制备
的制备取5mL 85%磷酸(密度1.7
 )于200mL烧杯中,加入70mL水,混合均匀。加热至60℃,缓缓加入10g无水碳酸钠,搅拌,调pH至7,然后在搅拌条件下逐滴加入
)于200mL烧杯中,加入70mL水,混合均匀。加热至60℃,缓缓加入10g无水碳酸钠,搅拌,调pH至7,然后在搅拌条件下逐滴加入饱和
 溶液。使pH达到8.2~10.0。
溶液。使pH达到8.2~10.0。II.
 制备
制备将pH达到8.2~10.0的料液,转移至蒸发皿中,加热蒸发并不断搅拌。干涸后,将蒸发皿移入马弗炉中,控制温度为200~240℃继续加热一段时间后,冷却称重。
III.焦磷酸钙的制备
将称重后的焦磷酸钠配制成10%的水溶液,加热至90℃,在搅拌下慢慢注入15%
 至沉淀完全。静置,倾析法倾去上层清液。沉淀物每次用100mL洗涤剂洗涤三次,洗涤液用倾析法除去,然后抽滤,烘干。冷却后称重得焦磷酸钙8.5g。
至沉淀完全。静置,倾析法倾去上层清液。沉淀物每次用100mL洗涤剂洗涤三次,洗涤液用倾析法除去,然后抽滤,烘干。冷却后称重得焦磷酸钙8.5g。请回答下列问题:
(1)第I步中使pH达到8.2~10.0,可用酸碱指示剂上
(2)第I步中为使pH=9.9,可使用
A.广泛pH试纸 B.pH计
(3)第II步中不断搅拌的理由是
(4)第III步洗涤时使用的洗涤剂是沸水,其原因是
(5)第III步中用到的实验装置有
 |  |  |  |
| A | B | C | D |
您最近一年使用:0次
名校
9 . 三氯氧磷(POCl3)是一种重要的化工原料,常作为半导体掺杂剂及光导纤维原料。在实验室利用PCl3、SO2、Cl2在60~65℃时反应制备POCl3和SOCl2,所用实验装置和相关物质的性质的如图所示(气体制备装置、夹持、加热及搅拌装置略):

相关性质如表:
回答下列问题:
(1)氯气可由重铬酸钾与浓盐酸反应制备,该反应的离子方程式为____ 。
(2)A、B装置中的试剂分别是____ 、____ 。
(3)装置C中发生反应的化学方程式为____ 。
(4)反应装置的虚线框中未画出的仪器最好选用____ (填仪器名称);装置E的作用是____ 。
(5)反应结束后应采用____ (填操作名称)提纯POCl3产品。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取5.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000mol·L-1的AgNO3溶液25.00mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2,用0.1000mol·L-1KSCN标准溶液滴定,消耗KSCN标准溶液22.00mL。[已知:AgCl和AgSCN均为难溶于水的白色固体,Ag3PO4可溶于硝酸,M(POCl3)=153.5g•mol-1]
①说明滴定到达终点的实验现象为____ 。
②产品中POCl3的质量分数为____ (保留三位有效数字)。

相关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| PCl3 | -93.6 | 76.1 | 遇水强烈水解,易与O2反应 |
| POCl3 | 1.25 | 105.8 | 遇水强烈水解,能溶于PCl3 |
| SOCl2 | -105 | 78.8 | 遇水强烈水解,受热易分解 |
(1)氯气可由重铬酸钾与浓盐酸反应制备,该反应的离子方程式为
(2)A、B装置中的试剂分别是
(3)装置C中发生反应的化学方程式为
(4)反应装置的虚线框中未画出的仪器最好选用
(5)反应结束后应采用
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取5.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000mol·L-1的AgNO3溶液25.00mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2,用0.1000mol·L-1KSCN标准溶液滴定,消耗KSCN标准溶液22.00mL。[已知:AgCl和AgSCN均为难溶于水的白色固体,Ag3PO4可溶于硝酸,M(POCl3)=153.5g•mol-1]
①说明滴定到达终点的实验现象为
②产品中POCl3的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 化合物W是合成雌酮激素的中间体,科学家们采用下列合成路线来制备:
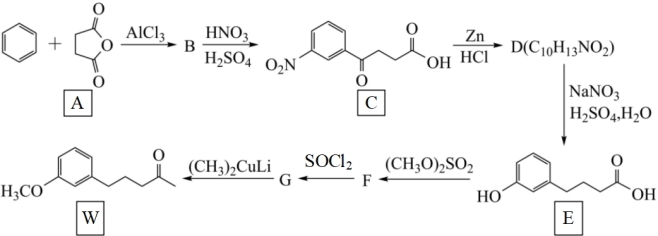
已知:RCOOH
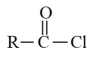
回答下列问题:
(1)合成B的反应是最理想的“原子经济性反应”,B的结构简式为____ 。
(2)C中含有的官能团的名称是羧基、____ 。
(3)已知D既能与酸发生反应,又能与碱发生反应,则C与Zn、盐酸反应生成D的化学方程式为____ 。G→W的反应类型是_____ 。
(4)满足下列条件的F的同分异构体有___ 种(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;
②既能发生水解反应,又能发生银镜反应;
③苯环上有四个取代基,且苯环上的一氯代物只有1种。
(5)由1,2—二溴乙烷制备可用于奶油香精双乙酰的合成路线如图:
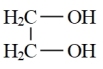
 X
X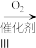 Y
Y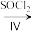
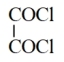
 双乙酰
双乙酰
①双乙酰的结构简式为____ 。反应Ⅰ的反应试剂和条件为____ 。
②写出X反应生成Y的化学方程式___ 。

已知:RCOOH

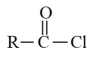
回答下列问题:
(1)合成B的反应是最理想的“原子经济性反应”,B的结构简式为
(2)C中含有的官能团的名称是羧基、
(3)已知D既能与酸发生反应,又能与碱发生反应,则C与Zn、盐酸反应生成D的化学方程式为
(4)满足下列条件的F的同分异构体有
①能与FeCl3溶液发生显色反应;
②既能发生水解反应,又能发生银镜反应;
③苯环上有四个取代基,且苯环上的一氯代物只有1种。
(5)由1,2—二溴乙烷制备可用于奶油香精双乙酰的合成路线如图:
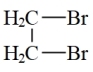
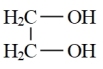
 X
X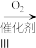 Y
Y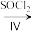
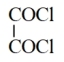
 双乙酰
双乙酰①双乙酰的结构简式为
②写出X反应生成Y的化学方程式
您最近一年使用:0次



