汽车尾气中含有CO和NO等,可以用不同的方法净化处理,防止空气污染。回答下列问题:
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。
①该反应在常温下能自发进行,则该反应的△H_______ 0(填“>”或“<”)。
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:
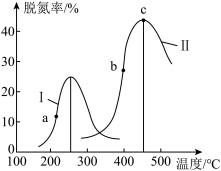
a点的v逆_______ b点的v正(填“>”“<”或“=”')。c点_______ (填“一定”或“不一定”)是平衡状态。
③对于反应2CO(g)+2NO(g) 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=_______ 。
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是_______ (填标号)。
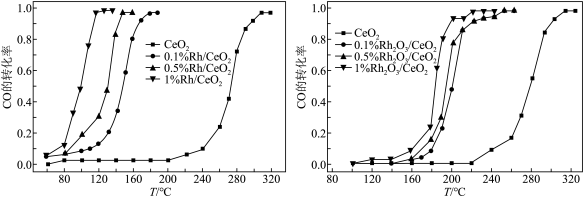
A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是__________ ,为了避免尿素过多造成的影响,可接一个氧化催化器,则氧化催化器中反应的化学方程式为_______ 。
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。①该反应在常温下能自发进行,则该反应的△H
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:

a点的v逆
③对于反应2CO(g)+2NO(g)
 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是

A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g)
 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
更新时间:2022-11-02 15:37:34
|
相似题推荐
【推荐1】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NO2经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。
T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g) NO2 (g) +O2(g) ΔH=-200.9kJ·mol-1
NO2 (g) +O2(g) ΔH=-200.9kJ·mol-1
2NO(g)+O2(g)⇌2NO2(g) ΔH=-116.2kJ·mol-1
SO2(g)+O3(g)⇌SO3(g) +O2 (g) ΔH=-241.6kJ·mol-1
(1)T℃时,反应3NO(g) +O3(g)⇌3NO2(g)的△H=_________________________ kJ·mol-1。
(2)T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图所示。
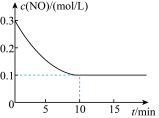
①T℃时,反应3NO(g) +O3(g)⇌3NO2(g)的平衡常数K=______________ 。
②不能说明反应达到平衡状态的是______________ 。
A.气体颜色不再改变
B.气体的平均摩尔质量不再改变
C.气体的密度不再改变
D.单位时间内生成O3和NO2的物质的量之比为1:3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空容器A、B中,反应起始时A、B的体积相同,均为aL(忽略导管中的气体体积)。

①若容器A中到达平衡所需时间为ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=________________ 。
②若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为__________ L。
③若平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数__________ (填“变大”“变小”或“不变”)。
I.污染物SO2、NO2经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。
T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)
 NO2 (g) +O2(g) ΔH=-200.9kJ·mol-1
NO2 (g) +O2(g) ΔH=-200.9kJ·mol-12NO(g)+O2(g)⇌2NO2(g) ΔH=-116.2kJ·mol-1
SO2(g)+O3(g)⇌SO3(g) +O2 (g) ΔH=-241.6kJ·mol-1
(1)T℃时,反应3NO(g) +O3(g)⇌3NO2(g)的△H=
(2)T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图所示。

①T℃时,反应3NO(g) +O3(g)⇌3NO2(g)的平衡常数K=
②不能说明反应达到平衡状态的是
A.气体颜色不再改变
B.气体的平均摩尔质量不再改变
C.气体的密度不再改变
D.单位时间内生成O3和NO2的物质的量之比为1:3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空容器A、B中,反应起始时A、B的体积相同,均为aL(忽略导管中的气体体积)。

①若容器A中到达平衡所需时间为ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=
②若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为
③若平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】燃煤废气中含有多种能回收利用的原料气,如CO2、SO2及氮氧化物等,对其综合利用,可以改善环境质量。回答下列问题:
(1)标准状况下,各元素最稳定单质生成标准状况下1mol某纯物质的热效应称为该物质的标准摩尔生成焓( )。将燃煤废气中的SO2富集后催化氧化可得到SO3。由表中数据,推测SO3(l)的
)。将燃煤废气中的SO2富集后催化氧化可得到SO3。由表中数据,推测SO3(l)的
_______ (填“>”、“<”或“=”)-395.7kJ·mol-1,写出SO2(g)与O2(g)生成SO3(g)的热化学方程式_______ 。
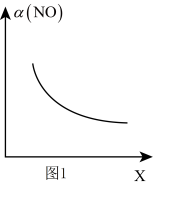
(2)亚硝酰氯(CINO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应2NO(g)+Cl2(g)⇌2CINO(g) ∆H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化关系如图1所示,则条件X可能是_______(填字母序号)。
(3)已知反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H=-746.5kJ∙mol-1,在密闭容器中充入4molCO和5molNO,平衡时NO的体积分数与温度、压强的关系如图2所示。
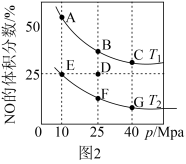
①反应在D点达到平衡后,若此时升高温度,同时扩大容器体积使压强减小,在重新达到平衡过程中,D点会向A~G点中的_______ 点移动。
②某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图3所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因是_______ ;a点_______ (填“是”或“不是”)对应温度下的平衡脱氮率,理由是_______ 。

(4)以连二亚硫酸根离子(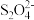 )为媒介,用电化学法处理烟气中NO的装置如图4所示。
)为媒介,用电化学法处理烟气中NO的装置如图4所示。

①阴极区的电极反应式为_______
②NO被吸收转化后的主要产物为 ,若通电时电路中转移了0.3mole-,则通电过程中理论上被吸收的NO在标准状况卜的体积为
,若通电时电路中转移了0.3mole-,则通电过程中理论上被吸收的NO在标准状况卜的体积为_______ mL。
(1)标准状况下,各元素最稳定单质生成标准状况下1mol某纯物质的热效应称为该物质的标准摩尔生成焓(
 )。将燃煤废气中的SO2富集后催化氧化可得到SO3。由表中数据,推测SO3(l)的
)。将燃煤废气中的SO2富集后催化氧化可得到SO3。由表中数据,推测SO3(l)的
| 物质 | O2(g) | SO2(g) | SO3(g) |
 /kJ∙mol-1 /kJ∙mol-1 | 0 | -296.8 | -395.7 |

| A.温度 | B.压强 | C. | D.与催化剂的接触面积 |

①反应在D点达到平衡后,若此时升高温度,同时扩大容器体积使压强减小,在重新达到平衡过程中,D点会向A~G点中的
②某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图3所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因是

(4)以连二亚硫酸根离子(
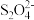 )为媒介,用电化学法处理烟气中NO的装置如图4所示。
)为媒介,用电化学法处理烟气中NO的装置如图4所示。
①阴极区的电极反应式为
②NO被吸收转化后的主要产物为
 ,若通电时电路中转移了0.3mole-,则通电过程中理论上被吸收的NO在标准状况卜的体积为
,若通电时电路中转移了0.3mole-,则通电过程中理论上被吸收的NO在标准状况卜的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】尿素 是首个由无机物人工合成的有机物。工业上合成尿素的反应为:
是首个由无机物人工合成的有机物。工业上合成尿素的反应为: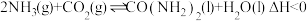 。回答下列问题:
。回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应I: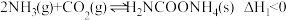 ;
;
反应II: ;
;
下列示意图中[a表示 ,b表示
,b表示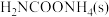 ,c表示
,c表示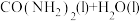 ],能正确表示尿素合成过程中能量变化的曲线是_______。
],能正确表示尿素合成过程中能量变化的曲线是_______。
(2)在恒温恒容的密闭容器中充入物质的量之比为2∶1的氨气和二氧化碳,发生反应: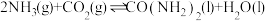 ,可判断其达到平衡状态的是_______。
,可判断其达到平衡状态的是_______。
(3)某实验小组甲模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按物质的量之比2∶1充入一体积为 的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经
的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经 达到平衡,各物质浓度的变化曲线如下图所示。
达到平衡,各物质浓度的变化曲线如下图所示。
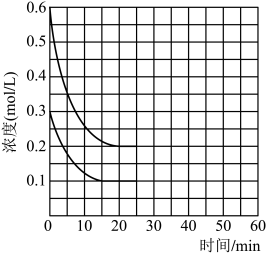
①在上述条件下,从反应开始至 时,二氧化碳的平均反应速率为
时,二氧化碳的平均反应速率为 _______ ;
②实验小组乙为提高尿素的平衡产率,对甲组实验进行了改进(其它条件相同,且保持反应过程恒温恒容),下列可以采取的措施有_______ ;
A.改用 的密闭容器 B.采用更高的温度
的密闭容器 B.采用更高的温度
C.充入一定量的氦气 D.使用合适的催化剂
 是首个由无机物人工合成的有机物。工业上合成尿素的反应为:
是首个由无机物人工合成的有机物。工业上合成尿素的反应为: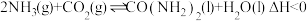 。回答下列问题:
。回答下列问题:(1)已知工业上合成尿素分两步进行,相关反应如下:
反应I:
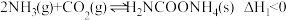 ;
;反应II:
 ;
;下列示意图中[a表示
 ,b表示
,b表示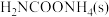 ,c表示
,c表示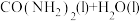 ],能正确表示尿素合成过程中能量变化的曲线是_______。
],能正确表示尿素合成过程中能量变化的曲线是_______。A.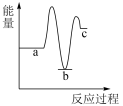 | B.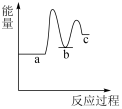 | C.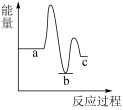 | D.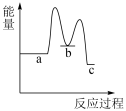 |
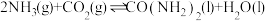 ,可判断其达到平衡状态的是_______。
,可判断其达到平衡状态的是_______。| A.氨气的体积分数不再变化 | B.氨气的转化率不再变化 |
| C.气体的平均摩尔质量不再变化 | D.气体的密度不再变化 |
 的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经
的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经 达到平衡,各物质浓度的变化曲线如下图所示。
达到平衡,各物质浓度的变化曲线如下图所示。
①在上述条件下,从反应开始至
 时,二氧化碳的平均反应速率为
时,二氧化碳的平均反应速率为 ②实验小组乙为提高尿素的平衡产率,对甲组实验进行了改进(其它条件相同,且保持反应过程恒温恒容),下列可以采取的措施有
A.改用
 的密闭容器 B.采用更高的温度
的密闭容器 B.采用更高的温度C.充入一定量的氦气 D.使用合适的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________ ;充入氮气,混合气体的密度__________________ (填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
①上述盐溶液中的阴离子,水解能力最弱的是__________________ 。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______ (填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______ (填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______ mol·L-1,此时溶液中c(CrO42-)等于_______ mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
(1)可逆反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
| T/K | 938 | 1100 |
| K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,水解能力最弱的是
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)将5mL0.005mol/L的 溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
①若滴加1mol/LKSCN溶液4滴,平衡___________ (填“正向”“不”或“逆向”,②同)移动,溶液红色___________ 。
②若滴加3滴浓KCl溶液,则平衡___________ 移动。
(2)火箭发射时可以用肼( ,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol
,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol 在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(3)在探究温度对化学平衡影响的实验中。已知,绿色 水溶液中存在如下平衡:
水溶液中存在如下平衡: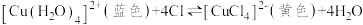
 ,加热的实验现象是溶液变为
,加热的实验现象是溶液变为___________ 色,由此得出的结论是___________ 。
(4)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得了诺贝尔化学奖。
①工业上合成氨反应的化学方程式为___________ 。
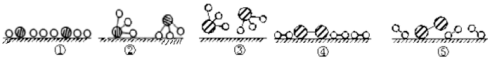
②用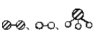 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列)
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列) ___________
状态①、②、④中,能量最高的状态是___________ 。
(1)将5mL0.005mol/L的
 溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。①若滴加1mol/LKSCN溶液4滴,平衡
②若滴加3滴浓KCl溶液,则平衡
(2)火箭发射时可以用肼(
 ,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol
,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol 在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
在上述反应中放出64.22kJ的热量,该反应的热化学方程式为(3)在探究温度对化学平衡影响的实验中。已知,绿色
 水溶液中存在如下平衡:
水溶液中存在如下平衡:
 ,加热的实验现象是溶液变为
,加热的实验现象是溶液变为(4)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得了诺贝尔化学奖。
①工业上合成氨反应的化学方程式为
②用
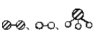 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列)
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列) 
状态①、②、④中,能量最高的状态是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
I.已知25℃和101kPa下:
①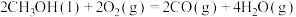

②

③

(1)则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
II. 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol
在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol 和
和 ,发生反应:
,发生反应:
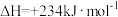
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)下列能判断 达到平衡状态的是______(填序号)。
达到平衡状态的是______(填序号)。
III.已知 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: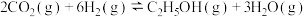
 设m为起始时的投料比,即
设m为起始时的投料比,即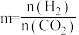 。
。
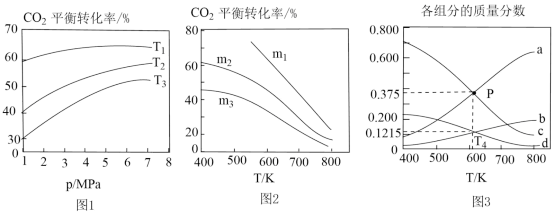
(4)图1中投料比相同,温度从高到低的顺序为___________ 。
(5)图2中 、
、 、
、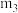 从大到小的顺序为
从大到小的顺序为___________ 。
(6)图3表示在总压为5MPa的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为
时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为___________ 。
IV.工业上可用丙烯加成法制备1,2-二氯丙烷( ),主要副产物为3-氯丙烯(
),主要副产物为3-氯丙烯( ),反应原理为:
),反应原理为:
①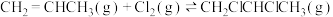
②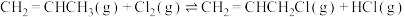
一定温度下,向恒容密闭容器中充入等物质的量的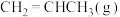 和
和 发生反应,容器内气体的压强随时间的变化如表所示。
发生反应,容器内气体的压强随时间的变化如表所示。
(7)用单位时间内气体分压的变化表示反应①的反应速率,即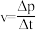 ,则前120min内平均反应速率
,则前120min内平均反应速率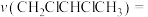
___________ 。
(8)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数
___________  (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
I.已知25℃和101kPa下:
①
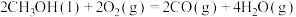

②


③


(1)则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为II.
 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol
在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol 和
和 ,发生反应:
,发生反应:
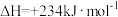
(2)该反应在
(3)下列能判断
 达到平衡状态的是______(填序号)。
达到平衡状态的是______(填序号)。| A.一定温度下,容积固定的容器中,密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
III.已知
 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: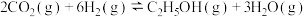
 设m为起始时的投料比,即
设m为起始时的投料比,即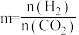 。
。
(4)图1中投料比相同,温度从高到低的顺序为
(5)图2中
 、
、 、
、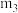 从大到小的顺序为
从大到小的顺序为(6)图3表示在总压为5MPa的恒压条件下,且
 时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为
时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为IV.工业上可用丙烯加成法制备1,2-二氯丙烷(
 ),主要副产物为3-氯丙烯(
),主要副产物为3-氯丙烯( ),反应原理为:
),反应原理为:①
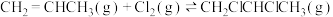
②
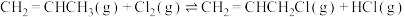
一定温度下,向恒容密闭容器中充入等物质的量的
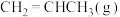 和
和 发生反应,容器内气体的压强随时间的变化如表所示。
发生反应,容器内气体的压强随时间的变化如表所示。| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
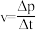 ,则前120min内平均反应速率
,则前120min内平均反应速率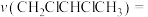
(8)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数

 (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
【推荐1】丙烯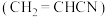 是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈
是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈 、氢氰酸、丙烯醛
、氢氰酸、丙烯醛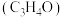 等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈
等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈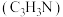 的主要反应如下:
的主要反应如下:
Ⅰ.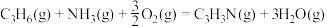
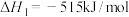
Ⅱ.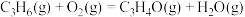
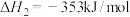
回答下列问题:
(1)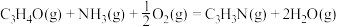

_______  。
。
(2)反应Ⅰ在_______ (填“高温”“低温”或“任意”)条件下可自发进行:恒温,体系达到平衡后,若压缩容器体积,则反应Ⅱ的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(3)工业生产条件下的丙烯氨氧化过程十分复杂。下列说法正确的是_______。
(4)已知对于反应: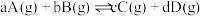 ,其标准平衡常数:
,其标准平衡常数: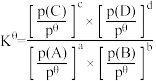 。T℃,压强为
。T℃,压强为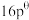 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol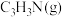 ,b mol
,b mol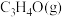 ,此时
,此时 的分压
的分压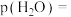
_______ (分压=总压×物质的量分数,用含a,b的代数式表示,下同);反应Ⅱ的标准平衡常数为_______ 。
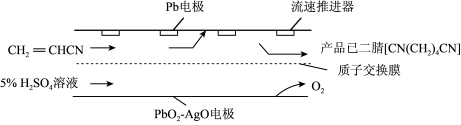
(5)以丙烯腈为原料,利用电解原理合成已二腈 可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为
可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为_______ 。
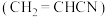 是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈
是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈 、氢氰酸、丙烯醛
、氢氰酸、丙烯醛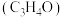 等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈
等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈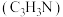 的主要反应如下:
的主要反应如下:Ⅰ.
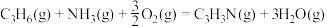
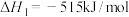
Ⅱ.
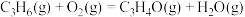
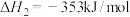
回答下列问题:
(1)
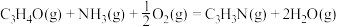

 。
。(2)反应Ⅰ在
(3)工业生产条件下的丙烯氨氧化过程十分复杂。下列说法正确的是_______。
| A.原料丙烯可以从石油裂解气中分离得到 |
| B.为提高丙烯的平衡转化率和丙烯腈的选择性,需要研究高性能催化剂 |
| C.加入水蒸气可防止原料混合气中丙烯与空气的比例处于爆炸范围内产生危险 |
| D.生产过程中会产生大量的含氰废水,对环境的危害很大,排放前必须除去 |
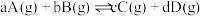 ,其标准平衡常数:
,其标准平衡常数: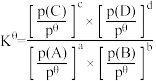 。T℃,压强为
。T℃,压强为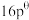 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol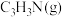 ,b mol
,b mol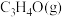 ,此时
,此时 的分压
的分压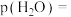
(5)以丙烯腈为原料,利用电解原理合成已二腈
 可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为
可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】在反应原理部分,我们经常以H2和I2的反应为例来研究化学反应速率和平衡。
(1)在2L的容器中充入H2、I2各1mol,对于反应:H2(g)+I2(g) 2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
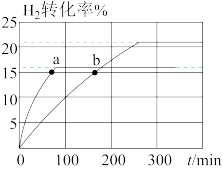
①323K时反应的平衡转化率 =
=__________ %。平衡常数K=____________ (保留2位小数)。
②在343K时,要提高I2转化率,可采取的措施是____ ( 答出两条);要缩短反应达到平衡的时间,可采取的措施有___ ( 答出两条)。
③比较a、b处反应速率大小:v(a)____ v(b)(填 “大于”“小于”或“等于”)。反应速率v正=k正x(H2)x(I2),v逆=k逆x2(HI),k正、 k逆分别为正、逆反应速率常数[k逆(323)=5,k逆(343)=7],x为物质的量分数,计算b处v正=________ mol/(L ∙ min)(保留1位小数)。
(2)对于反应:H2(g)+I2(g) 2HI(g)提出如下反应历程
2HI(g)提出如下反应历程
第一步:I2 I+I(快速平衡)
I+I(快速平衡)
第二步:H2+2I→2HI (慢反应)
其中可近似认为第二步反应不影响第一步的平衡。 下列表述正确的是______ ( 填字母序号)。
a.v(第一步的逆反应)<v(第二步的逆反应)
b.反应的中间产物只有I
c.第二步反应活化能较低
d.第二步中H2与I的碰撞仅部分有效
(3)已知反应2HI(g) H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
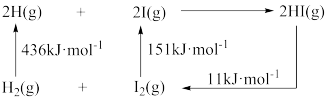
(1)在2L的容器中充入H2、I2各1mol,对于反应:H2(g)+I2(g)
 2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
①323K时反应的平衡转化率
 =
=②在343K时,要提高I2转化率,可采取的措施是
③比较a、b处反应速率大小:v(a)
(2)对于反应:H2(g)+I2(g)
 2HI(g)提出如下反应历程
2HI(g)提出如下反应历程第一步:I2
 I+I(快速平衡)
I+I(快速平衡)第二步:H2+2I→2HI (慢反应)
其中可近似认为第二步反应不影响第一步的平衡。 下列表述正确的是
a.v(第一步的逆反应)<v(第二步的逆反应)
b.反应的中间产物只有I
c.第二步反应活化能较低
d.第二步中H2与I的碰撞仅部分有效
(3)已知反应2HI(g)
 H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为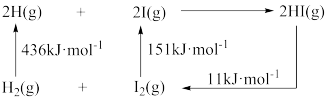
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】节能减排CO2建设友好型社会的必然选择。
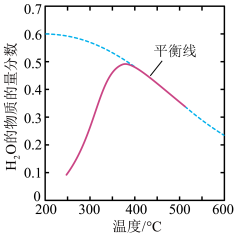
(1)CO2可与H2生成CH4:CO2(g)+4H2(g) CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而
CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而___ (填“增大”或“减小”)。恒温条件下,反应经过5min达到平衡,此时压强为初始的0.8倍,用H2表示该阶段化学反应速率为___ 。
(2)在恒温(T>100℃)恒容装置中进行该反应,达到平衡状态的是___ 。
a.混合气体密度不再改变
b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变
d.n(CO2):n(H2)=1:2
(3)原料气CO2可与H2通过如下反应制备:
①C(s)+CO2(g) 2CO(g)+akJ②CO(g)+H2O(g)
2CO(g)+akJ②CO(g)+H2O(g) H2(g)+CO2(g)+bkJ
H2(g)+CO2(g)+bkJ
某反应的平衡常数表达式K=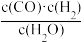 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___ 。
(4)CO2还可与H2生成CH3OH,CO2(g)+3H2(g) CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是
CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是___ 。
a.使用催化剂 b.加压 c.增大初始投料比
某温度下该反应的K=450,向该温度下2L的容器内分别投入0.2molH2、0.6molCO2、0.4molCH3OH和0.4molH2O,则反应向___ 方向进行(填“正”或“逆”)。
(4)上述反应存在副反应H2(g)+CO2(g) CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):
CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):
甲醇选择性:转化的CO2中生成甲醇的百分比。
数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,可能的原因是:___ 。
(1)CO2可与H2生成CH4:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而
CH4(g)+2H2O(g)。将原料气按n(CO2):n(H2)=1mol:4mol置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度降低而
(2)在恒温(T>100℃)恒容装置中进行该反应,达到平衡状态的是
a.混合气体密度不再改变
b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变
d.n(CO2):n(H2)=1:2
(3)原料气CO2可与H2通过如下反应制备:
①C(s)+CO2(g)
 2CO(g)+akJ②CO(g)+H2O(g)
2CO(g)+akJ②CO(g)+H2O(g) H2(g)+CO2(g)+bkJ
H2(g)+CO2(g)+bkJ某反应的平衡常数表达式K=
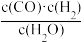 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)CO2还可与H2生成CH3OH,CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是
CH3OH(g)+H2O(g)+Q1。下列措施有利于提高合成CH3OH反应中CO2的平衡转化率的是a.使用催化剂 b.加压 c.增大初始投料比

某温度下该反应的K=450,向该温度下2L的容器内分别投入0.2molH2、0.6molCO2、0.4molCH3OH和0.4molH2O,则反应向
(4)上述反应存在副反应H2(g)+CO2(g)
 CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):
CO(g)+H2O(g)+Q2,控制压强一定,CO2和H2初始比一定,经过相同时间测得如下数据(反应未达平衡):| T(K) | CO2的实际转化率(%) | 甲醇的选择性(%) |
| 543 | 12.3 | 42.3 |
| 533 | 15.3 | 39.1 |
数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,可能的原因是:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2直接加氢。将n(CO2)∶n(H2)=1∶4的混合气体充入某密闭容器中,在一定温度下,同时自发发生反应1和反应2。
已知:反应1CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1>0
反应2CO2(g)+H2(g)⇌HCOOH(g) ΔH2
①ΔH2_______ 0(填“>”“<”)。
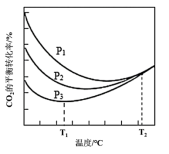
②不同压强下,实验测定CO2的平衡转化率随温度的变化关系如图所示。已知P1>P2>P3,P3时在T1℃之后CO2的转化率随温度升高而增大的原因是_______ 。
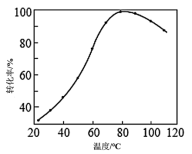
(2)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO−,其离子方程式为_______ ;其他条件不变,HCO 转化为HCOO−的转化率随温度的变化关系如图所示。反应温度在40℃~80℃范围内,HCO
转化为HCOO−的转化率随温度的变化关系如图所示。反应温度在40℃~80℃范围内,HCO 催化加氢的转化率迅速上升的可能原因是
催化加氢的转化率迅速上升的可能原因是_______ 。
(3)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极间用允许K+、H+通过的半透膜隔开。
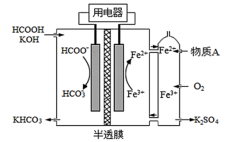
①结合电极反应式解释电池放电过程中生成KHCO3的原因_______ 。
②放电过程中需补充的物质A为_______ (填化学式);用化学用语解释装置中Fe3+再生的原因_______ 。
③该燃料电池放电的本质是HCOOH与O2的反应,离子方程式为_______ 。
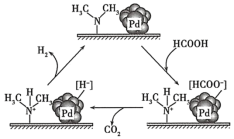
(4)HCOOH催化分解制备氢气。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图所示。研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是提高释放氢气的速率和_______ 。
(1)CO2直接加氢。将n(CO2)∶n(H2)=1∶4的混合气体充入某密闭容器中,在一定温度下,同时自发发生反应1和反应2。
已知:反应1CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1>0
反应2CO2(g)+H2(g)⇌HCOOH(g) ΔH2
①ΔH2
②不同压强下,实验测定CO2的平衡转化率随温度的变化关系如图所示。已知P1>P2>P3,P3时在T1℃之后CO2的转化率随温度升高而增大的原因是

(2)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO−,其离子方程式为
 转化为HCOO−的转化率随温度的变化关系如图所示。反应温度在40℃~80℃范围内,HCO
转化为HCOO−的转化率随温度的变化关系如图所示。反应温度在40℃~80℃范围内,HCO 催化加氢的转化率迅速上升的可能原因是
催化加氢的转化率迅速上升的可能原因是
(3)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极间用允许K+、H+通过的半透膜隔开。

①结合电极反应式解释电池放电过程中生成KHCO3的原因
②放电过程中需补充的物质A为
③该燃料电池放电的本质是HCOOH与O2的反应,离子方程式为
(4)HCOOH催化分解制备氢气。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图所示。研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是提高释放氢气的速率和

您最近一年使用:0次
【推荐2】氢能是一种绿色能源,甲醇可通过电催化和催化重整制取氢气。回答下列问题:
(1)用金属-有机骨架纳米片作阳极,电催化甲醇溶液(碱性)高效生产H2的装置如下:
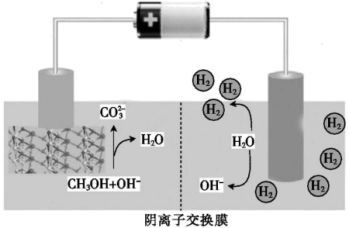
向阳极区迁移的离子是_______ ;阳极的电极反应式为_______ 。
(2)甲醇水蒸气重整制氢在不同催化剂条件下机理不相同,在MoC表面机理如下:
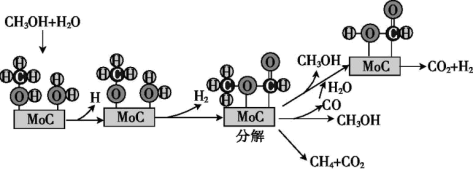
请补充下列方程式:
CH3OH→CH3O+H,2CH3O→H2+CH3OCHO,_______ ,_______ 。
主要副反应:CH3OCHO→CO+CH3OH CH3OCHO→CH4+CO2
(3)甲醇水蒸气重整反应:
I.CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
II.CH3OH(g)⇌CO(g)+2H2(g) ΔH2=+90.1 kJ·mol-1
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
①ΔH3=_______ kJ·mol-1。
②反应II自发进行的条件是_______ (填字母)。
A.高温 B.低温 C.任何温度
③若在恒温恒压密闭容器中充入2 mol CH4和4 mol H2O蒸气,起始时压强为p,加入适当催化剂发生反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)(不考虑其他反应),平衡时CH4转化率为50%,达到平衡时,p(H2)=_______ ;平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
(1)用金属-有机骨架纳米片作阳极,电催化甲醇溶液(碱性)高效生产H2的装置如下:

向阳极区迁移的离子是
(2)甲醇水蒸气重整制氢在不同催化剂条件下机理不相同,在MoC表面机理如下:

请补充下列方程式:
CH3OH→CH3O+H,2CH3O→H2+CH3OCHO,
主要副反应:CH3OCHO→CO+CH3OH CH3OCHO→CH4+CO2
(3)甲醇水蒸气重整反应:
I.CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
II.CH3OH(g)⇌CO(g)+2H2(g) ΔH2=+90.1 kJ·mol-1
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
①ΔH3=
②反应II自发进行的条件是
A.高温 B.低温 C.任何温度
③若在恒温恒压密闭容器中充入2 mol CH4和4 mol H2O蒸气,起始时压强为p,加入适当催化剂发生反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)(不考虑其他反应),平衡时CH4转化率为50%,达到平衡时,p(H2)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氨基羧酸盐在工农业、生活中有着广泛应用,其中氨基甲酸铵(NH2COONH4)可用作肥料、洗涤剂等。实验室用下图所示装置制备氨基甲酸铵,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则主要生成碳酸氢铵。
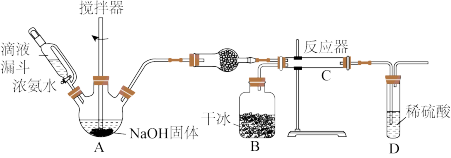
(1)盛放NaOH固体的仪器名称是_______ ,干燥管中的试剂为_______ 。
(2)无水条件下合成氨基甲酸铵的化学反应方程式为_______ ;若该反应能自发进行,则该反应的
_______ 0,(填“>”或“<”);对比碳酸钙和盐酸反应制取CO2,该实验利用干冰升华制取CO2,其优点有_______ 。
A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是_______ 。(写出其中任意1条)
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)______
(5)该小组在上述实验方案基础上又进行了探究,分别用两份不同初始浓度的氨基甲酸铵溶液在不同温度下测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。根据图中信息,能说明该水解反应速率随温度升高而加快的证据是_______ 。


(1)盛放NaOH固体的仪器名称是
(2)无水条件下合成氨基甲酸铵的化学反应方程式为

A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)
| 物理量 实验序号 | 温度T(℃) | 导电率变化量∆S | … | |||
| 1 | a | b | ||||
| 2 | a | b |

您最近一年使用:0次



