名校
解题方法
1 . 亚硝酸钠(NaNO2)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是____ ,装置乙的作用是____ 。
(2)甲中滴入稀硝酸前需先通入N2,原因是____ 。
(3)甲装置中发生反应的离子方程式为____ 。
(4)反应过程中观察到丙中的现象为___ 。
(5)丁中酸性KMnO4的作用是____ 。
(6)设计实验证明丙装置有NaNO2生成____ (写出操作、试剂和现象)。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是
(2)甲中滴入稀硝酸前需先通入N2,原因是
(3)甲装置中发生反应的离子方程式为
(4)反应过程中观察到丙中的现象为
(5)丁中酸性KMnO4的作用是
(6)设计实验证明丙装置有NaNO2生成
您最近一年使用:0次
2022-07-12更新
|
335次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
2 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
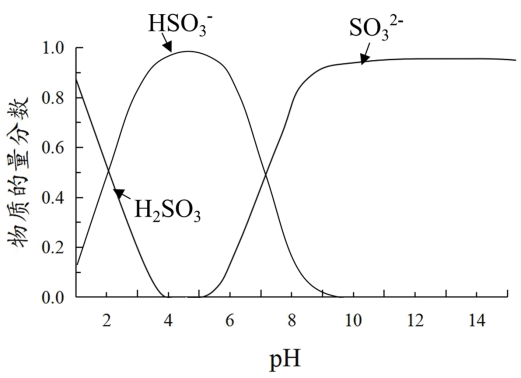
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1805次组卷
|
6卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题天天练6-10
名校
解题方法
3 . 铜是生活中常见的金属,以铜为原料进行如下实验。回答下列问题:
Ⅰ.制备
(1)利用铜与浓硫酸制备 ,适宜的装置是
,适宜的装置是_______ (从A、B、C中选择),该装置内发生的化学方程式为_______ 。
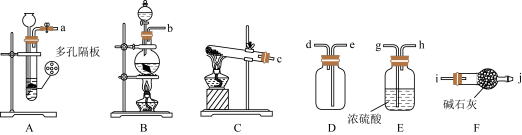
(2)收集干燥的 ,所需装置的接口连接顺序为:发生装置→
,所需装置的接口连接顺序为:发生装置→_______ (填小写字母)。
(3)反应后,发生装置中未观察到蓝色溶液,原因是_______ 。
Ⅱ.探究温度对铜与过氧化氢反应的影响
向10mL30%的 溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为
溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。
(4)写出生成 的离子方程式
的离子方程式_______ 。
(5)学习小组提出猜想:升高温度, 催化能力增强,该小组设计如下实验验证猜想。
催化能力增强,该小组设计如下实验验证猜想。
①小组同学认为实验1~3的结果,不能证明猜想成立,理由是_______ 。
②为进一步验证猜想,完善实验4~6的方案(答案填在答题卡上)_______ 。小组同学结合实验1~6,判断猜想成立,依据是_______ 。
Ⅰ.制备

(1)利用铜与浓硫酸制备
 ,适宜的装置是
,适宜的装置是
(2)收集干燥的
 ,所需装置的接口连接顺序为:发生装置→
,所需装置的接口连接顺序为:发生装置→(3)反应后,发生装置中未观察到蓝色溶液,原因是
Ⅱ.探究温度对铜与过氧化氢反应的影响
向10mL30%的
 溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为
溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。(4)写出生成
 的离子方程式
的离子方程式(5)学习小组提出猜想:升高温度,
 催化能力增强,该小组设计如下实验验证猜想。
催化能力增强,该小组设计如下实验验证猜想。| 实验序号 | 30%H2O2(mL) | 1mol/LCuSO4(mL) | 水(mL) | 水浴温度(℃) | 3min时生成O2的平均速率(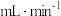 ) ) |
| 1 | 10 | 1 | 1 | 20 | 2.4 |
| 2 | 10 | 1 | 1 | 30 | 9 |
| 3 | 10 | 1 | 1 | 40 | 90 |
| 4 | 10 | 0 | 2 | 20 | A1 |
| 5 | A2 | ||||
| 6 | 10 | 0 | 2 | 40 | A3 |
②为进一步验证猜想,完善实验4~6的方案(答案填在答题卡上)
您最近一年使用:0次
2022-04-15更新
|
1536次组卷
|
9卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)押广东卷化学第17题 化学实验综合题-备战2022年高考化学临考题号押题(广东卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题甘肃省兰州市外国语高级中学2022-2023学年高三上学期第二次考试化学试题湖南省湘潭市第一中学2023届高三上学期第五次月考化学试题广东省广州市玉岩中学2024届高三上学期10月月考化学试题
名校
解题方法
4 . 已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D化合形成甲、乙、丙三种分子,均含有相同数目的电子。丙与甲、乙均能发生化学反应,且甲、丙为无色有刺激性气味的气体,丁与C的某种单质在常温条件下反应生成红棕色气体;B、C、D三种元素的单质与甲、乙、丁三种化合物之间存在如图所示的转化关系:

(1)丙的化学式为_______ 。
(2)丁与C的常见的单质在常温下反应生成红棕色气体的化学方程式为_______ 。
(3)B、C、D原子半径由大到小顺序为_______ (用元素符号表示)。
(4)B的单质+乙→甲+C的单质的化学方程式为_______ 。

(1)丙的化学式为
(2)丁与C的常见的单质在常温下反应生成红棕色气体的化学方程式为
(3)B、C、D原子半径由大到小顺序为
(4)B的单质+乙→甲+C的单质的化学方程式为
您最近一年使用:0次
2022-03-22更新
|
688次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
名校
解题方法
5 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
2021-11-05更新
|
1091次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
6 . 今有碱金属的两种碳酸盐和碱土金属(镁、钙等二价金属)的一种不溶性碳酸盐(碱式盐)组成的混合物。取7.560g该混合物与过量盐酸完全反应,放出CO2体积为1.344L(标准状况)。另取等质量的原混合物加水搅拌,可虑出不溶性盐1.420g
(1)过滤后1/10体积的滤液,向其中缓慢滴加浓度为0.2500mol/L的盐酸,并同时记录放出的CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。

写出向滤液中缓慢滴加盐酸的有关化学方程式(写离子方程式不给分):_______ 、_______ 。
(2)将滤出的不溶性盐(420g)投入到浓度为2.500mol/L盐酸中,当反应完全时,耗去16.00mL盐酸。写出原不溶性碳酸盐与盐酸反应的离子方程式:_______ 。
(1)过滤后1/10体积的滤液,向其中缓慢滴加浓度为0.2500mol/L的盐酸,并同时记录放出的CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。

写出向滤液中缓慢滴加盐酸的有关化学方程式(写离子方程式不给分):
(2)将滤出的不溶性盐(420g)投入到浓度为2.500mol/L盐酸中,当反应完全时,耗去16.00mL盐酸。写出原不溶性碳酸盐与盐酸反应的离子方程式:
您最近一年使用:0次
7 . 下图中D经氧化可以得到C,烃G分子中有2个甲基。

根据上图回答下列问题:
(1)B的分子式是_______ 。D的名称(系统命名)是_______ 。
(2)反应①的化学方程式是(有机物须用结构简式表示):_______ 。

根据上图回答下列问题:
(1)B的分子式是
(2)反应①的化学方程式是(有机物须用结构简式表示):
您最近一年使用:0次
解题方法
8 . 按要求完成下列各题。
(1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤取代物。如:

这一系列烷烃具有一定的规律性,当一种烃分子的一H全部被-CH3取代后,它的一卤代物异构体数目不变。
①请写出这一系列烷烃分子式的通式_______ 。
②人们在研究中发现另系列烷烃分子也只有一种一卤取代物,请写出它们分子的通式_______ 。
(2)化合物A、B和C互为同分异构体。它们的元素分析数据为:碳92.3%,氢7.7%。1molA在氧气中充分燃烧产生179.2LCO2(标准状况)。A是芳香化合物,分子中所有的原子共平面;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,偶极矩等于零;C是烷烃,分子中碳原子的化学环境完全相同。
①A、B和C的分子式为_______ 。
②画出A、B和C的结构简式:A:_______ ;B:_______ ;C:_______ 。
(1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤取代物。如:

这一系列烷烃具有一定的规律性,当一种烃分子的一H全部被-CH3取代后,它的一卤代物异构体数目不变。
①请写出这一系列烷烃分子式的通式
②人们在研究中发现另系列烷烃分子也只有一种一卤取代物,请写出它们分子的通式
(2)化合物A、B和C互为同分异构体。它们的元素分析数据为:碳92.3%,氢7.7%。1molA在氧气中充分燃烧产生179.2LCO2(标准状况)。A是芳香化合物,分子中所有的原子共平面;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,偶极矩等于零;C是烷烃,分子中碳原子的化学环境完全相同。
①A、B和C的分子式为
②画出A、B和C的结构简式:A:
您最近一年使用:0次
解题方法
9 . 用下面两种方法可以实现浓硫酸与蔗糖反应。
方法一:向蔗糖中加入浓硫酸的实验如下图,回答有关问题。

(1)向盛有蔗糖的烧杯中加几滴水的目的是:_______ 。
(2)写出该实验发生的主要反应的化学方程式:_______ 、_______ 。
方法二:某课外小组用下图装置实现浓硫酸与蔗糖反应并检验反应的气体产物。

(3)上图中装置设计不够完善,请你提出改进意见:_______ ,_______ 。
(4)为了检验生成的气体产物B、E中的药品分别是:B_______ 、E_______ 。
(5)与方法一比较,方法二的最大优点是_______ 。
方法一:向蔗糖中加入浓硫酸的实验如下图,回答有关问题。

(1)向盛有蔗糖的烧杯中加几滴水的目的是:
(2)写出该实验发生的主要反应的化学方程式:
方法二:某课外小组用下图装置实现浓硫酸与蔗糖反应并检验反应的气体产物。

(3)上图中装置设计不够完善,请你提出改进意见:
(4)为了检验生成的气体产物B、E中的药品分别是:B
(5)与方法一比较,方法二的最大优点是
您最近一年使用:0次
解题方法
10 . X、R是气体,X、D是单质,图中部分产物略去。回答下列问题:
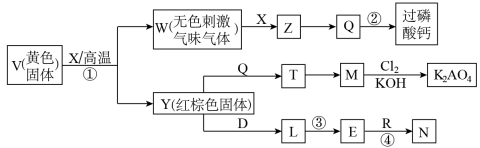
(1)V、W、Z、Q中含有同一种元素甲,指出元素甲形成的单质属于_______ 晶体(填晶体类型),反应②是Q的重要用途,写出反应②的化学方程式_______ 。
(2)V、Y、T、M含有同一种元素A,写出A的外围电子层排布_______ ,写出沉淀M被Cl2氧化为K2AO4的化学方程式_______ 。
(3)L形成的陶瓷熔点高、硬度大;N是白色胶状沉淀,若R分子呈三角锥形,反应③的离子方程式为_______ ,若R分子呈直线型,写出反应④的离子方程式_______ 。

(1)V、W、Z、Q中含有同一种元素甲,指出元素甲形成的单质属于
(2)V、Y、T、M含有同一种元素A,写出A的外围电子层排布
(3)L形成的陶瓷熔点高、硬度大;N是白色胶状沉淀,若R分子呈三角锥形,反应③的离子方程式为
您最近一年使用:0次



