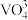真题
解题方法
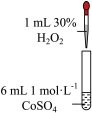
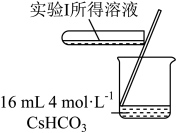
1 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、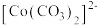 为红色、
为红色、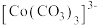 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
(1)配制 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明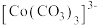 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、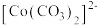 为红色、
为红色、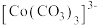 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b. 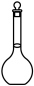 c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是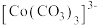 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
名校
2 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。
回答下列问题:
(1) 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有_____ (填序号)。
a.金属键 b.离子键 c.配位键 d.氢键
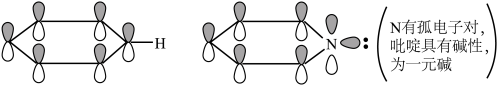
(2)下列关于胍(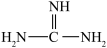 )的说法正确的是
)的说法正确的是________ (填序号)。
a.胍中C的杂化方式与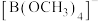 中B的相同
中B的相同
b.与 互为等电子体
互为等电子体
c.有大 键:
键: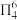
d.为一元碱
(3) 酸性条件下的水解产物是
酸性条件下的水解产物是__________ 和__________ (均写结构简式)。
(4)化合物A(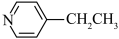 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
①化合物A最多有__________ 个碳原子共平面。
②化合物A的碱性比吡啶__________ (填“强”或“弱”)。
③化合物A的六元环芳香同分异构体有__________ 种。
 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。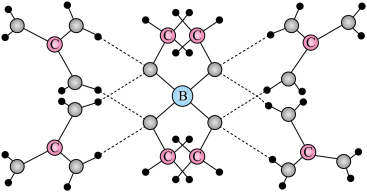
苯( | 吡啶( | |
重原子数 | 6 |
|
价电子数 |
|
|
关系 | 互为等电子体 | |
| ||
共同特点 | 有大 | |
具有芳香性 | ||
(1)
 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有a.金属键 b.离子键 c.配位键 d.氢键
(2)下列关于胍(
 )的说法正确的是
)的说法正确的是a.胍中C的杂化方式与
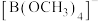 中B的相同
中B的相同b.与
 互为等电子体
互为等电子体c.有大
 键:
键:
d.为一元碱
(3)
 酸性条件下的水解产物是
酸性条件下的水解产物是(4)化合物A(
 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。①化合物A最多有
②化合物A的碱性比吡啶
③化合物A的六元环芳香同分异构体有
您最近一年使用:0次
名校
3 . 废旧芯片中常含有大量的单质Si和少量的Au、Ag、Cu等金属。某化学兴趣小组设计了如下图所示方法回收废旧芯片中的Au、Ag并制取硝酸铜晶体[Cu(NO3)2·6H2O]。 。
。
请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:_______ 、_______ 。
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式_______ 。
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式_______ 。
(4)金属A的名称是_______ 。
(5)操作X包括了_______ 过滤、洗涤、晾干。
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比_______ 。
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是_______ 。
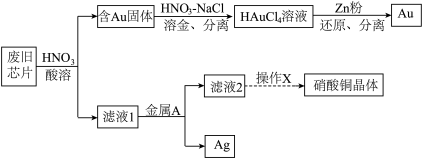
 。
。请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式
(4)金属A的名称是
(5)操作X包括了
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO
 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是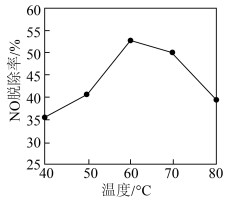
您最近一年使用:0次
4 . 某学习小组为探究Mg与酸、碱、盐溶液的反应。完成如下实验:
回答下列问题:
(1)实验前除去镁表面氧化物的方法是______ 。
(2)实验Ⅰ的离子方程式为____________ 。
(3)经实验分析,实验Ⅲ中产生的气体为 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是____________ 。
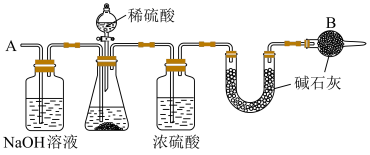
(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为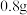 。
。____________ 。
②固体充分高温灼烧后,需要放在______ (填仪器名称)中冷却后才能称量。称量时______ (选填“是”“不是”)采用托盘天平称量。
(5)依据以上分析,实验Ⅲ中发生反应的方程式为____________ 。通过以上实验得出结论: 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
编号 | 操作 | 现象 |
Ⅰ | 将镁条放入 | 迅速放出大量气体,试管壁发热 |
Ⅱ | 将镁条放入pH为 | 无明显现象 |
Ⅲ | 将镁条放入pH为 | 放出气体,溶液中有白色沉淀生成 |
(1)实验前除去镁表面氧化物的方法是
(2)实验Ⅰ的离子方程式为
(3)经实验分析,实验Ⅲ中产生的气体为
 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体
 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为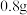 。
。
②固体充分高温灼烧后,需要放在
(5)依据以上分析,实验Ⅲ中发生反应的方程式为
 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
您最近一年使用:0次
名校
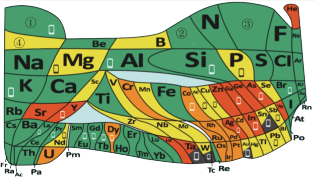
5 . 化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成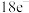 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与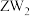 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
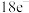 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 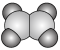 b.
b.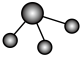 c.
c. 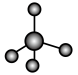 d.
d.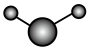
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
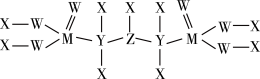
 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与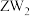 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
名校
6 . 钛被称为“二十一世纪的金属”,绿矾是重要的化工原料,用钛铁矿[主要成分是钛酸亚铁( ),含少量
),含少量 、MgO、
、MgO、 等杂质]作原料生产金属钛和绿矾(
等杂质]作原料生产金属钛和绿矾( )等产品的一种工艺流程如下:
)等产品的一种工艺流程如下:___________ 。
(2)矿渣的主要成分是___________ ;试剂A为___________ (填化学式)。
(3)“操作Ⅱ”为___________ 、___________ 、过滤、洗涤、干燥。
(4)对所得到的绿矾晶体常用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为___________ 。
(5)沸腾氯化中,氯气与矿料逆流而行,目的是___________ ,充分反应后,混合气体中CO与 的分压之比为1∶2,该温度下,
的分压之比为1∶2,该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为___________ 。
(6)俄罗斯科学家于20世纪60年代提出了用金属氢化物还原法生产钛粉这一技术构想,并进行了试验研究。俄罗斯图拉化工冶金厂以 为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式___________ 。
 ),含少量
),含少量 、MgO、
、MgO、 等杂质]作原料生产金属钛和绿矾(
等杂质]作原料生产金属钛和绿矾( )等产品的一种工艺流程如下:
)等产品的一种工艺流程如下: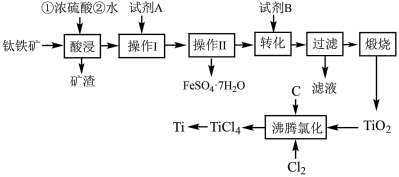
(2)矿渣的主要成分是
(3)“操作Ⅱ”为
(4)对所得到的绿矾晶体常用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为
(5)沸腾氯化中,氯气与矿料逆流而行,目的是
 的分压之比为1∶2,该温度下,
的分压之比为1∶2,该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为(6)俄罗斯科学家于20世纪60年代提出了用金属氢化物还原法生产钛粉这一技术构想,并进行了试验研究。俄罗斯图拉化工冶金厂以
 为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
您最近一年使用:0次
名校
7 . 我国航天事业高速发展,火箭推进剂的研究一直是航天工业的热点课题。火箭推进剂燃料有肼( )、液氢等,常见氧化剂有
)、液氢等,常见氧化剂有 、液氧等。回答下列问题:
、液氧等。回答下列问题:
(1)已知下列反应的热化学方程式如下:
ⅰ.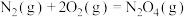
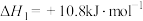
ⅱ.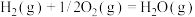
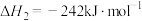
ⅲ.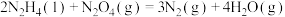
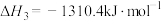
①则

__________  。
。
②反应ⅲ可自发进行的原因是__________ 。
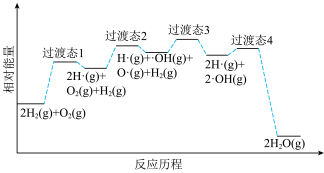
③火箭推进器内氢氧燃烧的简化反应历程如图所示:__________ 。
(2)利用甲烷和水蒸气催化制氢主要存在如下两个反应:
a:
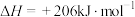
b:
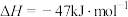
恒定压强为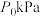 时,将物质的量之比为
时,将物质的量之比为 的
的 与
与 混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
①下列操作中,能提高 平衡转化率的是
平衡转化率的是__________ (填字母)。
A.提高 与
与 的投料比 B.移除CO
的投料比 B.移除CO
C.选择合适的催化剂 D.恒温恒压下通入Ar气
②已知 为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
__________  (列出计算式)。
(列出计算式)。
③平衡体系中 的物质的量分数随温度
的物质的量分数随温度 的变化如图,解释原因
的变化如图,解释原因__________ 。
 )、液氢等,常见氧化剂有
)、液氢等,常见氧化剂有 、液氧等。回答下列问题:
、液氧等。回答下列问题:(1)已知下列反应的热化学方程式如下:
ⅰ.
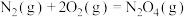
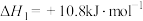
ⅱ.
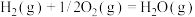
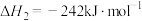
ⅲ.
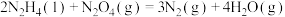
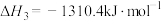
①则


 。
。②反应ⅲ可自发进行的原因是
③火箭推进器内氢氧燃烧的简化反应历程如图所示:
(2)利用甲烷和水蒸气催化制氢主要存在如下两个反应:
a:

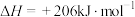
b:

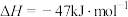
恒定压强为
 时,将物质的量之比为
时,将物质的量之比为 的
的 与
与 混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:物质 |
|
|
|
|
物质的量分数 | 0.04 | 0.32 | 0.50 | 0.08 |
 平衡转化率的是
平衡转化率的是A.提高
 与
与 的投料比 B.移除CO
的投料比 B.移除COC.选择合适的催化剂 D.恒温恒压下通入Ar气
②已知
 为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
 (列出计算式)。
(列出计算式)。③平衡体系中
 的物质的量分数随温度
的物质的量分数随温度 的变化如图,解释原因
的变化如图,解释原因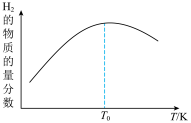
您最近一年使用:0次
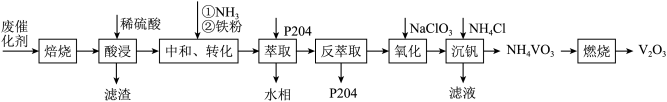
8 . 某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,
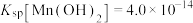


回答下列问题:
(1)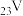 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中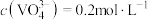 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,

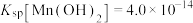


回答下列问题:
(1)
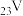 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是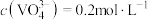 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。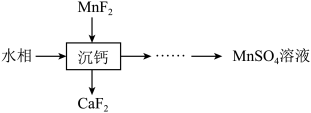
您最近一年使用:0次
名校
9 . 铋酸钠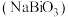 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,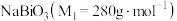 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;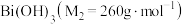 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题:_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
(3)装置B的作用为_______ 。
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是_______ 、过滤、洗涤、干燥。
(5) 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为_______ 。
(6)取上述 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的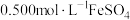 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为_______ ,假设终点时消耗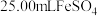 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为_______ %(结果保留小数点后一位)。
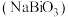 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,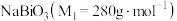 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;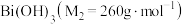 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题: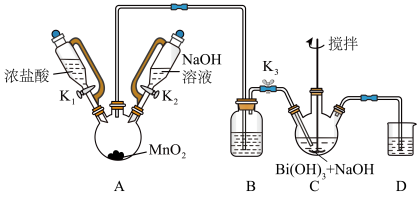
(2)装置C中发生反应的离子方程式为
(3)装置B的作用为
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是
(5)
 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为(6)取上述
 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的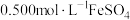 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为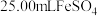 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为
您最近一年使用:0次
名校
解题方法
10 . A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是___________ ;A和C形成供氧剂的电子式___________ 。
(2) A、C、D、E离子半径由小到大的顺序为___________ 。(用离子符号表示)
(3)F的某种氯化物的饱和溶液滴加到沸水中可以形成胶体,写出此反应的化学反应方程式:___________ 。
(4)A和C形成的供氧剂与C的氢化物反应的化学方程式是:___________ 。
(5)E的单质与A的最高价氧化物的水化物反应的离子方程式为___________ 。
(6)红热的B单质与D的最高价氧化物对应水化物的浓溶液反应的化学方程式:___________ 。
| 元素 | 原子结构或性质 |
| A | 原子的最外层电子数是电子层数的 ,其含氧化合物可作为供氧剂 ,其含氧化合物可作为供氧剂 |
| B | 其形成的一种同位素原子在考古中可推测化石的年代 |
| C | 地壳中含量最多的元素 |
| D | 其单质位于火山口附近 |
| E | 与D同周期,且最外层电子数等于电子层数 |
| F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
(1)B在元素周期表中的位置是
(2) A、C、D、E离子半径由小到大的顺序为
(3)F的某种氯化物的饱和溶液滴加到沸水中可以形成胶体,写出此反应的化学反应方程式:
(4)A和C形成的供氧剂与C的氢化物反应的化学方程式是:
(5)E的单质与A的最高价氧化物的水化物反应的离子方程式为
(6)红热的B单质与D的最高价氧化物对应水化物的浓溶液反应的化学方程式:
您最近一年使用:0次


 )
)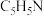 )
)
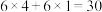


 (
(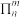 ,其中
,其中 为形成大
为形成大 稀硫酸中
稀硫酸中 的
的 溶液中
溶液中