名校
解题方法
1 . 晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1) 可写成
可写成 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为_______ , 中配位原子是
中配位原子是______ ,基态 的价电子轨道表示式为
的价电子轨道表示式为______ 。______ ,Mo原子周围与之等距离的Mo原子个数为______ 。
(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为 ,则原子2的原子分数坐标为
,则原子2的原子分数坐标为______ 。 ,
, 代表阿伏加德罗常数的值,则ZnS的晶胞中
代表阿伏加德罗常数的值,则ZnS的晶胞中 的配位数为
的配位数为_______ ; 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为____ nm(用代数式表示)。
(1)
 可写成
可写成 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为 中配位原子是
中配位原子是 的价电子轨道表示式为
的价电子轨道表示式为

(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
 ,则原子2的原子分数坐标为
,则原子2的原子分数坐标为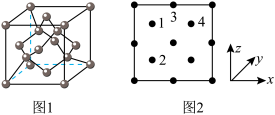

 ,
, 代表阿伏加德罗常数的值,则ZnS的晶胞中
代表阿伏加德罗常数的值,则ZnS的晶胞中 的配位数为
的配位数为 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.酒精检测仪是用来检测人体是否摄入酒精及摄入酒精多少程度的仪器。它可以作为交通警察执法时检测司机饮酒多少的工具,其反应原理为: 。
。
回答下列问题:
(1)Cr位于元素周期表中的_____ 区,其基态原子的核外简化电子排布式为_____ 。
(2) 分子中碳原子的杂化方式有
分子中碳原子的杂化方式有_____ 。_______ ,丙烯→A过程产生的同分异构体为_______ (写结构简式)。
(4)C中所含官能团的名称是________ ,C→D的反应类型是______ 。
(5)有机物F的结构简式为________ 。
(6)①B→C的化学方程式为________ 。
② 的化学方程式为
的化学方程式为______ 。
 。
。回答下列问题:
(1)Cr位于元素周期表中的
(2)
 分子中碳原子的杂化方式有
分子中碳原子的杂化方式有Ⅱ.丙酸苯甲酯(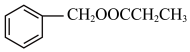 )是一种重要的化妆香精,工业上以丙烯为原料合成丙酸苯甲酯的路线:
)是一种重要的化妆香精,工业上以丙烯为原料合成丙酸苯甲酯的路线:

(4)C中所含官能团的名称是
(5)有机物F的结构简式为
(6)①B→C的化学方程式为
②
 的化学方程式为
的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 四钼酸铵[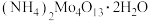 ]常用于生产加氢、脱硫等石油精炼催化剂,微溶于水,能溶于碱和氨水。工业中用钼精矿(主要含
]常用于生产加氢、脱硫等石油精炼催化剂,微溶于水,能溶于碱和氨水。工业中用钼精矿(主要含 ,还有Cu、Fe的化合物及
,还有Cu、Fe的化合物及 等)为原料制备四钼酸铵的工艺流程如图所示。
等)为原料制备四钼酸铵的工艺流程如图所示。
(1)[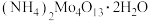 ]中Mo的化合价为
]中Mo的化合价为______ ;“焙烧”产生的气体是______ 。
(2)辉钼( )在纳米电子设备制造领域比硅或富勒烯(如
)在纳米电子设备制造领域比硅或富勒烯(如 )更有优势,可用
)更有优势,可用 硫化
硫化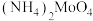 溶液生产辉钼。
溶液生产辉钼。 分子的VSEPR模型为
分子的VSEPR模型为_______ ,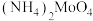 中所有元素的第一电离能由大到小的顺序为
中所有元素的第一电离能由大到小的顺序为______ 。
(3)“浸出”时,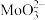 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有_______ (任写两种)。
(4)“净化”后溶液中若有低价钼(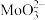 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(5)“净化”时,加入适量 的目的是
的目的是_______ 。为了使浸出液中残留的 、
、 离子浓度小于
离子浓度小于 ,应控制溶液的
,应控制溶液的 小于
小于______ 。(已知: ,
, ;CuS和FeS的
;CuS和FeS的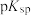 分别为35.2和17.2)。
分别为35.2和17.2)。
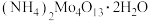 ]常用于生产加氢、脱硫等石油精炼催化剂,微溶于水,能溶于碱和氨水。工业中用钼精矿(主要含
]常用于生产加氢、脱硫等石油精炼催化剂,微溶于水,能溶于碱和氨水。工业中用钼精矿(主要含 ,还有Cu、Fe的化合物及
,还有Cu、Fe的化合物及 等)为原料制备四钼酸铵的工艺流程如图所示。
等)为原料制备四钼酸铵的工艺流程如图所示。
(1)[
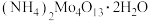 ]中Mo的化合价为
]中Mo的化合价为(2)辉钼(
 )在纳米电子设备制造领域比硅或富勒烯(如
)在纳米电子设备制造领域比硅或富勒烯(如 )更有优势,可用
)更有优势,可用 硫化
硫化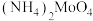 溶液生产辉钼。
溶液生产辉钼。 分子的VSEPR模型为
分子的VSEPR模型为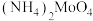 中所有元素的第一电离能由大到小的顺序为
中所有元素的第一电离能由大到小的顺序为(3)“浸出”时,
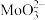 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有(4)“净化”后溶液中若有低价钼(
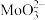 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)“净化”时,加入适量
 的目的是
的目的是 、
、 离子浓度小于
离子浓度小于 ,应控制溶液的
,应控制溶液的 小于
小于 ,
, ;CuS和FeS的
;CuS和FeS的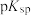 分别为35.2和17.2)。
分别为35.2和17.2)。
您最近一年使用:0次
名校
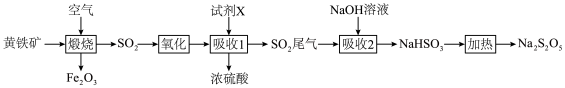
4 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,并把尾气进行资源化综合利用,生产常用作食品漂白剂的焦亚硫酸钠(Na2S2O5),流程如下图所示。
(1)Na2S2O5中S的化合价为___________ 。
(2)煅烧前,黄铁矿需要研磨,目的是___________ 。
(3)煅烧黄铁矿的化学方程式是___________ 。
(4)试剂X是___________ 。
(5)Na2S2O5易被氧化生成Na2SO4而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
限选试剂:稀盐酸、稀 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
(6) 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 。滴定反应的离子方程式为
。滴定反应的离子方程式为 ,该样品中
,该样品中 的残留量为
的残留量为___________ 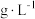 。(
。( 的相对分子质量为190)
的相对分子质量为190)
(1)Na2S2O5中S的化合价为
(2)煅烧前,黄铁矿需要研磨,目的是
(3)煅烧黄铁矿的化学方程式是
(4)试剂X是
(5)Na2S2O5易被氧化生成Na2SO4而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
限选试剂:稀盐酸、稀
 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验步骤 | 现象 | 结论 | |
 | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | |
 | 取实验 的溶液,① 的溶液,① | 最终有白色沉淀生成 | 样品已被氧化 |
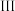 | 另取实验 的溶液,② 的溶液,② | ③ | 样品未完全变质 |
(6)
 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 。滴定反应的离子方程式为
。滴定反应的离子方程式为 ,该样品中
,该样品中 的残留量为
的残留量为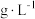 。(
。( 的相对分子质量为190)
的相对分子质量为190)
您最近一年使用:0次
名校
5 . 工业上用异丙苯氧化法合成苯酚,其生产流程如图。
(1)检验有机相中是否含有水所用的无机化学试剂是___________ 。
(2)“操作2”的名称是___________ 。
(3)①丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。检验丙酮中一定存在有机杂质的方法是________________ 。
A.酸性 溶液,加热 B.乙醇,溶解
溶液,加热 B.乙醇,溶解
C.NaOH溶液(酚酞),加热
②有机物A是丙酮的一种同分异构体,A与银氨溶液反应生成银镜,写出A与苯酚反应生成线型酚醛树酯的化学方程式:_______________ 。
(4)检验丙酮中是否存在有机杂质的方法还可以用仪器分析法。可选用的仪器是_______ 。(填选项字母
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪

物质 | 沸点 | 溶解性 | 主要化学性质 |
异丙苯 | 152.4℃ | 不溶于水,易溶于酒精 | 可被强氧化剂氧化 |
苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂 | 易被氧化 |
丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
(1)检验有机相中是否含有水所用的无机化学试剂是
(2)“操作2”的名称是
(3)①丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。检验丙酮中一定存在有机杂质的方法是
A.酸性
 溶液,加热 B.乙醇,溶解
溶液,加热 B.乙醇,溶解C.NaOH溶液(酚酞),加热
②有机物A是丙酮的一种同分异构体,A与银氨溶液反应生成银镜,写出A与苯酚反应生成线型酚醛树酯的化学方程式:
(4)检验丙酮中是否存在有机杂质的方法还可以用仪器分析法。可选用的仪器是
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
您最近一年使用:0次
名校
解题方法
6 . 赤泥是氧化铝生产排放的固体废弃物。由赤泥(主要成分为 、
、 、
、 、
、 、
、 、
、 等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下:
等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下:
(1)基态铝原子的核外电子排布式为_______ , 的空间构型是
的空间构型是_______ 。
(2)“焙烧”时,需将赤泥粉碎的目的是_______ 。
(3)“氧化”时发生反应的离子方程式为_______ ,向“氧化”后的溶液中滴加 溶液至
溶液至 ,生成沉淀。
,生成沉淀。
(4)为了测试所制得的聚合硫酸铝铁的性能,取某水样在不同 条件下加入PAFS
条件下加入PAFS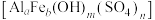 并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在偏酸性和偏碱性的
并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在偏酸性和偏碱性的 条件下,水样的去浊率均不高。试分析
条件下,水样的去浊率均不高。试分析 时,去浊率较低的可能原因为
时,去浊率较低的可能原因为_______ 。
 、
、 、
、 、
、 、
、 、
、 等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下:
等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下:
(1)基态铝原子的核外电子排布式为
 的空间构型是
的空间构型是(2)“焙烧”时,需将赤泥粉碎的目的是
(3)“氧化”时发生反应的离子方程式为
 溶液至
溶液至 ,生成沉淀。
,生成沉淀。(4)为了测试所制得的聚合硫酸铝铁的性能,取某水样在不同
 条件下加入PAFS
条件下加入PAFS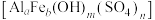 并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在偏酸性和偏碱性的
并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在偏酸性和偏碱性的 条件下,水样的去浊率均不高。试分析
条件下,水样的去浊率均不高。试分析 时,去浊率较低的可能原因为
时,去浊率较低的可能原因为
您最近一年使用:0次
7 . 近年我国大力加强温室气体 催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:①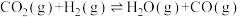
 。
。
②
 。
。
写出 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:_______ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是_______ (填选项字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由 (g)催化氢化合成
(g)催化氢化合成 (g),如图所示为不同投料比[
(g),如图所示为不同投料比[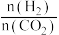 ]时某反应物X平衡转化率变化曲线:反应物X是
]时某反应物X平衡转化率变化曲线:反应物X是_______ (填“ ”或“
”或“ ”)。
”)。 、2mol
、2mol  和催化剂发生合成
和催化剂发生合成 的反应(以总反应方程式计算),10min时反应达到平衡状态,测得
的反应(以总反应方程式计算),10min时反应达到平衡状态,测得 。
。
①0~10min内,用氢气表示的化学反应速率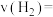
_______  ,化学平衡常数K=
,化学平衡常数K=_______ ;若起始压强为 ,则平衡常数
,则平衡常数
_______ (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②下列条件能说明该反应达到平衡状态的是_______ (填选项字母)。
A.
B.容器内混合气体的总压强不再变化
C.容器内混合气体的密度保持不变
D.容器内各物质的浓度满足
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如表所示:
根据表中所给数据,用 生产甲醇的最优实验为
生产甲醇的最优实验为_______ (填实验编号)。
 催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:①
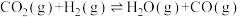
 。
。②

 。
。写出
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 (g)催化氢化合成
(g)催化氢化合成 (g),如图所示为不同投料比[
(g),如图所示为不同投料比[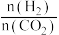 ]时某反应物X平衡转化率变化曲线:反应物X是
]时某反应物X平衡转化率变化曲线:反应物X是 ”或“
”或“ ”)。
”)。
 、2mol
、2mol  和催化剂发生合成
和催化剂发生合成 的反应(以总反应方程式计算),10min时反应达到平衡状态,测得
的反应(以总反应方程式计算),10min时反应达到平衡状态,测得 。
。①0~10min内,用氢气表示的化学反应速率
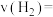
 ,化学平衡常数K=
,化学平衡常数K= ,则平衡常数
,则平衡常数
②下列条件能说明该反应达到平衡状态的是
A.

B.容器内混合气体的总压强不再变化
C.容器内混合气体的密度保持不变
D.容器内各物质的浓度满足

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如表所示:
| 实验编号 | 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
 生产甲醇的最优实验为
生产甲醇的最优实验为
您最近一年使用:0次
名校
解题方法
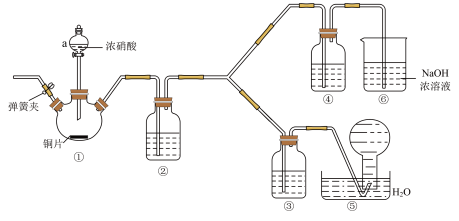
8 . 某化学学习小组探究浓度对硝酸氧化能力的影响。
Ⅰ.资料显示:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO;氢氧化钠能吸收NO2,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
(1)装置a的名称_______ 。
(2)写出装置①中反应的离子反应方程式_______ 。
(3)①~⑥装置中,没有发生氧化还原反应的是_______ 。(填装置序号)
(4)下列说法正确的是_______。
Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:
(5)下列说法正确的是_______ 。
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于12.2mol/LHNO3溶液反应说明不存在“钝化”现象。
(6)已知:在上述反应条件下,反应后铁以Fe3+形式存在于溶液中。当硝酸浓度为9.75mol·L-1时,计算氧化剂与还原剂的物质的量之比为:_______ 。
Ⅰ.资料显示:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO;氢氧化钠能吸收NO2,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
(1)装置a的名称
(2)写出装置①中反应的离子反应方程式
(3)①~⑥装置中,没有发生氧化还原反应的是
(4)下列说法正确的是_______。
| A.能证明氧化性的相对强弱的实验现象为③中溶液上方出现红棕色气体 |
| B.②中的试剂为水 |
| C.滴加浓硝酸前要先打开弹簧夹通一段时间氮气 |
| D.⑥的作用是吸收尾气NO |
Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:
(5)下列说法正确的是
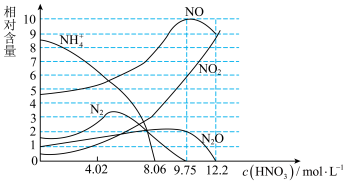
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于12.2mol/LHNO3溶液反应说明不存在“钝化”现象。
(6)已知:在上述反应条件下,反应后铁以Fe3+形式存在于溶液中。当硝酸浓度为9.75mol·L-1时,计算氧化剂与还原剂的物质的量之比为:
您最近一年使用:0次
9 . 高分子化合物H是一种重要工业原料,其单体A不易溶于水,可以发生如图变化。请回答下列问题:_______ 。
(2)有机物A中官能团的名称为_______ 、_______ 。
(3)反应①的反应类型为_______ ;反应⑤的反应类型为_______ 。
(4)反应②的化学方程式是_______ 。
(5)写出高分子化合物H的结构简式:_______ 。
(6)产物的探究:④反应在如图中发生,取下试管乙振荡,红色褪去。为了探究褪色原因,进行如下实验。
①用化学方程式解释实验Ⅰ中产生气泡的原因是_______ 。
②测得实验Ⅰ褪色后的下层溶液呈碱性,对比实验Ⅰ和实验Ⅱ,
小组得出该实验中乙酸与碳酸钠反应_______ (填“是”或“不是”)溶液褪色的主要原因。
③针对实验Ⅱ中现象,小组同学提出猜想:酚酞更易溶于乙酸乙酯。
实验Ⅲ中观察到_______ ,证实该猜想正确。

(2)有机物A中官能团的名称为
(3)反应①的反应类型为
(4)反应②的化学方程式是
(5)写出高分子化合物H的结构简式:
(6)产物的探究:④反应在如图中发生,取下试管乙振荡,红色褪去。为了探究褪色原因,进行如下实验。

编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 | —— |
②测得实验Ⅰ褪色后的下层溶液呈碱性,对比实验Ⅰ和实验Ⅱ,
小组得出该实验中乙酸与碳酸钠反应
③针对实验Ⅱ中现象,小组同学提出猜想:酚酞更易溶于乙酸乙酯。
实验Ⅲ中观察到
您最近一年使用:0次
10 . 回答下列问题:
(1)根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中_______ (填“吸收”或“放出”)的能量为_______ kJ。 ,n(NO)随时间变化如下表:
,n(NO)随时间变化如下表:
①0~2s内,用O2表示该反应的反应速率为_______ mol·L-1·s-1。
②下列措施能够使该反应的反应速率加快的是_______ (填字母)。
a.降低温度 b.使用合适的催化剂 c.减小容器容积
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的N2O5。_______ (填“石墨Ⅰ”或“石墨Ⅱ”)。
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2为_______ L。
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图甲所示),该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示,请分析并回答如下问题:_______ (填化学式)。
(5)0~t1时间段的温度为_______ 。
(1)根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中

 ,n(NO)随时间变化如下表:
,n(NO)随时间变化如下表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
②下列措施能够使该反应的反应速率加快的是
a.降低温度 b.使用合适的催化剂 c.减小容器容积
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的N2O5。

②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2为
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图甲所示),该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示,请分析并回答如下问题:
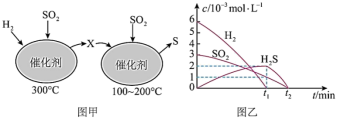
(5)0~t1时间段的温度为
您最近一年使用:0次