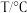名校
解题方法
1 . 实验室制备溴苯可用如图所示装置。_____ 。
(2)E试管内出现的现象为_____ 。
(3)F装置的作用是_____ 。
(4)待三颈烧瓶中的反应进行到仍有气泡冒出时松开G夹,关闭C夹,可以看到的现象是_____ 。
(5)反应结束后、拆开装置,从A口加入适量的 溶液,然后将液体倒入
溶液,然后将液体倒入_____ 中(填仪器名称)。
(2)E试管内出现的现象为
(3)F装置的作用是
(4)待三颈烧瓶中的反应进行到仍有气泡冒出时松开G夹,关闭C夹,可以看到的现象是
(5)反应结束后、拆开装置,从A口加入适量的
 溶液,然后将液体倒入
溶液,然后将液体倒入
您最近一年使用:0次
名校
解题方法
2 . I.磷是构成生命的基本元素之一。
(1)由磷原子形成的三种微粒:a.[Ne]3s23p3、b.[Ne]3s23p2、c.[Ne]3s23p24s1,半径最小的是___________ (填小写字母,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)PCl5可发生自耦电离产生一种四面体结构的离子和一种正八面体结构的离子,这两种离子的化学式分别为___________ 。
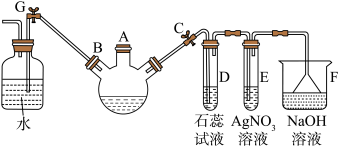
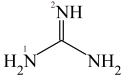
Ⅱ.胍是一类有机物,最简单胍类物质的结构简式如图所示:___________ ,分子中所有原子共平面,胍中N原子杂化方式为___________ 。
(4)胍分子在水中的溶解度___________ (填“大于”、“小于”或“等于”)在苯中的溶解度,原因是___________ 。
(5)2号N原子的孤电子对位于___________ (填选项序号)。
a.sp杂化轨道 b.sp2杂化轨道 c.sp3杂化轨道 d.2p轨道
(1)由磷原子形成的三种微粒:a.[Ne]3s23p3、b.[Ne]3s23p2、c.[Ne]3s23p24s1,半径最小的是
(2)PCl5可发生自耦电离产生一种四面体结构的离子和一种正八面体结构的离子,这两种离子的化学式分别为
Ⅱ.胍是一类有机物,最简单胍类物质的结构简式如图所示:
(4)胍分子在水中的溶解度
(5)2号N原子的孤电子对位于
a.sp杂化轨道 b.sp2杂化轨道 c.sp3杂化轨道 d.2p轨道
您最近一年使用:0次
名校
解题方法
3 . 硅元素及其化合物在生产生活中应用广泛。
回答下列问题:
(1)基态硅原子核外电子有___________ 种空间运动状态,价电子的电子排布图为___________ 。
(2)硅与碳同主族,但硅烷(SiH4)稳定性弱于甲烷,其原因是___________ 。
(3)高纯四氯化硅为无色透明液体,四氯化硅的空间构型为___________ ,四氯化硅易溶于苯,其原因是___________ ,四氯化硅熔点远低于氯化镁,其原因是___________ 。
(4)硅酸盐是地壳的主要成分。硅酸盐的最简单阴离子为 ,为硅氧四面体,结构如图1所示:
,为硅氧四面体,结构如图1所示:___________ 。
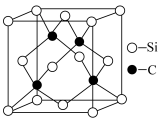
(5)碳化硅俗名金刚砂,其硬度大、熔点高,是良好的耐磨材料,其晶胞结构如图所示。晶体中碳原子位于硅原子组成的___________ (填“正方体”、“正四面体”或“正八面体”)中心;与碳原子距离最近且相等的碳原子有___________ 个,晶胞参数为anm,则碳化硅晶体的密度为___________ 。g·cm-3(列出计算式即可)。
回答下列问题:
(1)基态硅原子核外电子有
(2)硅与碳同主族,但硅烷(SiH4)稳定性弱于甲烷,其原因是
(3)高纯四氯化硅为无色透明液体,四氯化硅的空间构型为
(4)硅酸盐是地壳的主要成分。硅酸盐的最简单阴离子为
 ,为硅氧四面体,结构如图1所示:
,为硅氧四面体,结构如图1所示: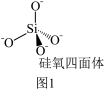

(5)碳化硅俗名金刚砂,其硬度大、熔点高,是良好的耐磨材料,其晶胞结构如图所示。晶体中碳原子位于硅原子组成的
您最近一年使用:0次
4 . NH3一种重要的化工原料,可用于制氮肥、HNO3、铵盐、纯碱等。某实验小组设计了如下实验装置制取NH3,回答下列问题:
(1)NH3的制备___________ 。
②实验室用装置D作为制取氨气的发生装置,该反应的化学方程式为___________ ;若用装置B作为制取氨气的发生装置,分液漏斗中盛装的试剂名称为___________ 。
③欲收集一瓶干燥的氨气,选择上图中的装置。其连接顺序为:发生装置→___________ (按气流方向,用小写字母表示)。
(2)工业上NH3经一系列反应可制取硝酸,某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO3)2,实验装置如图所示:___________ 。
②在①操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子方程式是___________ ;该反应体现了硝酸的___________ 性。
③装置B中用注射器压入空气之后现象是___________ ;反应的化学方程式是___________ 。
④D装置的作用是___________ 。
(1)NH3的制备

②实验室用装置D作为制取氨气的发生装置,该反应的化学方程式为
③欲收集一瓶干燥的氨气,选择上图中的装置。其连接顺序为:发生装置→
(2)工业上NH3经一系列反应可制取硝酸,某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO3)2,实验装置如图所示:

②在①操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子方程式是
③装置B中用注射器压入空气之后现象是
④D装置的作用是
您最近一年使用:0次
5 . 某小组同学利用下图所示装置完成碳与浓硫酸反应的实验,并验证所得全部产物。请完成下列空白。___________ ;
(2)写出浓硫酸和木炭粉发生反应的化学方程式:___________ ,在该反应中,浓H2SO4表现出___________ (填“吸水”、“脱水”或“强氧化”)性;。
(3)如果用图中的装置检验上述反应的全部产物,请回答下列问题:
①A中加入的试剂___________ ,B作用是___________ 。
②C中应观察到的现象是___________ ,体现了SO2的性质是___________ 。
a.漂白性 b.氧化性 c.还原性
(4)浓硫酸具有:a.脱水性;b.酸性;c.强氧化性;d.吸水性;下列各项分别表现浓硫酸的什么性质,请将字母填于空白处:
①盛有浓硫酸的烧杯敞口放置一段时间后,质量增加___________ 。
②浓硫酸与铜共热,浓硫酸表现的性质是___________ 。

(2)写出浓硫酸和木炭粉发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,请回答下列问题:
①A中加入的试剂
②C中应观察到的现象是
a.漂白性 b.氧化性 c.还原性
(4)浓硫酸具有:a.脱水性;b.酸性;c.强氧化性;d.吸水性;下列各项分别表现浓硫酸的什么性质,请将字母填于空白处:
①盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
②浓硫酸与铜共热,浓硫酸表现的性质是
您最近一年使用:0次
名校
6 . 氢技术产业是未来科技发展的重要方向。去年,世界氢能技术大会在广东召开,广东成立了“仙湖氢能实验室”,推动了氢气产业的发展,打造了“中国氢能产业第一区”。回答下列问题:
(1)日前大规模制取氢气的方法之一为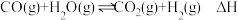 该反应的平衡常数(K)和温度(T)的关系如表所示:
该反应的平衡常数(K)和温度(T)的关系如表所示:
①该反应的正反应为_______ (填“放热”或“吸热”)反应。
② 时,在容积不变的密闭容器中,将
时,在容积不变的密闭容器中,将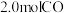 与
与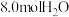 混合,反应达到平衡状态时
混合,反应达到平衡状态时 的转化率是
的转化率是 ,计算
,计算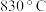 时该反应的平衡常数a:
时该反应的平衡常数a:_______ (写出计算过程);反应达到平衡状态后,继续向该容器中充入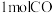 和
和 ,平衡
,平衡_______ (填“正向移动”“逆向移动”或“不移动”),达到新平衡时平衡常数K_______ a(填“>”“<”或“=”)。
③某温度下,向某恒容密闭容器中充入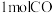 和
和 ,再向该体系中投入适量等量的微米
,再向该体系中投入适量等量的微米 和纳米
和纳米 ,平衡时
,平衡时 的体积分数增大,实验结果的对比如图所示。
的体积分数增大,实验结果的对比如图所示。 ,平衡时
,平衡时 的体积分数增大的原因是
的体积分数增大的原因是_______ ,微米 和纳米
和纳米 对平衡的影响不同,原因是
对平衡的影响不同,原因是_______ 。
(2)除氢能应用外, 还有许多用途,如合成氨反应:
还有许多用途,如合成氨反应: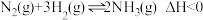 。研究合成氨反应的过程中,分离筛从空气中分离
。研究合成氨反应的过程中,分离筛从空气中分离 时常混有少量
时常混有少量 ,所以超过
,所以超过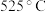 时存在副反应:
时存在副反应: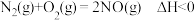 。
。
①合成氨工业中常采用循环操作,主要是为了_______ (填选项字母)。
A.增大化学反应速率 B.降低氨的沸点
C.提高氨气和氢气的利用率 D.提高平衡混合物中氨的含量
②用分离筛分离空气,将得到的 和
和 放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为
放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为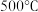 ,为提高
,为提高 的平衡转化率,继续通入过量
的平衡转化率,继续通入过量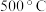 的
的 ,结果
,结果 的平衡转化率不升反降,原因是
的平衡转化率不升反降,原因是_______ (已知:反应过程温度未达到 与
与 反应的着火点)。
反应的着火点)。
(1)日前大规模制取氢气的方法之一为
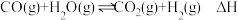 该反应的平衡常数(K)和温度(T)的关系如表所示:
该反应的平衡常数(K)和温度(T)的关系如表所示:
| 700 | 800 | 900 | 1000 | 1200 |
K | 1.67 | 1.11 | a | 0.59 | 0.38 |
②
 时,在容积不变的密闭容器中,将
时,在容积不变的密闭容器中,将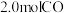 与
与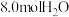 混合,反应达到平衡状态时
混合,反应达到平衡状态时 的转化率是
的转化率是 ,计算
,计算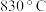 时该反应的平衡常数a:
时该反应的平衡常数a: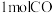 和
和 ,平衡
,平衡③某温度下,向某恒容密闭容器中充入
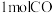 和
和 ,再向该体系中投入适量等量的微米
,再向该体系中投入适量等量的微米 和纳米
和纳米 ,平衡时
,平衡时 的体积分数增大,实验结果的对比如图所示。
的体积分数增大,实验结果的对比如图所示。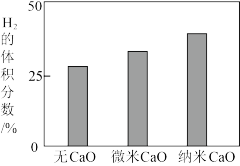
 ,平衡时
,平衡时 的体积分数增大的原因是
的体积分数增大的原因是 和纳米
和纳米 对平衡的影响不同,原因是
对平衡的影响不同,原因是(2)除氢能应用外,
 还有许多用途,如合成氨反应:
还有许多用途,如合成氨反应: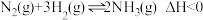 。研究合成氨反应的过程中,分离筛从空气中分离
。研究合成氨反应的过程中,分离筛从空气中分离 时常混有少量
时常混有少量 ,所以超过
,所以超过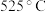 时存在副反应:
时存在副反应: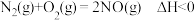 。
。①合成氨工业中常采用循环操作,主要是为了
A.增大化学反应速率 B.降低氨的沸点
C.提高氨气和氢气的利用率 D.提高平衡混合物中氨的含量
②用分离筛分离空气,将得到的
 和
和 放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为
放入绝热恒容密闭容器中进行合成氨反应,该反应达到平衡状态时温度为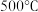 ,为提高
,为提高 的平衡转化率,继续通入过量
的平衡转化率,继续通入过量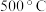 的
的 ,结果
,结果 的平衡转化率不升反降,原因是
的平衡转化率不升反降,原因是 与
与 反应的着火点)。
反应的着火点)。
您最近一年使用:0次
7 . 镍及其化合物用途广泛,可用作催化剂、合金、电器元件等。回答下列问题:
(1)基态Ni原子价电子的轨道表示式为___________ 。
(2)某镍配合物由1个 与2个
与2个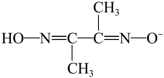 离子组成。
离子组成。
①组成该镍配合物的元素中,第二周期元素的第一电离能由高到低的顺序为___________ (用元素符号表示,下同),配合物中采用 杂化的原子为
杂化的原子为___________ 。
②已知该配合物中只有一种元素的原子与 配位,则与镍配位的原子为
配位,则与镍配位的原子为___________ (填“C”“N”或“O”),原因为___________ 。
(3) 是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于
是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于 、苯等有机溶剂的原因为
、苯等有机溶剂的原因为___________ , 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为___________ 。
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:___________ 。
②若晶胞参数为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为___________  。
。
(1)基态Ni原子价电子的轨道表示式为
(2)某镍配合物由1个
 与2个
与2个 离子组成。
离子组成。①组成该镍配合物的元素中,第二周期元素的第一电离能由高到低的顺序为
 杂化的原子为
杂化的原子为②已知该配合物中只有一种元素的原子与
 配位,则与镍配位的原子为
配位,则与镍配位的原子为(3)
 是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于
是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于 、苯等有机溶剂的原因为
、苯等有机溶剂的原因为 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:
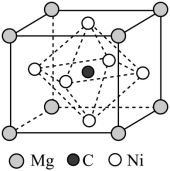
②若晶胞参数为a nm,阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
8 . 某化学实验小组的同学利用铜与浓硫酸反应制取二氧化硫并研究其性质,所用实验装置如图。回答下列问题:________________ 。
(2)装置A中反应的化学方程式是__________________ 。
(3)装置B的现象为__________ ,体现了SO2的__________ 性。
(4)装置C中反应的化学方程式是____________________________ 。
(5)探究SO2与钡盐的反应
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致,打开开关K,通入SO2流速一致。三次实验现象如下表:
三次实验分别得到如下pH-t图:_____________________________ 。
②pH-t图中,曲线a呈缓慢下降趋势,这是因为__________ ;曲线b出现骤降,这是因为SO2与BaCl2溶液中溶解的__________ 发生反应生成了H+。
③写出实验c中反应的离子方程式:_____________________
______Ba2++_______SO2+______ +_____=______BaSO4↓+_______NO+_______。
+_____=______BaSO4↓+_______NO+_______。
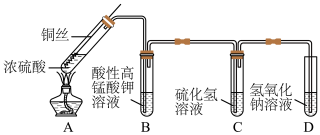
(2)装置A中反应的化学方程式是
(3)装置B的现象为
(4)装置C中反应的化学方程式是
(5)探究SO2与钡盐的反应
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致,打开开关K,通入SO2流速一致。三次实验现象如下表:
实验a | 实验b | 实验c |
|
已煮沸的 BaCl2溶液 | 未煮沸的 BaCl2溶液 | 已煮沸的 Ba(NO3)2溶液 | |
无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |

②pH-t图中,曲线a呈缓慢下降趋势,这是因为
③写出实验c中反应的离子方程式:
______Ba2++_______SO2+______
 +_____=______BaSO4↓+_______NO+_______。
+_____=______BaSO4↓+_______NO+_______。
您最近一年使用:0次
名校
9 . 学习小组在实验室中利用如图所示装置制备 并进行相关性质的探究。回答下列问题:
并进行相关性质的探究。回答下列问题:_______ ,装置c中的现象是_______ ,可证明 具有
具有_______ 性。
(2)装置f的作用是_______ 。
(3)装置a中发生反应的化学方程式为_______ 。
(4)探究 在KI溶液体系中的反应产物。
在KI溶液体系中的反应产物。
实验开始后,发现装置d中的溶液迅速变黄,继续通入 ,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: 。但有同学提出上述可逆反应生成的
。但有同学提出上述可逆反应生成的 可与
可与 发生反应:
发生反应: 。为进一步探究体系中的产物,完成下列实验方案。
。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴_______ 溶液(填试剂名称),振荡,无明显变化,浊液中无I2
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,_______ ,出现白色沉淀,产物溶液中存在 。
。
综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为_______ 。
 并进行相关性质的探究。回答下列问题:
并进行相关性质的探究。回答下列问题:
 具有
具有(2)装置f的作用是
(3)装置a中发生反应的化学方程式为
(4)探究
 在KI溶液体系中的反应产物。
在KI溶液体系中的反应产物。实验开始后,发现装置d中的溶液迅速变黄,继续通入
 ,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: 。但有同学提出上述可逆反应生成的
。但有同学提出上述可逆反应生成的 可与
可与 发生反应:
发生反应: 。为进一步探究体系中的产物,完成下列实验方案。
。为进一步探究体系中的产物,完成下列实验方案。Ⅰ.取适量装置d中浊液,向其中滴加几滴
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,
 。
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 1913年,合成氨问世,氨催化氧化法生产硝酸开始进入工业化阶段,氨及硝酸都是重要的化工原料,回答下列问题:
(1)用 和
和 制备
制备 的化学方程式为
的化学方程式为___________ ,反应发生、气体干燥、气体收集和尾气处理装置依次为___________ (填写字母)。 性质实验。
性质实验。 ,
, 瓶中的现象是
瓶中的现象是___________ ,原因是___________ ,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________ 。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和 、
、 的混合气体,这些混合气体与
的混合气体,这些混合气体与 (标准状况下)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。
(标准状况下)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。
向所得硝酸铜溶液中加入 溶液至
溶液至 恰好完全沉淀,则消耗
恰好完全沉淀,则消耗 溶液的体积是
溶液的体积是___________  。
。
(1)用
 和
和 制备
制备 的化学方程式为
的化学方程式为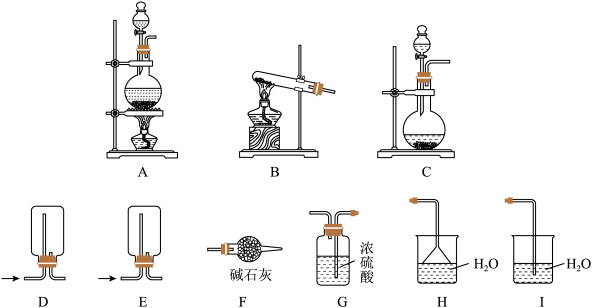
 性质实验。
性质实验。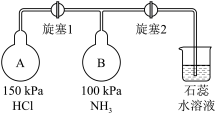
 ,
, 瓶中的现象是
瓶中的现象是②再打开旋塞2,B瓶中的现象是
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和
 、
、 的混合气体,这些混合气体与
的混合气体,这些混合气体与 (标准状况下)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。
(标准状况下)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。向所得硝酸铜溶液中加入
 溶液至
溶液至 恰好完全沉淀,则消耗
恰好完全沉淀,则消耗 溶液的体积是
溶液的体积是 。
。
您最近一年使用:0次