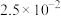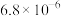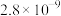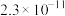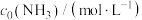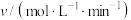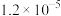名校
解题方法
1 . A是一种重要的有机化工原料,其产量通常用来衡量一个国家石油化学工业的发展水平。结合下图物质间转化关系回答下列问题:___________ ,G中含氧官能团的名称为___________ 。
(2)高分子化合物H是一种常见的合成纤维—丙纶,其结构简式为___________ 。
(3)反应③的化学方程式为___________ ,反应类型为___________ 。
(4)反应⑤的化学方程式为___________ 。
(5)F与氢气发生加成反应的产物为K,写出K的同分异构体中属于酯的一种物质的结构简式:___________ 。
(6)15.2 g J与足量的金属Na完全反应,生成标准状况下氢气的体积为___________ L。
已知:CH2=CH2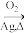
 ,
, +H2O
+H2O CH2OHCH2OH。
CH2OHCH2OH。
(2)高分子化合物H是一种常见的合成纤维—丙纶,其结构简式为
(3)反应③的化学方程式为
(4)反应⑤的化学方程式为
(5)F与氢气发生加成反应的产物为K,写出K的同分异构体中属于酯的一种物质的结构简式:
(6)15.2 g J与足量的金属Na完全反应,生成标准状况下氢气的体积为
您最近一年使用:0次
7日内更新
|
152次组卷
|
3卷引用:山西省名校联考2023-2024学年高一下学期5月月考化学试题
名校
解题方法
2 . 甲醇是重要的化工原料,利用合成气(CO、 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题:___________ mol⋅L ⋅min
⋅min ,此时v(正)
,此时v(正)___________ v(逆)(填“>”“<”或“=”)。
②下列措施能增大反应速率的是___________ (填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡时, 的转化率为
的转化率为___________ , 的体积分数为
的体积分数为___________ 。
(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
(4)化石燃料燃烧产生的 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):___________ (填“正”或“负”)极,正极电极反应式为___________ 。
②该电池中每转移2 mol电子,能够吸收___________ mol  。
。
 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题: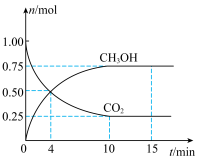
 ⋅min
⋅min ,此时v(正)
,此时v(正)②下列措施能增大反应速率的是
A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)反应达到平衡时,
 的转化率为
的转化率为 的体积分数为
的体积分数为(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
A. 、 、 、 、 、 、 四种物质的浓度相等 四种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总压强不随时间的变化而变化 |
D.单位时间内消耗3 mol  的同时生成1 mol 的同时生成1 mol  |
(4)化石燃料燃烧产生的
 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):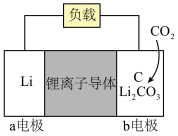
②该电池中每转移2 mol电子,能够吸收
 。
。
您最近一年使用:0次
7日内更新
|
76次组卷
|
3卷引用:山西省名校联考2023-2024学年高一下学期5月月考化学试题
解题方法
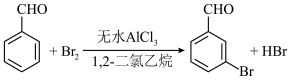
3 . 实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
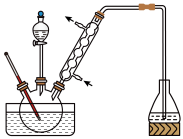
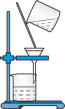
步骤1:将一定配比的无水A1Cl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后装入三颈烧瓶(如图所示),缓慢滴加足量经浓硫酸干燥过的液溴,控温反应一段时间,冷却。
步骤3:向经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体。
步骤4:分离有机层,减压蒸馏有机相,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是___________ ,锥形瓶中的试剂为___________ (填化学式)溶液,其作用为___________ 。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为___________ (填字母)。步骤1所加物质中,AlCl3是催化剂,请推测1,2-二氯乙烷的作用:___________ 。
A.>229℃ B.58.8~179℃ C.<58.8℃
(3)有同学建议将装置中温度计换成搅拌器,那么温度计应移到___________ (填位置)。
(4)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的___________ (填化学式)。
(5)步骤4中采用减压蒸馏技术,其目的是___________ 。
(6)若实验结束后得到3.7g间溴苯甲醛。则本实验中间溴苯甲醛产率为___________ 。
②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
| 物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
| 沸点/℃ | 58.8 | 179 | 83.5 | 229 |
| 相对分子质量 | 160 | 106 | 99 | 185 |
步骤3:向经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体。
步骤4:分离有机层,减压蒸馏有机相,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为
A.>229℃ B.58.8~179℃ C.<58.8℃
(3)有同学建议将装置中温度计换成搅拌器,那么温度计应移到
(4)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的
(5)步骤4中采用减压蒸馏技术,其目的是
(6)若实验结束后得到3.7g间溴苯甲醛。则本实验中间溴苯甲醛产率为
您最近一年使用:0次
7日内更新
|
46次组卷
|
2卷引用:山西省部分学校2023-2024学年高二下学期5月质量检测化学试题
解题方法
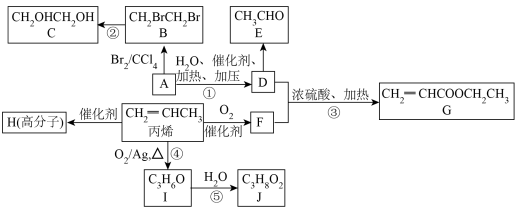
4 . 正丁酸乙酯(G)是我国规定允许使用的食用香料,常用于调制苹果、香蕉、菠萝等果香型食用香精和威士忌酒香精,以有机物A为原料制备正丁酸乙酯(G)的一种合成路线如图所示,有机物A的产量可以用来衡量一个国家石油化学工业的发展水平。回答下列问题:_____ ,E中官能团的名称为_____ 。
(2)A→B反应的化学方程式为_____ ,反应类型为_____ ;F→G反应的反应类型为_____ 。
(3)E可以发生加聚反应生成高分子化合物H,H的结构简式为_____ 。
(4)G的同分异构体有多种,其中能与饱和 溶液反应产生
溶液反应产生 的有
的有_____ 种,其中分子中含有3个甲基的结构简式为_____ (任写一种)。
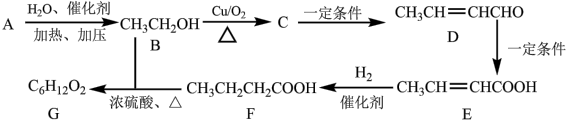
(2)A→B反应的化学方程式为
(3)E可以发生加聚反应生成高分子化合物H,H的结构简式为
(4)G的同分异构体有多种,其中能与饱和
 溶液反应产生
溶液反应产生 的有
的有
您最近一年使用:0次
名校
解题方法
5 . 我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,青蒿素是从青蒿中提取的能有效治疗疟疾的有机化合物。已知青蒿素为无色针状晶体,熔点为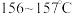 ,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:
,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:
I.该兴趣小组的实验流程如图所示: 前要对青蒿干进行粉碎,其目的是
前要对青蒿干进行粉碎,其目的是_____________________ ,操作b的名称是______________ 。
(2)重结晶的操作步骤:加入 的乙醇溶液溶解
的乙醇溶液溶解
_______ 
_______  过滤、洗涤、干燥。
过滤、洗涤、干燥。
II.已知青蒿素是一种仅含有C、H、O三种元素的化合物,其相对分子质量为282。为确定其分子式,进行了如图实验:
①连接装置,检查装置气密性;
②称量装置丙、丁中仪器及药品的质量;
③取 青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;
青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后装置丙、丁中仪器及药品的质量。
(3)装置乙的作用是________________________________ ;装置丙、丁中吸收的生成物依次为________________ 、_________________ (填化学式)。
(4)实验测得有关数据如表所示:
则通过上述数据,可得出青蒿素的分子式为________________ 。
(5)装置戊的作用是________________ 。
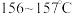 ,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:
,易溶于丙酮、乙醇和乙醚等有机溶剂,难溶于水。某校兴趣小组利用下列实验流程和实验装置提取青蒿素并确定其分子式。回答下列问题:I.该兴趣小组的实验流程如图所示:
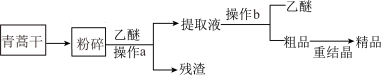
 前要对青蒿干进行粉碎,其目的是
前要对青蒿干进行粉碎,其目的是(2)重结晶的操作步骤:加入
 的乙醇溶液溶解
的乙醇溶液溶解

 过滤、洗涤、干燥。
过滤、洗涤、干燥。II.已知青蒿素是一种仅含有C、H、O三种元素的化合物,其相对分子质量为282。为确定其分子式,进行了如图实验:
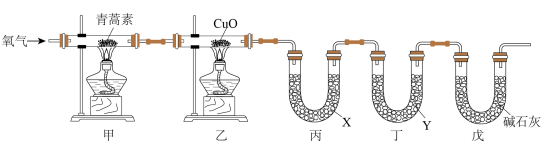
①连接装置,检查装置气密性;
②称量装置丙、丁中仪器及药品的质量;
③取
 青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;
青蒿素放入装置甲的硬质玻璃管中,点燃装置甲、乙中的酒精灯加热,充分反应;④实验结束后冷却至室温,称量反应后装置丙、丁中仪器及药品的质量。
(3)装置乙的作用是
(4)实验测得有关数据如表所示:
装置 | 实验前(仪器+药品) | 实验后(仪器+药品) |
丙 | 54.0g | 73.8g |
丁 | 80.0g | 146.0g |
(5)装置戊的作用是
您最近一年使用:0次
解题方法
6 . 工业上常用浓氨水检验运输氯气的管道是否泄漏。某同学为验证干燥、纯净的氨气与氯气的反应,设计装置如图所示,C装置为氯气与氨气反应的装置。
(1)装置A中发生的化学反应方程式是___________ 。
(2)仪器a的名称为___________ ,装置B的作用是 ___________ 。
(3)装置F中浓盐酸发生反应时体现的性质是___________ 。若要得到标准状况下112mLCl2,需MnO2的质量为 ___________ 。
(4)为得到干燥、纯净的氯气,D、E分别应盛放的试剂是___________ 、___________ (填序号)。
①饱和NaCl溶液 ②浓NaOH溶液 ③浓硫酸 ④饱和NaHCO3溶液
(5)通入C装置的两根导管左边较长、右边较短,目的是___________ 。实验过程中观察到装置C内出现浓厚的白烟并在容器内壁凝结,经检验发现另一生成物是空气的主要成分之一。写出反应的化学方程式:___________ 。
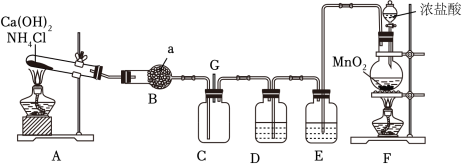
(1)装置A中发生的化学反应方程式是
(2)仪器a的名称为
(3)装置F中浓盐酸发生反应时体现的性质是
(4)为得到干燥、纯净的氯气,D、E分别应盛放的试剂是
①饱和NaCl溶液 ②浓NaOH溶液 ③浓硫酸 ④饱和NaHCO3溶液
(5)通入C装置的两根导管左边较长、右边较短,目的是
您最近一年使用:0次
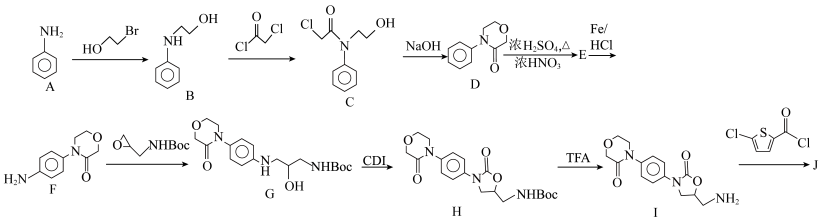
7 . 利伐沙班(J)是一种新型抗凝药物,可用于治疗下肢静脉血栓,合成路线如下:
(1)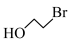 的名称为
的名称为_________________ ;
(2)有机物C中的含氧官能团名称为____________________ ;
(3)D→E的化学方程式为_____________________ ;
(4)E→F的反应类型为________________ ;
(5)合成G时, 中引入—Boc(叔丁氧炭基)的作用是
中引入—Boc(叔丁氧炭基)的作用是_______________ ;
(6)化合物J的结构简式为_____________ ;
(7)化合物X为B的同分异构体,则符合下列条件的X的结构共有_______ 种
①遇 溶液显紫色
溶液显紫色
②分子中存在 结构,但不与苯环直接相连
结构,但不与苯环直接相连
其中,核磁共振氢谱含有6组吸收峰,且峰面积比为1∶2∶2∶2∶2∶2的是______________________ 。
已知: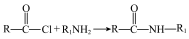
(1)
 的名称为
的名称为(2)有机物C中的含氧官能团名称为
(3)D→E的化学方程式为
(4)E→F的反应类型为
(5)合成G时,
 中引入—Boc(叔丁氧炭基)的作用是
中引入—Boc(叔丁氧炭基)的作用是(6)化合物J的结构简式为
(7)化合物X为B的同分异构体,则符合下列条件的X的结构共有
①遇
 溶液显紫色
溶液显紫色②分子中存在
 结构,但不与苯环直接相连
结构,但不与苯环直接相连其中,核磁共振氢谱含有6组吸收峰,且峰面积比为1∶2∶2∶2∶2∶2的是
您最近一年使用:0次
名校
解题方法
8 . 钴酸锂( )常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量
)常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量 、
、 、
、 等)为原料制备
等)为原料制备 并获得金属Mg副产品的一种工艺流程如图所示:
并获得金属Mg副产品的一种工艺流程如图所示:
① 的溶解度随温度升高而降低。
的溶解度随温度升高而降低。
②常温下,几种难溶物质的溶度积数据如下表所示。
回答下列问题:
(1)某小组同学利用右图装置进行“除杂1”相关操作,装置图中有一处不符合操作规范,该不规范之处是指_________________ 。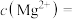
____________  。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要
。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要_________________ 。
(3)“洗涤” 固体时最好选用
固体时最好选用__________ (填“热水”或“冷水”),检验 否洗涤干净的操作是
否洗涤干净的操作是_____________________ 。
(4)高温下,“合成”反应的化学方程式为_____________________ 。
(5) 固体“溶解”后经过“一系列操作”,可以得到
固体“溶解”后经过“一系列操作”,可以得到 晶体,则“一系列操作”为
晶体,则“一系列操作”为___________________ 。
(6)“脱水”时加入 能抑制
能抑制 的水解,原因是
的水解,原因是_________________ 。
 )常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量
)常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量 、
、 、
、 等)为原料制备
等)为原料制备 并获得金属Mg副产品的一种工艺流程如图所示:
并获得金属Mg副产品的一种工艺流程如图所示: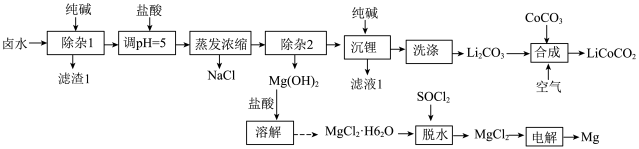
①
 的溶解度随温度升高而降低。
的溶解度随温度升高而降低。②常温下,几种难溶物质的溶度积数据如下表所示。
物质 |
|
|
|
|
|
室温下 |
|
|
|
|
|
(1)某小组同学利用右图装置进行“除杂1”相关操作,装置图中有一处不符合操作规范,该不规范之处是指
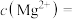
 。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要
。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要(3)“洗涤”
 固体时最好选用
固体时最好选用 否洗涤干净的操作是
否洗涤干净的操作是(4)高温下,“合成”反应的化学方程式为
(5)
 固体“溶解”后经过“一系列操作”,可以得到
固体“溶解”后经过“一系列操作”,可以得到 晶体,则“一系列操作”为
晶体,则“一系列操作”为(6)“脱水”时加入
 能抑制
能抑制 的水解,原因是
的水解,原因是
您最近一年使用:0次
2024-06-06更新
|
44次组卷
|
2卷引用:2024届山西省大同市第一中学校高三下学期高考临门一脚(一)理综试卷-高中化学
名校
9 . 氨是化肥工业和基本有机化工的主要原料。回答下列问题,
(1)查阅资料可知,H—H、N≡N、N-H的键能分别为436 、946
、946 、389
、389 ,则
,则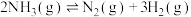 的焓变△H=
的焓变△H=______ ,该反应活化能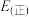
______ (填“>”或“<”)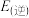 。
。
(2)已知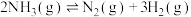 分解反应的速率方程为
分解反应的速率方程为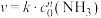 (k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
(k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
速率方程中n=______________ ;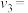
______________ 。
(3)恒压密闭容器中,充入一定量的 和
和 ,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应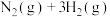
 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示:
的体积分数随温度变化如图所示:
_________ (填“>”或“<”,下同) 。
。
②240℃时,催化效果最好的催化剂为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”);T>300℃,曲线重合的原因是________________ 。
(4)恒温、恒容条件下, 和
和 按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
(5)合成氨的常用催化剂是铁触媒,已知铁为面心立方晶体,其晶胞结构如图所示,若铁原子的半径为a pm,则铁晶体中最近的两个铁原子间的距离(核间距)为____ pm;铁晶体的密度为________  (
( 表示阿伏加德罗常数的值,写出计算表达式)。
表示阿伏加德罗常数的值,写出计算表达式)。
(1)查阅资料可知,H—H、N≡N、N-H的键能分别为436
 、946
、946 、389
、389 ,则
,则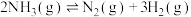 的焓变△H=
的焓变△H=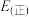
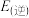 。
。(2)已知
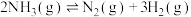 分解反应的速率方程为
分解反应的速率方程为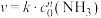 (k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
(k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:组别 |
| 速率常数k |
|
1 | 0.04 | k |
|
2 | 0.16 | k |
|
3 | 0.36 | k |
|
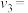
(3)恒压密闭容器中,充入一定量的
 和
和 ,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应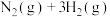
 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示:
的体积分数随温度变化如图所示: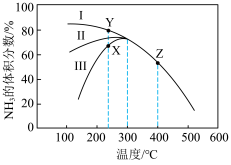
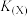
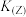 。
。②240℃时,催化效果最好的催化剂为
(4)恒温、恒容条件下,
 和
和 按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。| A.容器内压强不再发生改变 | B.容器内混合气体的平均摩尔质量不变 |
| C.容器内气体密度不再发生改变 | D. 的体积分数保持不变 的体积分数保持不变 |
(5)合成氨的常用催化剂是铁触媒,已知铁为面心立方晶体,其晶胞结构如图所示,若铁原子的半径为a pm,则铁晶体中最近的两个铁原子间的距离(核间距)为
 (
( 表示阿伏加德罗常数的值,写出计算表达式)。
表示阿伏加德罗常数的值,写出计算表达式)。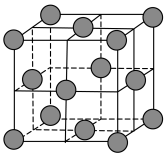
您最近一年使用:0次
名校
解题方法
10 . 四氯化碳( )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
① 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;
② 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
③硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。
回答下列问题:
(1)装置A中仪器a的名称是___________ ,用浓盐酸与 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为____________ (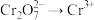 )。
)。
(2)装置的连接顺序为___________ 。
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为_______ (填编号);装置C中冷凝管的作用是____________ ,冷水从_________ 口通入。 、
、 ,此时装置F的作用为
,此时装置F的作用为_________________ 。
(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:_________ 。
(6)装置C中反应结束后,先过滤除去固体_________ (填名称),再经过_________ (填操作名称)可得到 。
。
 )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。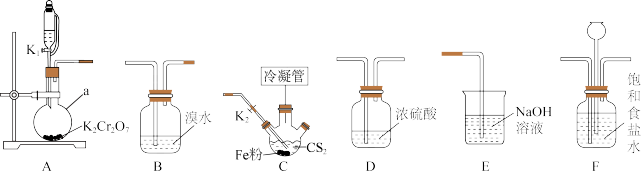
①
 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;②
 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;③硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。回答下列问题:
(1)装置A中仪器a的名称是
 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为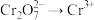 )。
)。(2)装置的连接顺序为
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为

 、
、 ,此时装置F的作用为
,此时装置F的作用为(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:
(6)装置C中反应结束后,先过滤除去固体
 。
。
您最近一年使用:0次
2024-06-06更新
|
72次组卷
|
2卷引用:2024届山西省大同市第一中学校高三下学期高考临门一脚(一)理综试卷-高中化学