1 . 铁是一种重要的金属元素,铁的单质及化合物在社会生产、生活和科学研究中应用广泛。回答下列问题:
(1)基态Fe的价层电子排布式为___________ ,其中含有的单电子数为___________ 。
(2)已知 的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则
的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则 的晶体类型为
的晶体类型为___________ ;画出 二聚体的结构式(不要求立体结构):
二聚体的结构式(不要求立体结构):___________ 。
(3)已知反式尖晶石结构晶体的通式为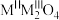 ,属于立方晶系。其晶胞中一半
,属于立方晶系。其晶胞中一半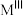 占据所有
占据所有 构成的四面体空隙,
构成的四面体空隙,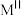 与另外一半
与另外一半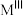 占据所有
占据所有 构成的八面体空隙。
构成的八面体空隙。 晶体为反式尖晶石结构,1个
晶体为反式尖晶石结构,1个 晶胞中,
晶胞中, 堆积共形成四面体空隙和八面体空隙的总和为24,则1个
堆积共形成四面体空隙和八面体空隙的总和为24,则1个 晶胞中
晶胞中 构成的四面体空隙的数目为
构成的四面体空隙的数目为___________ 。
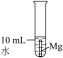
(4)研究储氢材料对解决未来能源问题具有重要意义。某种Mg与Fe形成的储氢材料储氢后的晶胞结构如图所示(H原子位置未标出),晶胞参数(晶胞棱长)为a pm,H原子以正八面体、6配位的配位模式分布在Fe原子的周围,晶胞中每条棱上有2个H原子,H原子与Fe原子的最短距离为 。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为
。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为___________ %(Mg原子的填隙率 );该材料的化学式为
);该材料的化学式为___________ ;晶体中Mg原子与H原子之间的最短距离为___________ pm。
(1)基态Fe的价层电子排布式为
(2)已知
 的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则
的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则 的晶体类型为
的晶体类型为 二聚体的结构式(不要求立体结构):
二聚体的结构式(不要求立体结构):(3)已知反式尖晶石结构晶体的通式为
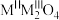 ,属于立方晶系。其晶胞中一半
,属于立方晶系。其晶胞中一半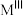 占据所有
占据所有 构成的四面体空隙,
构成的四面体空隙,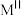 与另外一半
与另外一半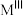 占据所有
占据所有 构成的八面体空隙。
构成的八面体空隙。 晶体为反式尖晶石结构,1个
晶体为反式尖晶石结构,1个 晶胞中,
晶胞中, 堆积共形成四面体空隙和八面体空隙的总和为24,则1个
堆积共形成四面体空隙和八面体空隙的总和为24,则1个 晶胞中
晶胞中 构成的四面体空隙的数目为
构成的四面体空隙的数目为(4)研究储氢材料对解决未来能源问题具有重要意义。某种Mg与Fe形成的储氢材料储氢后的晶胞结构如图所示(H原子位置未标出),晶胞参数(晶胞棱长)为a pm,H原子以正八面体、6配位的配位模式分布在Fe原子的周围,晶胞中每条棱上有2个H原子,H原子与Fe原子的最短距离为
 。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为
。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为 );该材料的化学式为
);该材料的化学式为
您最近一年使用:0次
7日内更新
|
5次组卷
|
2卷引用:陕西省榆林市2023-2024学年高三下学期开学理综试题-高中化学
2 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。回答下列问题:
(1)CO2与CO2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1: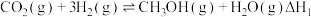
反应2: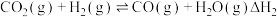
已知:在一定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。几种物质在298K的标准摩尔生成焓如表所示:
则△H2___________ 。
(2)CO2资源化利用是实现碳中和的重要途径。科学家近年发明了一种新型Zn-CO2水介质电池,可将CO2转化为甲酸,如图所示,双极隔膜由一层阳离子交换膜和一层阴离子交换膜复合而成,中间为水,作为电解质溶液中H+和OH-的来源。___________ ;双极隔膜中左侧的离子交换膜为___________ (填“阴”或“阳”)离子交换膜。
(3)在某纳米级催化剂上,CO2直接催化加氢生成甲酸,其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态,该历程中决速步骤的化学方程式为___________ 。 ,
, 的平衡转化率随温度、压强的变化如图所示:
的平衡转化率随温度、压强的变化如图所示:___________ (填选项字母)。
A.同时断裂2 mol C-H键和1 mol H-H键 B.容器内混合气体的压强保持不变
C.反应速率有2v正(CO2)=v正(H2) D.容器中混合气体的密度保持不变
E.混合气体的平均摩尔质量保持不变
②由图丙可知,压强p1___________ p2(填“>”“<”或“=”,下同);压强为p2时,Y点速率v正___________ v逆。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则压强为p2时,X点对应温度下的Kp=___________ (用含p2的代数式表示)。
(1)CO2与CO2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:
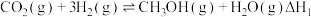
反应2:
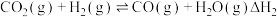
已知:在一定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓。几种物质在298K的标准摩尔生成焓如表所示:
| 物质 | CO2(g) | CO(g) | CH3OH(g) | H2O(g) | H2(g) |
| 标准摩尔生成焓(kJ/mol) | -393.51 | -110.5 | -201.17 | -241.82 | 0 |
(2)CO2资源化利用是实现碳中和的重要途径。科学家近年发明了一种新型Zn-CO2水介质电池,可将CO2转化为甲酸,如图所示,双极隔膜由一层阳离子交换膜和一层阴离子交换膜复合而成,中间为水,作为电解质溶液中H+和OH-的来源。
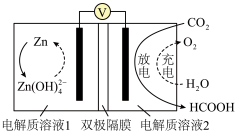
(3)在某纳米级催化剂上,CO2直接催化加氢生成甲酸,其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态,该历程中决速步骤的化学方程式为
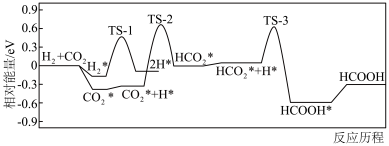
 ,
, 的平衡转化率随温度、压强的变化如图所示:
的平衡转化率随温度、压强的变化如图所示: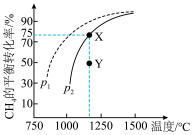
A.同时断裂2 mol C-H键和1 mol H-H键 B.容器内混合气体的压强保持不变
C.反应速率有2v正(CO2)=v正(H2) D.容器中混合气体的密度保持不变
E.混合气体的平均摩尔质量保持不变
②由图丙可知,压强p1
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则压强为p2时,X点对应温度下的Kp=
您最近一年使用:0次
7日内更新
|
32次组卷
|
2卷引用:陕西省榆林市2023-2024学年高三下学期开学理综试题-高中化学
解题方法
3 . 碲(Te)是重要的稀有元素,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。一种从碲化镉废料(主要成分为CdTe、CdS、 )中回收Te和Cd的工艺流程如图所示:
)中回收Te和Cd的工艺流程如图所示: 的电离平衡常数
的电离平衡常数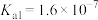 ,
,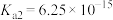 ;
;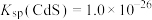 ,
,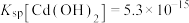 。
。
回答下列问题:
(1)在元素周期表中碲与硫同主族,碲原子比硫原子多2个电子层,碲的原子结构示意图为___________ 。
(2)为提高“氧化浸出”速率,可采取的措施有___________ (任答两条)。
(3)“氧化浸出”过程中CdTe反应的离子方程式为___________ 。
(4)“溶浸”过程中产生“浸渣”的主要成分为S和___________ (填化学式);“还原”过程中发生反应的化学方程式为___________ 。
(5)沉淀溶解平衡中,离子浓度≤10-5mol/L时视为完全沉淀。“沉镉”过程中,当 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中 浓度为
浓度为___________ ;若此时溶液 ,则溶液中
,则溶液中
___________  。
。
 )中回收Te和Cd的工艺流程如图所示:
)中回收Te和Cd的工艺流程如图所示: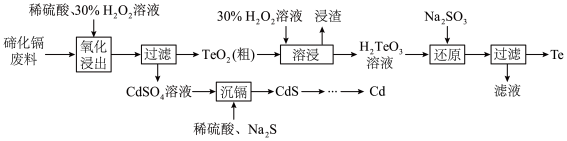
 的电离平衡常数
的电离平衡常数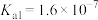 ,
,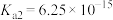 ;
; ,
,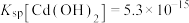 。
。回答下列问题:
(1)在元素周期表中碲与硫同主族,碲原子比硫原子多2个电子层,碲的原子结构示意图为
(2)为提高“氧化浸出”速率,可采取的措施有
(3)“氧化浸出”过程中CdTe反应的离子方程式为
(4)“溶浸”过程中产生“浸渣”的主要成分为S和
(5)沉淀溶解平衡中,离子浓度≤10-5mol/L时视为完全沉淀。“沉镉”过程中,当
 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中 浓度为
浓度为 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
7日内更新
|
18次组卷
|
2卷引用:陕西省榆林市2023-2024学年高三下学期开学理综试题-高中化学
解题方法
4 . 某医用有机试剂中间体的一种合成方法如图所示:
(1)根据系统命名法,B的名称是___________ ;C中含有官能团的名称是___________ 。
(2) 的“条件
的“条件 ”为
”为___________ ; 的反应类型为
的反应类型为___________ 。
(3) 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(4) 反应过程中,
反应过程中, 的作用为
的作用为___________ 。
(5) 的化学方程式为
的化学方程式为___________ 。
(6) 的同分异构体中符合下列条件的共有
的同分异构体中符合下列条件的共有___________ 种(不考虑立体异构)。
①含有 ;②能与碳酸钠溶液反应产生
;②能与碳酸钠溶液反应产生 ;③能发生银镜反应,但不能发生水解反应
;③能发生银镜反应,但不能发生水解反应
(7)设计由有机物 制备
制备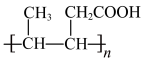 的合成路线:
的合成路线:___________ (无机试剂任选)。

(1)根据系统命名法,B的名称是
(2)
 的“条件
的“条件 ”为
”为 的反应类型为
的反应类型为(3)
 第一步反应的化学方程式为
第一步反应的化学方程式为(4)
 反应过程中,
反应过程中, 的作用为
的作用为(5)
 的化学方程式为
的化学方程式为(6)
 的同分异构体中符合下列条件的共有
的同分异构体中符合下列条件的共有①含有
 ;②能与碳酸钠溶液反应产生
;②能与碳酸钠溶液反应产生 ;③能发生银镜反应,但不能发生水解反应
;③能发生银镜反应,但不能发生水解反应(7)设计由有机物
 制备
制备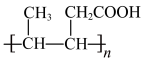 的合成路线:
的合成路线:
您最近一年使用:0次
7日内更新
|
25次组卷
|
2卷引用:2024届普通高等学校招生全国统一考试青桐鸣大联考理科综合化学试题
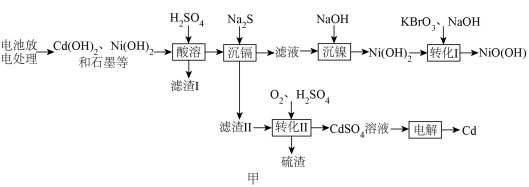
5 . 镍镉电池是最早应用于手机、超科等设备的电池种类,它具有良好的大电流放电特性、耐过充放电能力强、维护简单。某废旧镍镉电池的回收再生工艺流程如图甲所示:
回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)已知镍镉电池的工作原理为: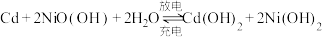 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为___________ 。
(3)“沉镉”操作选用的沉淀剂为 ,而不选用
,而不选用 的原因为
的原因为___________ 。
(4)室温下,“沉镍”过程中为确保滤液中 不超过
不超过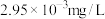 ,需要调节溶液的
,需要调节溶液的
___________ ;检验 已洗深干净的方法为
已洗深干净的方法为___________ 。
(5)“转化Ⅰ”发生反应的离子方程式为___________ 。
(6)“转化Ⅱ”发生反应的化学方程式为___________ 。
(7)金属镉晶体中原子的堆积方式为六方最密堆积,如图乙所示,晶胞可用图丙表示,则该晶胞中含有的原子个数为___________ ,已知该晶胞的底边长为 ,高为
,高为 ,则该晶体的密度为
,则该晶体的密度为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
| 物质 |  |  |  |  |
 | 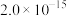 | 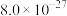 | 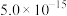 | 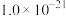 |
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)已知镍镉电池的工作原理为:
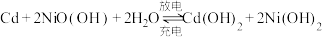 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为(3)“沉镉”操作选用的沉淀剂为
 ,而不选用
,而不选用 的原因为
的原因为(4)室温下,“沉镍”过程中为确保滤液中
 不超过
不超过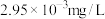 ,需要调节溶液的
,需要调节溶液的
 已洗深干净的方法为
已洗深干净的方法为(5)“转化Ⅰ”发生反应的离子方程式为
(6)“转化Ⅱ”发生反应的化学方程式为
(7)金属镉晶体中原子的堆积方式为六方最密堆积,如图乙所示,晶胞可用图丙表示,则该晶胞中含有的原子个数为
 ,高为
,高为 ,则该晶体的密度为
,则该晶体的密度为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。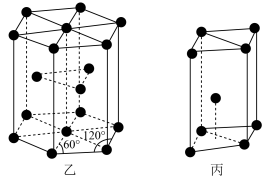
您最近一年使用:0次
7日内更新
|
20次组卷
|
2卷引用:2024届普通高等学校招生全国统一考试青桐鸣大联考理科综合化学试题
解题方法
6 . 氯乙烯是一种用途广泛的有机原料,可制备多种化工产品。回答下列问题:
已知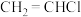 与
与 发生加成反应的化学方程式如下:
发生加成反应的化学方程式如下:
Ⅰ.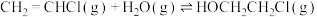
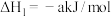
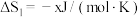
Ⅱ.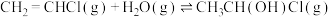
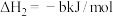
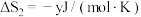
“反应Ⅰ”和“反应Ⅱ”满足范特霍夫方程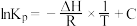 (
(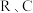 均为常数,不同的反应
均为常数,不同的反应 值不同),平衡常数与温度的关系如图甲所示,生成物的产率随温度的变化情况如图乙所示:
值不同),平衡常数与温度的关系如图甲所示,生成物的产率随温度的变化情况如图乙所示: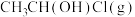 转化为
转化为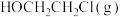 的热化学方程式为
的热化学方程式为___________ 。
(2)若已知反应
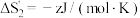 ,则熵变的数值
,则熵变的数值
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3)由图甲可知“反应Ⅰ”和“反应Ⅱ”的焓变
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)图乙中表示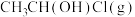 的产率随温度变化的曲线为
的产率随温度变化的曲线为___________ (填“M”或“N”)。
(5) 时,在初始压强为
时,在初始压强为 的恒容密闭容器中,按物质的量之比为
的恒容密闭容器中,按物质的量之比为 充入
充入 和
和 ,发生“反应Ⅰ”和“反应Ⅱ”,达到平衡时,容器中
,发生“反应Ⅰ”和“反应Ⅱ”,达到平衡时,容器中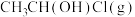 和
和 的分压分别为
的分压分别为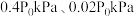 。则:
。则:
①平衡时, 的转化率为
的转化率为___________  。
。
② 时,“反应Ⅱ”的平衡常数
时,“反应Ⅱ”的平衡常数
___________  (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
③若其它条件不变,将恒容密闭容器换成压强为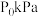 的恒压密闭容器,反应达到平衡时,
的恒压密闭容器,反应达到平衡时,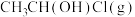 的平衡产率将
的平衡产率将___________ (填“增大”“减小”或“不变”),原因为___________ 。
已知
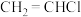 与
与 发生加成反应的化学方程式如下:
发生加成反应的化学方程式如下:Ⅰ.
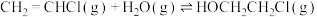
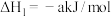
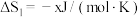
Ⅱ.
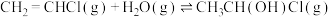
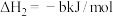
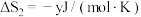
“反应Ⅰ”和“反应Ⅱ”满足范特霍夫方程
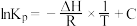 (
(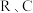 均为常数,不同的反应
均为常数,不同的反应 值不同),平衡常数与温度的关系如图甲所示,生成物的产率随温度的变化情况如图乙所示:
值不同),平衡常数与温度的关系如图甲所示,生成物的产率随温度的变化情况如图乙所示: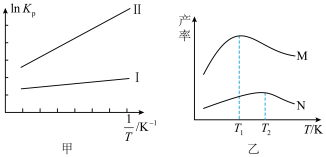
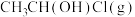 转化为
转化为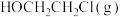 的热化学方程式为
的热化学方程式为(2)若已知反应

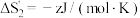 ,则熵变的数值
,则熵变的数值
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)由图甲可知“反应Ⅰ”和“反应Ⅱ”的焓变

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)图乙中表示
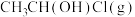 的产率随温度变化的曲线为
的产率随温度变化的曲线为(5)
 时,在初始压强为
时,在初始压强为 的恒容密闭容器中,按物质的量之比为
的恒容密闭容器中,按物质的量之比为 充入
充入 和
和 ,发生“反应Ⅰ”和“反应Ⅱ”,达到平衡时,容器中
,发生“反应Ⅰ”和“反应Ⅱ”,达到平衡时,容器中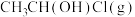 和
和 的分压分别为
的分压分别为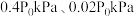 。则:
。则:①平衡时,
 的转化率为
的转化率为 。
。②
 时,“反应Ⅱ”的平衡常数
时,“反应Ⅱ”的平衡常数
 (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。③若其它条件不变,将恒容密闭容器换成压强为
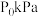 的恒压密闭容器,反应达到平衡时,
的恒压密闭容器,反应达到平衡时,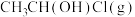 的平衡产率将
的平衡产率将
您最近一年使用:0次
7日内更新
|
41次组卷
|
2卷引用:2024届普通高等学校招生全国统一考试青桐鸣大联考理科综合化学试题
解题方法
7 . 二氯四氨合钯 是重要的钯化合物,广泛应用在化学催化及电镀工业。利用钯粉制备二氯四氨合钯的实验过程和部分装置如下:
是重要的钯化合物,广泛应用在化学催化及电镀工业。利用钯粉制备二氯四氨合钯的实验过程和部分装置如下: 钯粉,加入适量的王水[
钯粉,加入适量的王水[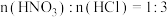 ]中,使钯粉溶解,溶液中有无色气泡产生,加热赶出溶液中的含氮化合物,经浓缩、结晶、过滤、洗涤后得到四氯合钯酸(
]中,使钯粉溶解,溶液中有无色气泡产生,加热赶出溶液中的含氮化合物,经浓缩、结晶、过滤、洗涤后得到四氯合钯酸( );
);
Ⅱ.将四氯合钯酸加入到装置 中,用3倍体积的去离子水溶解,加入搅拌磁子;
中,用3倍体积的去离子水溶解,加入搅拌磁子;
Ⅲ.将装置 中的混合物在
中的混合物在 条件下恒温加热2小时;
条件下恒温加热2小时;
Ⅳ.在不断搅拌并持续保温下,缓慢加入浓氨水,开始时装置 中产生白烟,溶液内有沉淀产生,继续滴加浓氨水,溶液逐渐澄清,最后得到浅黄色的
中产生白烟,溶液内有沉淀产生,继续滴加浓氨水,溶液逐渐澄清,最后得到浅黄色的 溶液;
溶液;
Ⅴ.浅黄色溶液经过一系列操作,得到 纯净的二氯四氨合钯
纯净的二氯四氨合钯 产品。
产品。
回答下列问题:
(1)“步骤Ⅰ”中溶解钯粉时,氧化剂与还原剂的物质的量之比为___________ 。
(2)装置 的仪器名称为
的仪器名称为___________ ;装置 的作用为
的作用为___________ 。
(3)“步骤Ⅲ”中最佳的加热方式为___________(填选项字母)。
(4)“步骤Ⅳ”中产生沉淀时发生的反应为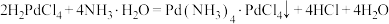 ;继续滴加浓氨水,溶液逐渐澄清,此时发生反应的化学方程式为
;继续滴加浓氨水,溶液逐渐澄清,此时发生反应的化学方程式为___________ 。
(5)装置c中产生的白烟的成分可能为___________ 。
(6)根据实验分析,在题述实验条件下,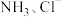 与钯的配位能力强弱顺序为:
与钯的配位能力强弱顺序为:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(7)“步骤Ⅴ”中的一系列操作为:将浅黄色溶液加热浓缩,___________ 时停止加热,冷却结晶,经过滤、洗涤、 真空干燥后得到纯净的二氯四氨合钯。
真空干燥后得到纯净的二氯四氨合钯。
(8)本实验中产品产率为___________ (保留3位有效数字)。
 是重要的钯化合物,广泛应用在化学催化及电镀工业。利用钯粉制备二氯四氨合钯的实验过程和部分装置如下:
是重要的钯化合物,广泛应用在化学催化及电镀工业。利用钯粉制备二氯四氨合钯的实验过程和部分装置如下: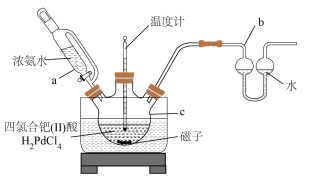
 钯粉,加入适量的王水[
钯粉,加入适量的王水[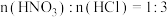 ]中,使钯粉溶解,溶液中有无色气泡产生,加热赶出溶液中的含氮化合物,经浓缩、结晶、过滤、洗涤后得到四氯合钯酸(
]中,使钯粉溶解,溶液中有无色气泡产生,加热赶出溶液中的含氮化合物,经浓缩、结晶、过滤、洗涤后得到四氯合钯酸( );
);Ⅱ.将四氯合钯酸加入到装置
 中,用3倍体积的去离子水溶解,加入搅拌磁子;
中,用3倍体积的去离子水溶解,加入搅拌磁子;Ⅲ.将装置
 中的混合物在
中的混合物在 条件下恒温加热2小时;
条件下恒温加热2小时;Ⅳ.在不断搅拌并持续保温下,缓慢加入浓氨水,开始时装置
 中产生白烟,溶液内有沉淀产生,继续滴加浓氨水,溶液逐渐澄清,最后得到浅黄色的
中产生白烟,溶液内有沉淀产生,继续滴加浓氨水,溶液逐渐澄清,最后得到浅黄色的 溶液;
溶液;Ⅴ.浅黄色溶液经过一系列操作,得到
 纯净的二氯四氨合钯
纯净的二氯四氨合钯 产品。
产品。回答下列问题:
(1)“步骤Ⅰ”中溶解钯粉时,氧化剂与还原剂的物质的量之比为
(2)装置
 的仪器名称为
的仪器名称为 的作用为
的作用为(3)“步骤Ⅲ”中最佳的加热方式为___________(填选项字母)。
| A.水浴加热 | B.油浴加热 | C.酒精灯加热 | D.酒精喷灯加热 |
(4)“步骤Ⅳ”中产生沉淀时发生的反应为
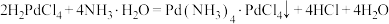 ;继续滴加浓氨水,溶液逐渐澄清,此时发生反应的化学方程式为
;继续滴加浓氨水,溶液逐渐澄清,此时发生反应的化学方程式为(5)装置c中产生的白烟的成分可能为
(6)根据实验分析,在题述实验条件下,
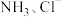 与钯的配位能力强弱顺序为:
与钯的配位能力强弱顺序为:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(7)“步骤Ⅴ”中的一系列操作为:将浅黄色溶液加热浓缩,
 真空干燥后得到纯净的二氯四氨合钯。
真空干燥后得到纯净的二氯四氨合钯。(8)本实验中产品产率为
您最近一年使用:0次
7日内更新
|
20次组卷
|
2卷引用:2024届普通高等学校招生全国统一考试青桐鸣大联考理科综合化学试题
8 . 化学工业上用二氧化锰生产硫酸锰、高锰酸钾、碳酸锰、氯化锰、硝酸锰、一氧化锰等。利用含锰工业废料[含 ,MnOOH,
,MnOOH, 及少量Fe]制备Zn和
及少量Fe]制备Zn和 的一种工艺流程如图所示:
的一种工艺流程如图所示: 在酸性条件下比较稳定,pH高于5.5时易被氧气氧化;
在酸性条件下比较稳定,pH高于5.5时易被氧气氧化;
②室温下,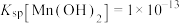 ,
,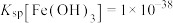 ,
,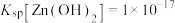 ,
,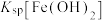
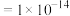 ;
;
③当离子浓度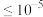 mol/L时,离子沉淀完全。
mol/L时,离子沉淀完全。
请回答下列问题:
(1)“还原焙烧”时,需要把“废料”粉碎的目的是_______ 。
(2)“还原焙烧”时,加入过量炭黑的主要作用是将 、MnOOH转化成MnO,其中炭黑与MnOOH反应时还原剂和还原产物物质的量之比为
、MnOOH转化成MnO,其中炭黑与MnOOH反应时还原剂和还原产物物质的量之比为_______ 。
(3)“酸浸”过程中发生的非氧化还原反应的离子方程式为_______ 。
(4)“酸浸”分离滤渣1和滤液在实验室中使用到的玻璃仪器有_______ ,滤渣1的主要成分是_______ 。
(5)“净化”包括_______ 和调节pH两步,向溶液中加入_______ (填化学式)来调节溶液pH,假设滤液中 ,
, 的浓度是0.1 mol/L,应将溶液pH调节的合理范围是
的浓度是0.1 mol/L,应将溶液pH调节的合理范围是_______ 。
(6)“电解”时,阳极的电极反应式为_______ ,电解后的溶液可以循环利用于该流程中的_______ 步骤。
 ,MnOOH,
,MnOOH, 及少量Fe]制备Zn和
及少量Fe]制备Zn和 的一种工艺流程如图所示:
的一种工艺流程如图所示: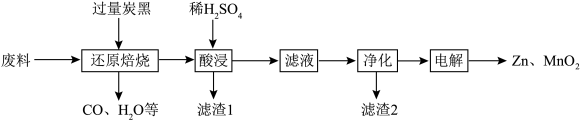
 在酸性条件下比较稳定,pH高于5.5时易被氧气氧化;
在酸性条件下比较稳定,pH高于5.5时易被氧气氧化;②室温下,
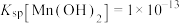 ,
,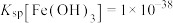 ,
,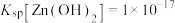 ,
,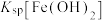
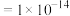 ;
;③当离子浓度
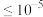 mol/L时,离子沉淀完全。
mol/L时,离子沉淀完全。请回答下列问题:
(1)“还原焙烧”时,需要把“废料”粉碎的目的是
(2)“还原焙烧”时,加入过量炭黑的主要作用是将
 、MnOOH转化成MnO,其中炭黑与MnOOH反应时还原剂和还原产物物质的量之比为
、MnOOH转化成MnO,其中炭黑与MnOOH反应时还原剂和还原产物物质的量之比为(3)“酸浸”过程中发生的非氧化还原反应的离子方程式为
(4)“酸浸”分离滤渣1和滤液在实验室中使用到的玻璃仪器有
(5)“净化”包括
 ,
, 的浓度是0.1 mol/L,应将溶液pH调节的合理范围是
的浓度是0.1 mol/L,应将溶液pH调节的合理范围是(6)“电解”时,阳极的电极反应式为
您最近一年使用:0次
7日内更新
|
29次组卷
|
2卷引用:2024届陕西省西安市周至县高三上学期第一次模拟考试理综试题-高中化学
名校
9 . 某研究小组为制备 并探究
并探究 溶液的性质,设计并完成了下列实验。
溶液的性质,设计并完成了下列实验。
请回答下列问题:
(1)模拟侯氏制碱工艺制备 。
。_______ ,仪器ii的作用为_______ 。
②各仪器接口的连接顺序为_______ 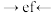
_______ (用字母表示,用→代表气流方向)。
(2)该小组为探究 与
与 溶液能快速反应产生
溶液能快速反应产生 的原因(实验中的镁条均经过打磨)进行了如下实验。
的原因(实验中的镁条均经过打磨)进行了如下实验。
查阅资料:与致密的 相比,
相比,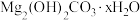 是质地疏松的难溶物。
是质地疏松的难溶物。
①与实验ii相比,实验i观察到镁条表面只有极微量气泡附着的原因为_______ 。
②该小组欲借助肥皂液等检验实验ii中产生的 ,写出相应的实验操作与现象:
,写出相应的实验操作与现象:_______ 。
③实验iii证实 对
对 与水反应起促进作用,试从化学平衡移动角度解释其原因:
与水反应起促进作用,试从化学平衡移动角度解释其原因:_______ 。
(3)查阅资料:水存在自耦电离,方程式为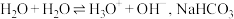 溶液中
溶液中 也存在类似水的电离[已知:常温下
也存在类似水的电离[已知:常温下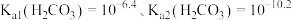 ]。
]。
用 传感器测量常温下不同浓度
传感器测量常温下不同浓度 溶液的
溶液的 ,结果如下表。
,结果如下表。
写出 自耦电离方程式:
自耦电离方程式:_______ ,理论上表格中的
_______ 。
 并探究
并探究 溶液的性质,设计并完成了下列实验。
溶液的性质,设计并完成了下列实验。请回答下列问题:
(1)模拟侯氏制碱工艺制备
 。
。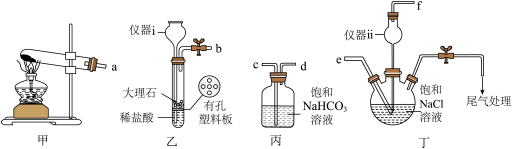
②各仪器接口的连接顺序为
(2)该小组为探究
 与
与 溶液能快速反应产生
溶液能快速反应产生 的原因(实验中的镁条均经过打磨)进行了如下实验。
的原因(实验中的镁条均经过打磨)进行了如下实验。| 实验组别 | 实验内容 | 实验现象 |
| i |
| 镁条表面有极微量气泡附着 |
| ii |
| 镁条表面持续产生大量气泡(经检验为 ),溶液变浑浊[经检验该浑浊物为 ),溶液变浑浊[经检验该浑浊物为 ] ] |
| iii | 将实验i中的镁条取出,立即加入到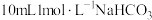 溶液中,很快镁条表面持续产生大量气泡 溶液中,很快镁条表面持续产生大量气泡 | |
 相比,
相比,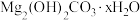 是质地疏松的难溶物。
是质地疏松的难溶物。①与实验ii相比,实验i观察到镁条表面只有极微量气泡附着的原因为
②该小组欲借助肥皂液等检验实验ii中产生的
 ,写出相应的实验操作与现象:
,写出相应的实验操作与现象:③实验iii证实
 对
对 与水反应起促进作用,试从化学平衡移动角度解释其原因:
与水反应起促进作用,试从化学平衡移动角度解释其原因:(3)查阅资料:水存在自耦电离,方程式为
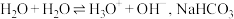 溶液中
溶液中 也存在类似水的电离[已知:常温下
也存在类似水的电离[已知:常温下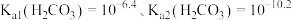 ]。
]。用
 传感器测量常温下不同浓度
传感器测量常温下不同浓度 溶液的
溶液的 ,结果如下表。
,结果如下表。 溶液的浓度/ 溶液的浓度/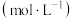 | 1 | 0.5 | 0.1 | 0.01 |
 | a | a | a | a |
 自耦电离方程式:
自耦电离方程式:
您最近一年使用:0次
7日内更新
|
108次组卷
|
5卷引用:陕西省延安新区部分学校2024-2025学年高三上学期开学摸底考试化学试卷
名校
10 . H2S是一种有毒气体,利用H2S与CH4的反应可将其转化为有价值的H2、S2等。发生的反应有:
反应ⅰ: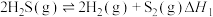
反应ⅱ:
回答下列问题:
(1)CO2中心原子价层电子对数为________ 。
(2)已知相关化学键的键能如下表:
反应ⅰ: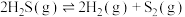 的
的
________ kJ⋅mol-1。
(3)一定温度下,在体积为2L的刚性容器中,充入1molCH4和2molH2S,发生反应i和反应ⅱ,5min时反应达到平衡,H2S的平衡转化率为40%, 。
。
①下列叙述中能说明反应ⅱ达到平衡状态的是________ (填字母)。
A. B.混合气体的密度不再变化
B.混合气体的密度不再变化
C.断裂1molC—H的同时生成1molC=S D.混合气体的平均摩尔质量不再变化
②0~5min内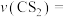
________ mol⋅L-1⋅min-1。
③此温度下,反应ⅱ的平衡常数Kx=________ (Kx是以平衡物质的量分数代替平衡浓度计算的平衡常数)。
(4)在常压和不同温度下,将H2S和CH4按照2∶1的体积比充入热解器中,用N2稀释,发生反应ⅰ和反应ⅱ。反应相同时间后,H2、S2和CS2的体积分数随温度的变化关系如图所示。
________ (填“>”“<”或“=”)0,低于1000℃时反应ⅱ________ (填“能”或“不能”)发生。
②1050℃时,H2的体积分数为________ 。
③温度高于1100℃时,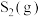 体积分数减小的原因是
体积分数减小的原因是________ 。
反应ⅰ:
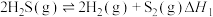
反应ⅱ:

回答下列问题:
(1)CO2中心原子价层电子对数为
(2)已知相关化学键的键能如下表:
化学键 | H—H | H—S | S2(化学键视为S—S) |
键能/(kJ·mol-1) | 436 | 339 | 298 |
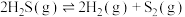 的
的
(3)一定温度下,在体积为2L的刚性容器中,充入1molCH4和2molH2S,发生反应i和反应ⅱ,5min时反应达到平衡,H2S的平衡转化率为40%,
 。
。①下列叙述中能说明反应ⅱ达到平衡状态的是
A.
 B.混合气体的密度不再变化
B.混合气体的密度不再变化C.断裂1molC—H的同时生成1molC=S D.混合气体的平均摩尔质量不再变化
②0~5min内
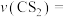
③此温度下,反应ⅱ的平衡常数Kx=
(4)在常压和不同温度下,将H2S和CH4按照2∶1的体积比充入热解器中,用N2稀释,发生反应ⅰ和反应ⅱ。反应相同时间后,H2、S2和CS2的体积分数随温度的变化关系如图所示。
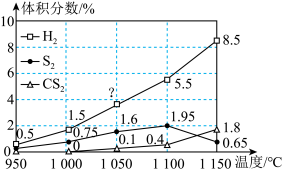

②1050℃时,H2的体积分数为
③温度高于1100℃时,
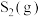 体积分数减小的原因是
体积分数减小的原因是
您最近一年使用:0次
2024-09-16更新
|
154次组卷
|
4卷引用:山西省运城市康杰中学2024-2025学年高三上学期一模考试 化学试题