9-10高一下·河北唐山·期中
名校
解题方法
1 . 在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A+2B=3C。反应经2min后,A的浓度从开始时的1.0mol·L-1降到0.8mol·L-1。已知反应开始时B的浓度是1.2mol·L-1。
(1)2min末B、C的浓度____ 。
(2)用A表示该反应2min内的平均速率____ 。
(1)2min末B、C的浓度
(2)用A表示该反应2min内的平均速率
您最近一年使用:0次
2022-02-10更新
|
755次组卷
|
7卷引用:2011-2012学年广东省梅州市曾宪梓中学高一5月月考化学试卷
(已下线)2011-2012学年广东省梅州市曾宪梓中学高一5月月考化学试卷(已下线)2009---2010学年唐山二中高一第二学期期中化学试卷陕西省西安中学2019-2020学年高一下学期期中考试(平行班)化学试题(已下线)6.1.1 化学反应速率-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第二册)江苏省扬州市江都区邵伯高级中学2020-2021学年高一下学期期中考试化学试题苏教2020版化学必修第二册专题6第一单元 化学反应速率与反应限度课后习题福建省福州市福清市虞阳中学2022-2023学年下学期高一年第一次月考化学试卷
名校
解题方法
2 . 现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的 ;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
回答下列问题:
(1)用电子式表示C和E形成化合物的过程:______ 。
(2)写出基态F原子的核外电子排布式:______ 。
(3)A2D的电子式为______ ,其分子中______ (填“含”或“不含”,下同) 键,
键,______ π键。
(4)A、B、C共同形成的化合物中化学键的类型有______ 。
 ;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答下列问题:
(1)用电子式表示C和E形成化合物的过程:
(2)写出基态F原子的核外电子排布式:
(3)A2D的电子式为
 键,
键,(4)A、B、C共同形成的化合物中化学键的类型有
您最近一年使用:0次
2021-02-16更新
|
2266次组卷
|
5卷引用:广东省佛山市顺德市李兆基中学2022-2023学年高二下学期3月月考化学试题
广东省佛山市顺德市李兆基中学2022-2023学年高二下学期3月月考化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第1节 共价键模型(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键(已下线)2.1 共价键(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)甘肃省武威市凉州区2022-2023学年高二下学期期中考试化学试题
解题方法
3 . 写出下列反应的热化学方程式。
(1)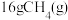 与适量
与适量 反应生成
反应生成 和
和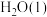 ,放出890.3kJ热量:
,放出890.3kJ热量:_______ 。
(2)若适量的 和
和 完全反应,每生成
完全反应,每生成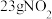 需要吸收16.95kJ热量:
需要吸收16.95kJ热量:_______ 。
(3)汽油的重要成分是辛烷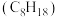 ,
, 在
在 在燃烧,生成
在燃烧,生成 和
和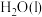 ,放出5518kJ热量:
,放出5518kJ热量:_______ 。
(4)卫星发射时可用肼 作燃料,
作燃料, 在
在 中燃烧,生成
中燃烧,生成 和
和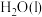 ,放出622kJ热量:
,放出622kJ热量:_______ 。
(1)
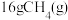 与适量
与适量 反应生成
反应生成 和
和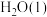 ,放出890.3kJ热量:
,放出890.3kJ热量:(2)若适量的
 和
和 完全反应,每生成
完全反应,每生成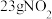 需要吸收16.95kJ热量:
需要吸收16.95kJ热量:(3)汽油的重要成分是辛烷
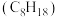 ,
, 在
在 在燃烧,生成
在燃烧,生成 和
和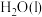 ,放出5518kJ热量:
,放出5518kJ热量:(4)卫星发射时可用肼
 作燃料,
作燃料, 在
在 中燃烧,生成
中燃烧,生成 和
和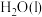 ,放出622kJ热量:
,放出622kJ热量:
您最近一年使用:0次
2021-01-15更新
|
1780次组卷
|
4卷引用:广东省汕头市潮南区龙岭中英文学校2023-2024学年高二上学期10月月考化学试题
广东省汕头市潮南区龙岭中英文学校2023-2024学年高二上学期10月月考化学试题甘肃省白银市会宁县2020-2021学年高二上学期期末考试化学试题(已下线)1.1.2 热化学方程式 燃烧热(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)第一章 化学反应的热效应(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
名校
4 . 把7 molA气体和5 molB气体混合放入2 L密闭容器中,在一定条件下发生反应:3A(g)+B(g)⇌2C(s)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·(L·min)-1,求:
(1)B的转化率_______
(2)x的值_______
(3)平衡时压强与初始时压强之比_______
(4)该温度下此反应的平衡常数_______
(1)B的转化率
(2)x的值
(3)平衡时压强与初始时压强之比
(4)该温度下此反应的平衡常数
您最近一年使用:0次
2021-01-06更新
|
1427次组卷
|
6卷引用:广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题
广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题(已下线)2.2.2 化学平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2.2.1 化学平衡常数-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)山西运城盐湖五中2022-2023学年高二上学期阶段性测试化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考题猜想】(5大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
5 . Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(1)你认为往废水中投入_____ (填字母序号),沉淀效果最好。
A NaOH B Na2S C KI D Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ mol/L。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。回答下列问题:
已知:25℃,Ksp(AgI,黄色)=8.3×10‾17,Ksp(AgSCN,白色)= 1.0×10‾12 。
(3)步骤3中现象a是________________ 。
(4)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为__________ mol/L。
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A NaOH B Na2S C KI D Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。回答下列问题:
| 步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
(3)步骤3中现象a是
(4)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为
您最近一年使用:0次
2020-11-04更新
|
328次组卷
|
2卷引用:广东省珠海市第二中学2019-2020学年高二上学期期中考试化学试题
名校
6 . 已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K= ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为___ ;K值为___ 。
(2)830K时,若只将起始时c(H2O)改为6mol·L-1,则水蒸气的转化率为___ 。
(3)若830K时,起始加入物质为CO和H2O,起始浓度c(CO)=amol·L-1,c(H2O)=bmol·L-1,过段时间,达到平衡时H2的平衡浓度c(H2)=cmol·L-1
①a、b、c之间的关系式是___ ;
②当a=b时,a=___ c。
 CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K= ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。(1)830K时,若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为
(2)830K时,若只将起始时c(H2O)改为6mol·L-1,则水蒸气的转化率为
(3)若830K时,起始加入物质为CO和H2O,起始浓度c(CO)=amol·L-1,c(H2O)=bmol·L-1,过段时间,达到平衡时H2的平衡浓度c(H2)=cmol·L-1
①a、b、c之间的关系式是
②当a=b时,a=
您最近一年使用:0次
2020-10-20更新
|
545次组卷
|
11卷引用:广东省惠州市龙门县高级中学2023-2024学年高二上学期期中考试化学试题
广东省惠州市龙门县高级中学2023-2024学年高二上学期期中考试化学试题2014-2015河北枣强中学高二上学期期末考试化学试卷2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷北京市昌平临川育人学校2017-2018学年高二上学期期中考试化学试题吉林省梅河口市朝鲜族中学2019-2020学年高二上学期期末考试化学试题陕西省黄陵县中学2020-2021学年高二上学期期中考试化学试题(高新部)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率2.2.3化学平衡常数 课后
名校
7 . 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将23.2g
MnCl2+Cl2↑+2H2O。现将23.2g
含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应)。把反应后所得溶液稀释成200ml。计算:
(1)参加反应的MnO2的质量____ 。
(2)生成的Cl2的体积(标准状况)____ 。
(3)稀释后溶液中MnCl2的物质的量浓度____ 。
 MnCl2+Cl2↑+2H2O。现将23.2g
MnCl2+Cl2↑+2H2O。现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应)。把反应后所得溶液稀释成200ml。计算:
(1)参加反应的MnO2的质量
(2)生成的Cl2的体积(标准状况)
(3)稀释后溶液中MnCl2的物质的量浓度
您最近一年使用:0次
2020-10-17更新
|
777次组卷
|
5卷引用:广东省大埔县虎山中学2018-2019学年高一上学期期中考试化学试题
10-11高二上·河南周口·期中
8 . 向8 g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所消耗的硫酸体积为100 mL,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称___ 。
(2)计算通电后硫酸溶液的物质的量浓度____ (假设溶液体积不变)。
(1)根据计算确定金属氧化物的名称
(2)计算通电后硫酸溶液的物质的量浓度
您最近一年使用:0次
11-12高一上·辽宁抚顺·阶段练习
名校
解题方法
9 . 常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g•cm-3的混合溶液。计算:
(1)混合后溶液中溶质的质量分数为____ 。
(2)混合后溶液中溶质的物质的量浓度为___ 。
(3)在1000g水中需溶解____ molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
(1)混合后溶液中溶质的质量分数为
(2)混合后溶液中溶质的物质的量浓度为
(3)在1000g水中需溶解
您最近一年使用:0次
2020-08-31更新
|
1444次组卷
|
35卷引用:广东省仲元中学2017-2018学年高一上学期期中考试化学试题
广东省仲元中学2017-2018学年高一上学期期中考试化学试题(已下线)2011-2012学年辽宁省抚顺县高中高一9月月考理科综合试题(化学部分)(已下线)2014-2015学年云南省玉溪市一中高一上学期期中化学试卷2016-2017学年北大附中河南分校高一上第一次月考化学卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年湖南省湘潭县第一中学高一下学期第一次模块考试化学试卷河北省定州中学2017-2018学年高一上学期开学考试化学试题河南省林州市第一中学2017-2018学年高一(普通班)10月调研化学试题甘肃省武威第五中学2017-2018学年高一上学期第一次月考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高一上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一上学期11月考试化学试题河北省辛集市第一中学2017-2018学年高二上学期第三次月考化学试题江苏省南通市、盐城市六校联盟2017-2018学年高一上学期期中联考(通泰)化学试题(已下线)2018年9月7日 《每日一题》人教必修1-溶液稀释或混合的计算(已下线)2018年9月16日《每日一题》人教必修1- 每周一测(已下线)2018年10月20日 《每日一题》人教必修1 - 周末培优四川省三台中学实验学校2018-2019学年高一上学期第一次月考化学试题(已下线)第16天 溶解度、溶质质量分数和物质的量浓度之间的关系——《2019年暑假作业总动员》高一化学(已下线)2019年9月6日《每日一题》 必修1 溶液稀释或混合的计算(已下线)2019年9月15日 《每日一题》必修1 —— 每周一测2019年10月19日《每日一题》2019-2020学年高一化学人教必修1——周末培优吉林省榆树市第一高级中学2019-2020学年高一上学期期中考试化学试卷四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题(已下线)期中模拟卷(二)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)苏教版(2020)高一必修第一册专题2第二单元突破1 物质的量浓度的有关计算人教版(2019)高一必修第一册 第二章 专题2 物质的量浓度的有关计算鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 专题1 物质的量浓度的有关计算高一必修第一册(鲁科2019)第1章 章末综合检测卷甘肃省武威八中2020-2021学年高一上学期10月月考化学试题甘肃省民勤县第一中学2020-2021学年高一上学期第一次月考化学试题安徽桐城重点中学2021-2022学年高一上学期开学教学质量检测化学试题(已下线)【南昌新东方】2019 湾里一中 高一上第一次月考
11-12高一上·浙江杭州·阶段练习
名校
10 . 在标准状况下,11.2LCO和CO2的混合气体的质量为20.4g,求混合气体中CO和CO2的体积之比和质量之比________________ ?
您最近一年使用:0次
2020-02-24更新
|
251次组卷
|
9卷引用:2011-2012学年广东省龙山中学高一上学期期中考试化学试卷
(已下线)2011-2012学年广东省龙山中学高一上学期期中考试化学试卷2015-2016学年广东省阳东广雅学校高一上学期9月月考化学试卷(已下线)2011-2012年浙江省杭州市西湖高级中学高一10月考化学试卷(已下线)2012-2013学年辽宁省实验中学分校高一12月月考化学试卷2016-2017学年甘肃省会宁一中高一上期中化学试卷湖北省利川市第五中学2018-2019学年高一上学期期中模拟考试化学试题黑龙江省大庆市第一中学高中化学必修一第一章 第二节 化学计量在实验中的应用考点练习题高一必修第一册(苏教2019)专题1 第二单元 物质的化学计量甘肃省永昌县第一高级中学2020-2021学年高一上学期期中考试化学试题



