名校
1 . 向100mL含 、
、 、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
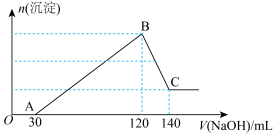
(1)写出OA段发生的离子方程式___________ ;
(2)依据表格中信息,计算滴加氢氧化钠溶液的物质的量浓度为___________ :(保留一位小数)
(3)原溶液中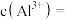
___________ ,
___________ ;
(4)将最终生成的沉淀过滤、洗涤、干燥后,放入坩埚中灼烧,得到的固体质量为4.9克。若灼烧后的固体为 ,则x的值为多少?
,则x的值为多少?___________ (无计算过程不给分)。
 、
、 、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
(1)写出OA段发生的离子方程式
(2)依据表格中信息,计算滴加氢氧化钠溶液的物质的量浓度为
| 分子式:NaOH 相对分子质量:40 密度:  NaOH的质量分数:16.7% |
(3)原溶液中
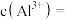

(4)将最终生成的沉淀过滤、洗涤、干燥后,放入坩埚中灼烧,得到的固体质量为4.9克。若灼烧后的固体为
 ,则x的值为多少?
,则x的值为多少?
您最近一年使用:0次
2 . 把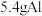 放入
放入 足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:
足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:
(1)生成氢气在标准状况下的体积______________ 。
(2)反应后溶液中四羟基合铝酸钠的物质的量浓度______________ 。
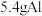 放入
放入 足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:
足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:(1)生成氢气在标准状况下的体积
(2)反应后溶液中四羟基合铝酸钠的物质的量浓度
您最近一年使用:0次
名校
3 . 20℃时,将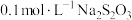 溶液与
溶液与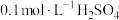 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: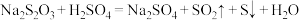 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?_______
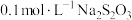 溶液与
溶液与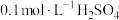 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: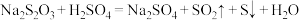 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
您最近一年使用:0次
2022-11-25更新
|
457次组卷
|
3卷引用:四川省江油中学2022-2023学年高一下学期期中考试化学试题
名校
4 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
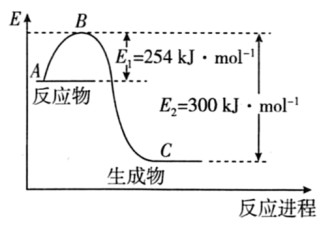
(1)如图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶___________
(2)若已知下列数据∶
试根据表中及图中数据计算N-H的键能∶___________ kJ·mol-1
(3)用 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知:
 ①
①
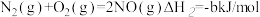 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3___________ kJ/mol(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I: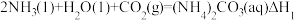
反应II: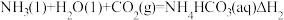
反应Ⅲ: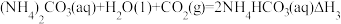
则△H3与△H1、△H2之间的关系是△H3=___________ 。
(1)如图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶
(2)若已知下列数据∶
| 化学键 | H-H | N=N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能∶
(3)用
 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知: ①
①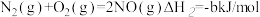 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:
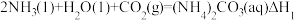
反应II:
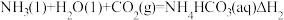
反应Ⅲ:
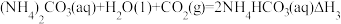
则△H3与△H1、△H2之间的关系是△H3=
您最近一年使用:0次
2021-06-20更新
|
1309次组卷
|
7卷引用:四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题
四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
解题方法
5 . 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=_______ mol/L
(2)前5min内用B表示的平均反应速率v(B)=_______ mol/(L·min);
(3)化学反应方程式中x的值为_______ 。
(1)此时A的浓度c(A)=
(2)前5min内用B表示的平均反应速率v(B)=
(3)化学反应方程式中x的值为
您最近一年使用:0次
名校
解题方法
6 . (1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:_______ 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+ O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=_______ kJ/mol。氢气的燃烧热为_______ kJ/mol。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为_______ 。
 O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为
您最近一年使用:0次
解题方法
7 . 化学家研制出了一种复杂的铁氧化物(FexOy),取该氧化物76.0 g溶于600 mL 2.5 mol/L稀硫酸中,得到溶液X。向溶液X中加入一定体积4.0 mol/L NaOH溶液,恰好使溶液中的金属离子沉淀完全。过滤、洗涤,将沉淀加热至质量不再变化,得残渣80.0g。
回答下列问题:
(1)加热沉淀时发生反应的化学方程式为_______ ,所得残渣的颜色为_______ 。
(2)铁氧化物(FexOy)的化学式为_______ ,所加NaOH溶液的体积为_______ mL。
(3)向溶液X中加入足量铁粉制备绿矾(化学式为FeSO4·7H2O,相对分子质量278),不考虑产品损失,最多能够制备多少克绿矾?______ (无解题过程不给分)
回答下列问题:
(1)加热沉淀时发生反应的化学方程式为
(2)铁氧化物(FexOy)的化学式为
(3)向溶液X中加入足量铁粉制备绿矾(化学式为FeSO4·7H2O,相对分子质量278),不考虑产品损失,最多能够制备多少克绿矾?
您最近一年使用:0次
解题方法
8 . (1)化合物A分子组成可用OxFy表示。30mLA气体在一定条件下能分解生成15mLO2和30mLF2(在同温同压下),A的化学式是__________ 。
(2)1.5mol CH3COOH所含氧原子数跟________ g H2O所含氧原子数相等。
(3)实验室现有Fe2(SO4)3溶液100mL, 的物质的量浓度为0.45 mol·L-1,则Fe3+的物质的量浓度为
的物质的量浓度为0.45 mol·L-1,则Fe3+的物质的量浓度为_________ mol·L-1,含有Fe2(SO4)3 的质量为________ g。
(4)N2和CH4的混合气体11g,在标准状况下的体积为11.2L,则混合气体的平均摩尔质量为________ ,混合气体中CH4的电子数为________ 。
(2)1.5mol CH3COOH所含氧原子数跟
(3)实验室现有Fe2(SO4)3溶液100mL,
 的物质的量浓度为0.45 mol·L-1,则Fe3+的物质的量浓度为
的物质的量浓度为0.45 mol·L-1,则Fe3+的物质的量浓度为(4)N2和CH4的混合气体11g,在标准状况下的体积为11.2L,则混合气体的平均摩尔质量为
您最近一年使用:0次
2020-10-15更新
|
257次组卷
|
2卷引用:四川省合江县马街中学校2023-2024学年高一上学期12月月考化学试题
解题方法
9 . 把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g) nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2min内,用X表示的平均反应速率________ ;
(2)2min末时Y的转化率_______ ;
(3)化学方程式中Z的化学计量数n=______ 。
 nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:(1)前2min内,用X表示的平均反应速率
(2)2min末时Y的转化率
(3)化学方程式中Z的化学计量数n=
您最近一年使用:0次
2020-10-15更新
|
507次组卷
|
12卷引用:2014-2015学年四川省资阳市高一下学期期末质量检测化学试卷
2014-2015学年四川省资阳市高一下学期期末质量检测化学试卷甘肃省镇原县二中2018-2019学年高二上学期期末考试化学试题新疆昌吉回族自治州玛纳斯县第一中学2018-2019学年高二上学期第一次月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)课时1 化学反应的快慢——A学习区 夯实基础(鲁科版(2019)第二册)课时1 化学反应的快慢——A学习区 夯实基础(鲁科版必修2)黑龙江省海林市朝鲜族中学2019-2020学年高一下学期期末考试化学试题必修第二册RJ第6章第二节 化学反应的速率与限度 课时1黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题黑龙江省绥化市青冈县第一中学2020-2021学年高二上学期10月月考(筑梦班)化学试题(已下线)第13讲 化学反应速率(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
名校
解题方法
10 . (1)已知常温下, 乙醇
乙醇 和一定量的氧气混合后点燃,恰好完全燃烧,放出
和一定量的氧气混合后点燃,恰好完全燃烧,放出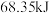 热量,则该反应的热化学方程式为
热量,则该反应的热化学方程式为________ 。
(2)已知:
硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为
 ,该反应的反应热为
,该反应的反应热为________  。
。
(3)已知水的比热容为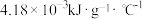 。
。 硫黄在
硫黄在 中完全燃烧生成气态
中完全燃烧生成气态 时放出的热量能使
时放出的热量能使 的温度由18℃升高至62.4℃,则硫黄的燃烧热为
的温度由18℃升高至62.4℃,则硫黄的燃烧热为________ (保留三位有效数字),热化学方程式为________ 。
 乙醇
乙醇 和一定量的氧气混合后点燃,恰好完全燃烧,放出
和一定量的氧气混合后点燃,恰好完全燃烧,放出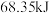 热量,则该反应的热化学方程式为
热量,则该反应的热化学方程式为(2)已知:
| 化学键 |  |  |  |  |
键能/ | 360 | 436 | 431 | 176 |
硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为
 ,该反应的反应热为
,该反应的反应热为 。
。(3)已知水的比热容为
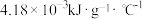 。
。 硫黄在
硫黄在 中完全燃烧生成气态
中完全燃烧生成气态 时放出的热量能使
时放出的热量能使 的温度由18℃升高至62.4℃,则硫黄的燃烧热为
的温度由18℃升高至62.4℃,则硫黄的燃烧热为
您最近一年使用:0次
2020-09-19更新
|
295次组卷
|
2卷引用:四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(基础卷)



