1 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。
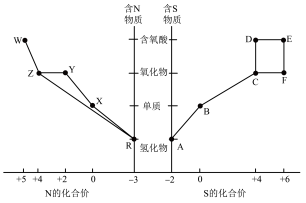
回答下列问题:
(1)写出物质R的电子式___________ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是___________ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是___________ 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 中所含化学键类型为
中所含化学键类型为___________ , 水溶液显
水溶液显___________ (填“酸性”、“碱性”或“中性”)。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: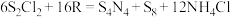 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有___________ ,该反应每生成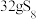 转移电子
转移电子___________ mol。

回答下列问题:
(1)写出物质R的电子式
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与
 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 中所含化学键类型为
中所含化学键类型为 水溶液显
水溶液显(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: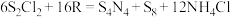 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有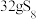 转移电子
转移电子
您最近一年使用:0次
解题方法
2 . 如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
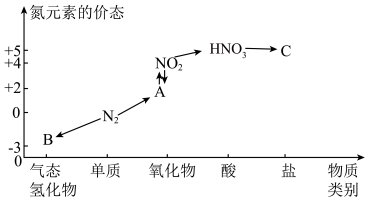
(1)B的电子式为___________ , 的用途为
的用途为___________ (写出一条即可)。
(2) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为___________ 。
(3)浓硝酸与木炭在加热条件下反应的化学方程式为___________ 。
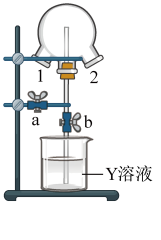
(4)如图装置可用于探究氯气与氨气的反应。实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气。实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为___________ ,请设计一个实验方案鉴定该固体中的阳离子___________ 。
(5)标准状况下,若在烧瓶中充满混有空气的氨气,倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度为___________ mol/L。

(1)B的电子式为
 的用途为
的用途为(2)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为(3)浓硝酸与木炭在加热条件下反应的化学方程式为
(4)如图装置可用于探究氯气与氨气的反应。实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气。实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为

(5)标准状况下,若在烧瓶中充满混有空气的氨气,倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度为
您最近一年使用:0次
3 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。

回答下列问题:
(1)写出物质R的电子式。_______ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是_______ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将 的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是_______ 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 晶体中所含化学键的类型有
晶体中所含化学键的类型有_______ ,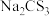 水溶液显
水溶液显_______ (填“酸性”、“碱性”或“中性”)。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: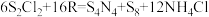 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有_______ ,该反应每生成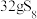 转移电子
转移电子_______  。其中被氧化的元素是
。其中被氧化的元素是_______ (填元素符号)。

回答下列问题:
(1)写出物质R的电子式。
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与
 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将
 的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 晶体中所含化学键的类型有
晶体中所含化学键的类型有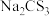 水溶液显
水溶液显(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: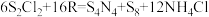 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有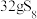 转移电子
转移电子 。其中被氧化的元素是
。其中被氧化的元素是
您最近一年使用:0次
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:___________ 性。
(2)从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应:___________
________Na2S+________Na2SO3+________H2SO4=________Na2SO4+________S↓+________H2O
(5)如图是验证SO2性质的实验装置。___________ (填序号,下同);B中___________ ;C中___________ 。
②D装置的作用是___________ 。

(2)从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应:
________Na2S+________Na2SO3+________H2SO4=________Na2SO4+________S↓+________H2O
(5)如图是验证SO2性质的实验装置。
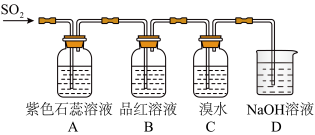
②D装置的作用是
您最近一年使用:0次
2022-12-21更新
|
234次组卷
|
2卷引用:湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题
5 . Ⅰ.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________ 。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H+ + OH﹣= H2O外,还有:_____________________________ 、________________________________ ;
(3)步骤③中加入(或通入)的过量试剂b的结构式是______________ 。
Ⅱ. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(4)从硫元素化合价的角度分析,图中只具有还原性的化合物有______________ (填化学式)。
(5)将X与Y混合,可生成淡黄色固体,该反应的化学方程式为_________________________ 。
(6)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______ (填代号).
a.Na2S + S b.SO2 + Na2SO4 c.Na2SO3 + S d.Na2SO3 + Na2SO4

(1)沉淀A的成分是(填化学式)
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H+ + OH﹣= H2O外,还有:
(3)步骤③中加入(或通入)的过量试剂b的结构式是
Ⅱ. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(4)从硫元素化合价的角度分析,图中只具有还原性的化合物有
(5)将X与Y混合,可生成淡黄色固体,该反应的化学方程式为
(6)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S + S b.SO2 + Na2SO4 c.Na2SO3 + S d.Na2SO3 + Na2SO4
您最近一年使用:0次
2020-09-15更新
|
69次组卷
|
2卷引用:湖北省新高考联考协作体2020-2021学年高二上学期开学联考化学试题
解题方法
6 . 对碳的氧化物和氮的氧化物的无害化处理是人类面临的一个重大课题。回答下列问题:
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =___________ kJ·mol-1,若反应III的正反应的活化能为Ea kJ·mol-1 ,则其逆反应的活化能为___________ kJ·mol-1。
②在某容积为2.00L的密闭容器中按照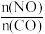 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
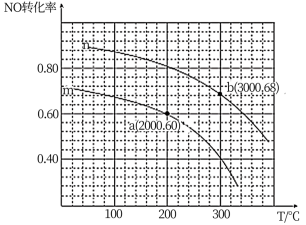
曲线n所代表的压强___________ (填“ >”或“<”)曲线m所代表的压强。测得a点对于反应容器体系中c(CO)=0.10 mol ·L-1,则该条件下容器体系中n(NO) =___________ mol,该温度下平衡常数K=___________ 。
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
则ΔH___________ (填“>”或“<”)0,写出提高CO2的平衡转化率的措施有______ (写出1条即可),测得250℃时,平衡体系压强为1.0 ×106 Pa,则平衡常数Kp=______ 。
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =
②在某容积为2.00L的密闭容器中按照
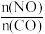 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
曲线n所代表的压强
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:| T/℃ | 100 | 150 | 200 | 250 | 300 | 350 |
| 转化率/% | 0.64 | 0.58 | 0.53 | 0.50 | 0.48 | 0.47 |
您最近一年使用:0次
7 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g)ΔH。若:N
N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=____________ (用含(a、b、c的代数式表示)kJ•mol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是____________ (填写催化剂的化学式)。
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g)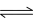 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=____________ 。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是____________ (填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。

①Pt—C3N4,电极上产生NH3的电极反应式为____________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:____________ 。
(1)氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g)ΔH。若:N
N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=(3)关于合成氨工艺的理解,下列说法不正确的是
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。

①Pt—C3N4,电极上产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:
您最近一年使用:0次
8 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。

回答下列问题:
(1)X的电离方程式为___ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=___ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y的化学式为___ ;Y在400℃时分解只生成两种盐。其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别___ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为___ ,其中氧化剂与还原剂的物质的量之比为___ 。

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y的化学式为
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近一年使用:0次
9-10高一下·湖北·阶段练习
9 . 某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
(2)实验② 。
(3)实验③
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭。 |
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A~F) |
(3)实验③
您最近一年使用:0次
名校
解题方法
10 . 材料是经济增长与社会发展的重要物质基础,请回答下列问题。
(1)硅是重要的半导体材料,广泛应用于电子产品领域,工业上以硅石 为原料制备冶金级高纯硅的工艺流程如图所示:
为原料制备冶金级高纯硅的工艺流程如图所示: 室温下为易挥发、易水解的无色液体。
室温下为易挥发、易水解的无色液体。
①写出上述过程中氧化过程的化学方程式:___________ ;
② 极易水解且生成某种可燃性气体,写出化学反应方程式:
极易水解且生成某种可燃性气体,写出化学反应方程式:___________ ;
③上述工艺生产中需要在无水、无氧的条件下进行的操作有:___________ 。
(2)某MOFs多孔材料能高选择性吸附 ,其孔径大小和形状恰好将
,其孔径大小和形状恰好将 “固定”。废气中的
“固定”。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为 。原理示意图如下。
。原理示意图如下。
①写出反应中转化为 的化学反应方程式
的化学反应方程式___________ ;
②每生成 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为___________ 。
(3)甲醇是重要的化工原料之一,其制备和用途研究一直是化学工业热门研究方向。
工业上利用 和
和 合成甲醇,反应方程式为
合成甲醇,反应方程式为 ,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入
,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入 和
和 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如图所示。
浓度随时间变化如图所示。 和
和 充分反应后,放出的能量
充分反应后,放出的能量___________ (填“>”“<”或“=”)89kJ;
②从0到10min,
___________ ;
③达到平衡时 的体积分数
的体积分数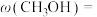
___________ 。
(1)硅是重要的半导体材料,广泛应用于电子产品领域,工业上以硅石
 为原料制备冶金级高纯硅的工艺流程如图所示:
为原料制备冶金级高纯硅的工艺流程如图所示: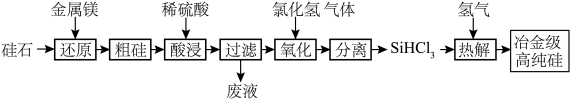
 室温下为易挥发、易水解的无色液体。
室温下为易挥发、易水解的无色液体。①写出上述过程中氧化过程的化学方程式:
②
 极易水解且生成某种可燃性气体,写出化学反应方程式:
极易水解且生成某种可燃性气体,写出化学反应方程式:③上述工艺生产中需要在无水、无氧的条件下进行的操作有:
(2)某MOFs多孔材料能高选择性吸附
 ,其孔径大小和形状恰好将
,其孔径大小和形状恰好将 “固定”。废气中的
“固定”。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为 。原理示意图如下。
。原理示意图如下。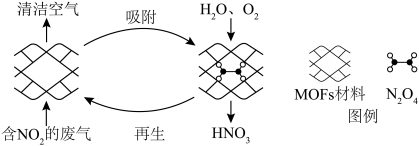

①写出反应中转化为
 的化学反应方程式
的化学反应方程式②每生成
 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为(3)甲醇是重要的化工原料之一,其制备和用途研究一直是化学工业热门研究方向。
工业上利用
 和
和 合成甲醇,反应方程式为
合成甲醇,反应方程式为 ,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入
,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入 和
和 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如图所示。
浓度随时间变化如图所示。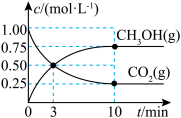
 和
和 充分反应后,放出的能量
充分反应后,放出的能量②从0到10min,

③达到平衡时
 的体积分数
的体积分数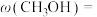
您最近一年使用:0次



