名校
解题方法
1 . 合成氨是人工固氮比较成熟的技术,在工业上有重要的用途。
(1)已知化学键的键能如下表,则
___________ 。
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是___________ 。
①体系压强保持不变
②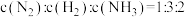
③每消耗 ,有
,有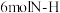 键发生断裂
键发生断裂
④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥
(3)合成氨反应的平衡常数与温度的对应关系如下表:
试解释平衡常数随温度的升高而减小的原因___________ 。工业上合成氨一般以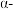 铁触媒为催化剂,
铁触媒为催化剂,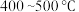 条件下反应,选取该反应温度而非室温或更高温度的原因是
条件下反应,选取该反应温度而非室温或更高温度的原因是___________ 。
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的 与
与 后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲___________ 乙(填“>”、“<”或“=”)。反应达平衡后向甲容器中再充入一定量的 ,则甲容器中
,则甲容器中 的转化率
的转化率___________ (填“增大”、“减小”或“不变”)。
(5)肼 又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为
又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为___________ 。

(1)已知化学键的键能如下表,则

| 化学键 |  |  |  |  |
键能/ | 435.9 | 946.5 | 391.1 | 192.8 |
①体系压强保持不变
②
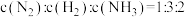
③每消耗
 ,有
,有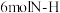 键发生断裂
键发生断裂④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥

(3)合成氨反应的平衡常数与温度的对应关系如下表:
温度( ) ) | 25 | 400 | 450 |
| 平衡常数 | 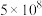 | 0.507 | 0.152 |
 铁触媒为催化剂,
铁触媒为催化剂,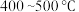 条件下反应,选取该反应温度而非室温或更高温度的原因是
条件下反应,选取该反应温度而非室温或更高温度的原因是(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的
 与
与 后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲 ,则甲容器中
,则甲容器中 的转化率
的转化率(5)肼
 又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为
又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为
您最近一年使用:0次
名校
2 . I.某同学通过查阅资料得知,常温下 和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取
和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取 并探究其有关性质:
并探究其有关性质:

(1)装置A中存在一处错误,改正这处错误:_______ 。有同学认为,上述装置还有另外一处的缺陷,并给出了改进措施。该改进措施是_______ 。
(2)配平装置A中发生反应的化学方程式: _______
_______ _______
_______ _______
_______ _______
_______
_______ 。
(3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入_______ (填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为_______ (填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
II.利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题:
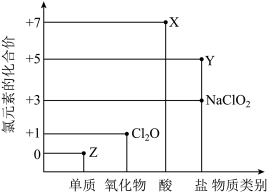
(4)X的电离方程式为_______ 。
(5)Y可用于实验室制 ,其焰色试验为紫色,则Y含有的化学键类型为
,其焰色试验为紫色,则Y含有的化学键类型为_______ ;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,生成的两种盐的化学式分别为_______ 。
 和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取
和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取 并探究其有关性质:
并探究其有关性质:
(1)装置A中存在一处错误,改正这处错误:
(2)配平装置A中发生反应的化学方程式:
 _______
_______ _______
_______ _______
_______ _______
_______
(3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
II.利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题:

(4)X的电离方程式为
(5)Y可用于实验室制
 ,其焰色试验为紫色,则Y含有的化学键类型为
,其焰色试验为紫色,则Y含有的化学键类型为
您最近一年使用:0次
2023-03-28更新
|
286次组卷
|
3卷引用:天津市新华中学2022-2023学年高一上学期期末考试化学试题
天津市新华中学2022-2023学年高一上学期期末考试化学试题(已下线)专题05 氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)天津市第五十四中学2023-2024学年高一上学期期末化学试卷
解题方法
3 . 合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如表:
常温下,大气固氮的倾向____ 工业固氮(填“大于”或“小于”)。
(2)N2(g)与H2(g)反应的能量变化如图所示。
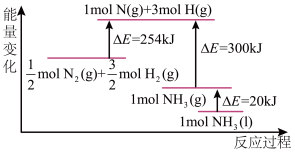
则N2(g)与H2(g)制备NH3(l)的热化学方程式为_____ 。
(3)T℃时,在2L恒容密闭容器中加入1molN2和2molH2模拟一定条件下工业固氮N2(g)+3H2(g) 2NH3(g),体系中n(NH3)随时间的变化如图。
2NH3(g),体系中n(NH3)随时间的变化如图。
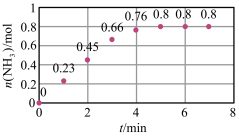
①前2分钟内的平均反应速率v(NH3)=____ mol•L-1•min-1。
②下列情况能说明该反应已达到平衡状态的是____ (选填序号)。
A.混合气体的密度不变
B.单位时间内断裂nmolN-H键的同时形成nmolH-H键
C.3v正(H2)=2v逆(NH3)
D.容器内的总压强不再变化
③有关工业固氮的说法正确的是____ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.温度控制在500℃左右有利于反应向正方向进行
C.循环使用N2、H2可提高NH3的产率
D.增大压强有利于加快反应速率,所以压强越大越好
④T℃时,该反应的平衡常数为_____ 。
⑤若800℃,该反应的平衡常数为2,在该温度下,某时刻,N2、H2、NH3的浓度都2mol/L时,则v正_____ v逆(填“>”、“<”、“=”)。
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol•min-1)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最小的催化剂是____ (填化学式)。
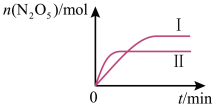
(5)在恒容密闭容器中充入2molNO2和1molO2发生反应如下:4NO2(g)(红棕色)+O2(g) 2N2O5(g)(无色)。已知在不同温度下测得N2O5的物质的量随时间的变化如图所示。该反应的△H
2N2O5(g)(无色)。已知在不同温度下测得N2O5的物质的量随时间的变化如图所示。该反应的△H____ 0,△S____ 0。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如表:
| 反应 | 大气固氮N2(g)+O2(g) 2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g) 2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数(K) | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
常温下,大气固氮的倾向
(2)N2(g)与H2(g)反应的能量变化如图所示。

则N2(g)与H2(g)制备NH3(l)的热化学方程式为
(3)T℃时,在2L恒容密闭容器中加入1molN2和2molH2模拟一定条件下工业固氮N2(g)+3H2(g)
 2NH3(g),体系中n(NH3)随时间的变化如图。
2NH3(g),体系中n(NH3)随时间的变化如图。 
①前2分钟内的平均反应速率v(NH3)=
②下列情况能说明该反应已达到平衡状态的是
A.混合气体的密度不变
B.单位时间内断裂nmolN-H键的同时形成nmolH-H键
C.3v正(H2)=2v逆(NH3)
D.容器内的总压强不再变化
③有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.温度控制在500℃左右有利于反应向正方向进行
C.循环使用N2、H2可提高NH3的产率
D.增大压强有利于加快反应速率,所以压强越大越好
④T℃时,该反应的平衡常数为
⑤若800℃,该反应的平衡常数为2,在该温度下,某时刻,N2、H2、NH3的浓度都2mol/L时,则v正
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol•min-1)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
在不同催化剂的催化作用下,氨气分解反应中的活化能最小的催化剂是
(5)在恒容密闭容器中充入2molNO2和1molO2发生反应如下:4NO2(g)(红棕色)+O2(g)
 2N2O5(g)(无色)。已知在不同温度下测得N2O5的物质的量随时间的变化如图所示。该反应的△H
2N2O5(g)(无色)。已知在不同温度下测得N2O5的物质的量随时间的变化如图所示。该反应的△H
您最近一年使用:0次
名校
4 . Ⅰ.如图是氮元素的各种价态与物质类别的对应关系:
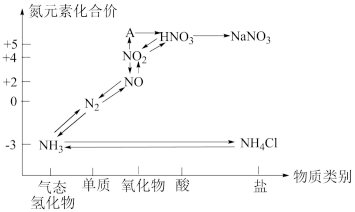
(1)根据A对应的化合价和物质类别,A为___________ (写分子式,下同),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)浓、稀HNO3的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式:___________ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅱ.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。(固定装置已略去)
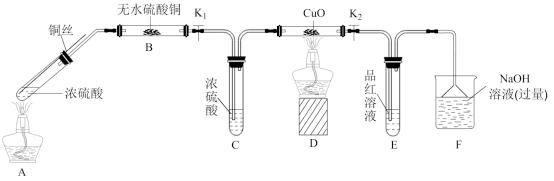
(1)B装置中的现象是___________ 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是___________ 。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是___________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀HNO3的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
Ⅱ.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。(固定装置已略去)

(1)B装置中的现象是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
您最近一年使用:0次
5 . 锰的化合物用途与性质的探究,有关物质及颜色: (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:
Ⅰ.用 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
(1)操作Ⅰ为______ ,操作Ⅱ为______ 。
(2)无色液体A是______ ,.定性检验A的试剂是______ ,现象是____________ 。
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程____________ 。
Ⅱ.探究 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略): 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
实验ⅱ:物质a为40% KOH溶液,C中通入 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。
(4)通入 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为____________ 。
(5) 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是____________ 。
(6)浓碱条件下, 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为____________ 。
(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因____________ 。
 (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:Ⅰ.用
 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。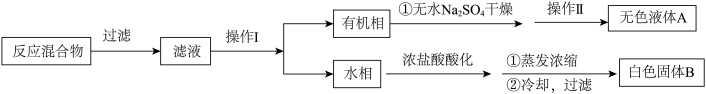
(1)操作Ⅰ为
(2)无色液体A是
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程
Ⅱ.探究
 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略):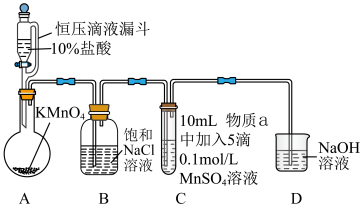
 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。实验ⅱ:物质a为40% KOH溶液,C中通入
 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。(4)通入
 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为(5)
 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是(6)浓碱条件下,
 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.有机物的种类繁多,在日常生活中有重要的用途,回答下列问题:
(1)键线式 表示的分子式
表示的分子式______ ;系统命名法名称是______ 。
(2) 中含有的官能团的名称为
中含有的官能团的名称为______ 。
(3)顺丁橡胶是以1,3-丁二烯为原料,在催化剂作用下发生加聚反应得到的以顺式结构为主的聚合物,请写出该反应的化学方程式______ 。
(4)已知:苯的同系物中,与苯环直接相连的碳原子上有氢原子,就能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下: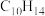 ,回答下列问题。
,回答下列问题。
①甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是______ 。
②乙的苯环上的一溴代物只有一种,且核磁共振氢谱只有2组峰,请写出其结构简式______ 。
已知:①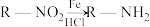
以下是用苯做原料制备某些化合物的转化关系图:______ 。
(6)在“
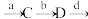
 ”的所有反应中属于取代反应的是
”的所有反应中属于取代反应的是______ (填字母)。
(1)键线式
 表示的分子式
表示的分子式(2)
 中含有的官能团的名称为
中含有的官能团的名称为(3)顺丁橡胶是以1,3-丁二烯为原料,在催化剂作用下发生加聚反应得到的以顺式结构为主的聚合物,请写出该反应的化学方程式
(4)已知:苯的同系物中,与苯环直接相连的碳原子上有氢原子,就能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:

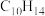 ,回答下列问题。
,回答下列问题。①甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是
②乙的苯环上的一溴代物只有一种,且核磁共振氢谱只有2组峰,请写出其结构简式
已知:①
②
以下是用苯做原料制备某些化合物的转化关系图:

(6)在“

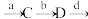
 ”的所有反应中属于取代反应的是
”的所有反应中属于取代反应的是
您最近一年使用:0次
7 . 含氮化合物在工农业有着重要的用途。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为____________ 。
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→_________ (按气流方向,用小写字母表示)。
(3)请写出氨气的检验方法:________________ 。
Ⅱ. 经一系列反应可以得到
经一系列反应可以得到 。
。
(4)①中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是____________ 。
(5)NO的检验方法是:______________ 。
Ⅲ.研究、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。
(6)选择性催化还原技术(SCR)可使NOx与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:___________ 。
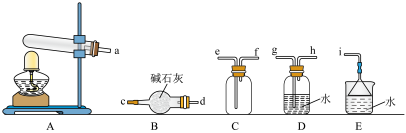
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→
(3)请写出氨气的检验方法:
Ⅱ.
 经一系列反应可以得到
经一系列反应可以得到 。
。
(4)①中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是(5)NO的检验方法是:
Ⅲ.研究、
 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。(6)选择性催化还原技术(SCR)可使NOx与
 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:
您最近一年使用:0次
8 . 实验室制备 并对其进行性质探究
并对其进行性质探究
I.制备 (无水
(无水 易潮解,加热易升华)
易潮解,加热易升华)
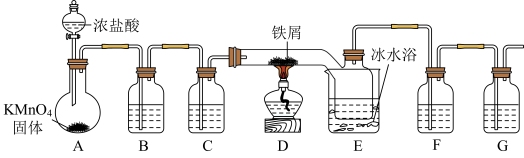
(1)A为氯气发生装置,A中的反应方程式是_______ (锰被还原为 )。
)。
(2)B中试剂的用途是_______ ;C中试剂是_______ ;F中的试剂是_______ 。
II.探究性质
将制得FeCl3的配成0.1molFeCl3溶液,进行实验ii和实验iii。
(3)实验ii:将酸化的5mL0.1mol/L 溶液与2mL0.1mol/L
溶液与2mL0.1mol/L 溶液混合,得到红色溶液(
溶液混合,得到红色溶液( 与
与 可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是
可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是_______ 。
(4)结合化学方程式,解释a中的实验现象_______ 。
(5)对b的现象进行探究。推测灼烧时,导出的气体是_______ 。
(6)将c黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由是_______ 。
 并对其进行性质探究
并对其进行性质探究I.制备
 (无水
(无水 易潮解,加热易升华)
易潮解,加热易升华)
(1)A为氯气发生装置,A中的反应方程式是
 )。
)。(2)B中试剂的用途是
II.探究性质
将制得FeCl3的配成0.1molFeCl3溶液,进行实验ii和实验iii。
(3)实验ii:将酸化的5mL0.1mol/L
 溶液与2mL0.1mol/L
溶液与2mL0.1mol/L 溶液混合,得到红色溶液(
溶液混合,得到红色溶液( 与
与 可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是
可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是| 实验ⅲ | 操作 | 序号 | 现象 |
 | a | 蒸发时,试管内有白雾 | |
| b | 灼烧时,导出的气体可以使NaBr溶液变黄 | ||
| c | 最终,试管底部留有黑色固体 |
(4)结合化学方程式,解释a中的实验现象
(5)对b的现象进行探究。推测灼烧时,导出的气体是
(6)将c黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由是
您最近一年使用:0次
解题方法
9 . 现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间的转化关系如图所示(部分产物和反应条件省略).

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B______ 、丙______ .
(2)写出下列反应的离子方程式:
反应①______ ;
反应④______ .
(3)黄绿色气体乙的用途______ (列举一例即可)

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B
(2)写出下列反应的离子方程式:
反应①
反应④
(3)黄绿色气体乙的用途
您最近一年使用:0次
10 . 四氧化三铁( )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
(1) 能和稀硫酸反应,生成的两种盐是
能和稀硫酸反应,生成的两种盐是___________ 。验证反应后溶液中含有 的最恰当的试剂是
的最恰当的试剂是___________ 。
A.氯水 B.酸性 溶液 C.KSCN溶液 D.NaOH溶液
溶液 C.KSCN溶液 D.NaOH溶液
(2)铁粉在氧气中燃烧是制取 最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。___________ 。(从下图①、②、③中选择)
②在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作,___________ ,向分液漏斗中加足量水,塞紧玻璃塞,打开玻璃旋塞,过一会儿,水不再下滴,说明装置①的气密性良好。如果把分液漏斗改成恒压滴液漏斗,___________ (填“是”或“否”)可以用上述步骤检验装置的气密性?
③写出B装置中反应的化学方程式___________ 。
(3)氧化沉淀法也是制取 的一种常见方法,其制取流程如下图所示,
的一种常见方法,其制取流程如下图所示,___________ (填写化学式),由溶液N获得该副产品的操作是:加热浓缩→___________ →过滤洗涤→晶体加热至完全失去结晶水。
(4)某兴趣小组模仿上述流程制取 并测定其产率、具体操作如下:
并测定其产率、具体操作如下:
I.测定绿矾的含量:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为
溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为___________ 。
Ⅱ.称取300g工业绿矾,通过上述流程最终制得:50g 计算产品
计算产品 的产率为
的产率为___________ 。(保留4位有效数字)
 )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。(1)
 能和稀硫酸反应,生成的两种盐是
能和稀硫酸反应,生成的两种盐是 的最恰当的试剂是
的最恰当的试剂是A.氯水 B.酸性
 溶液 C.KSCN溶液 D.NaOH溶液
溶液 C.KSCN溶液 D.NaOH溶液(2)铁粉在氧气中燃烧是制取
 最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。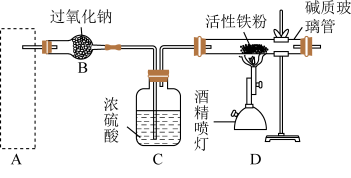
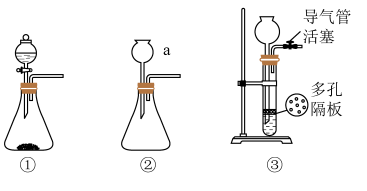
②在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作,
③写出B装置中反应的化学方程式
(3)氧化沉淀法也是制取
 的一种常见方法,其制取流程如下图所示,
的一种常见方法,其制取流程如下图所示,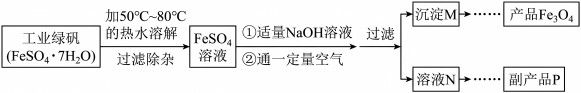
(4)某兴趣小组模仿上述流程制取
 并测定其产率、具体操作如下:
并测定其产率、具体操作如下:I.测定绿矾的含量:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000
 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为
溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为Ⅱ.称取300g工业绿矾,通过上述流程最终制得:50g
 计算产品
计算产品 的产率为
的产率为
您最近一年使用:0次



