湖北省2020-2021学年高二上学期期末质量检测化学试题
湖北
高二
期末
2021-02-06
407次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质
湖北省2020-2021学年高二上学期期末质量检测化学试题
湖北
高二
期末
2021-02-06
407次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
2. 下列叙述不涉及盐类水解的是
| A.应用热的纯碱除去厨具上的油污 |
| B.在配制的FeSO4溶液中滴少入量稀硫酸 |
| C.在HCl气氛中加热蒸干AlCl3溶液制备无水AlCl3 |
| D.应用含Na2PO3F的牙膏防治龋齿 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
4. 从海水中提取溴的过程中,常用饱和纯碱溶液吸收粗溴:3Br2 + 3Na2CO3=NaBrO3+ 5NaBr +3CO2↑。在该反应中,氧化剂、还原剂的质量之比为
| A.1:1 | B.1 :2 | C.5:1 | D.1 :5 |
【知识点】 与氧化剂、还原剂有关的计算解读
您最近一年使用:0次
单选题
|
较易(0.85)
5. 反应2H2O2=2H2O+O2↑和N2 +O2 2NO的能量变化如图所示。
2NO的能量变化如图所示。

下列说法错误的是
 2NO的能量变化如图所示。
2NO的能量变化如图所示。
下列说法错误的是
| A.双氧水分解的反应是放热反应 | B.分解反应一定是吸热反应 |
| C.氮气与氧气的反应是吸热反应 | D.上述反应都是氧化还原反应 |
【知识点】 化学反应中能量变化的原因
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 短周期主族元素X、Y 、Z、W的原子序数依次递增,基态X原子的最高能级的单电子数是3,X、Y形成的化合物较多,其中一种化合物为红棕色气体;Z、W均为金属元素,其中基态Z原子最高能层与最低能层的电子数之和是L层电子数的一半。下列说法正确的是
| A.原子半径:W >Z>Y>X | B.第一电离能:W >Z |
| C.简单氢化物的沸点:Y >X | D.W、Y形成的化合物是碱性氧化物 |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
2021-02-04更新
|
183次组卷
|
4卷引用:湖北省2020-2021学年高二上学期期末质量检测化学试题
湖北省2020-2021学年高二上学期期末质量检测化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)宁夏银川市贺兰县景博高中2020-2021学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
7. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是


| A.利用甲装置制备Fe(OH)2白色沉淀 |
| B.利用乙装置测定生成氢气的速率 |
| C.利用丙装置探究温度对化学平衡的影响 |
| D.利用丁装置设计反应为Cu+2Ag+ =Cu2+ + 2Ag的原电池 |
您最近一年使用:0次
单选题
|
适中(0.65)
8. 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.常温下,1.0 L pH=1的稀盐酸中由水电离出的H+数为0.1 NA |
| B.7.1 g Cl2完全被石灰水的浑浊液吸收,转移的电子数为0.1NA |
| C.11.2 L CO和N2的混合气体中,含原子数为NA |
D.500 mL1.0 mol·L-1的NaNO2溶液中,NO 数为0.5 NA 数为0.5 NA |
您最近一年使用:0次
二、多选题 添加题型下试题
多选题
|
适中(0.65)
解题方法
9. 下列离子方程式能够正确地描述相应事实的是
A.硫酸铜溶液呈弱酸性:Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
B.在Na2SO3溶液中滴入足量稀硝酸:3SO +2NO +2NO +2H+=3SO +2H+=3SO +2NO↑+H2O +2NO↑+H2O |
| C.在漂白粉溶液中通入过量CO2:Ca2+ +2ClO- +CO2 +H2O= CaCO3↓+ 2HClO |
D.AlCl3溶液中通入过量NH3:Al3+ +4NH + 2H2O=AlO + 2H2O=AlO +4NH +4NH |
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
10. 工业上常用浓氨水来检验氯气管道是否漏气,其反应的化学方程式:8NH3+3Cl2=N2+6NH4Cl。下列有关说法正确的是
| A.N的电负性比同周期的O、F都大。 |
| B.N最高能层上的电子数与Cl最高能级上的电子数之比为5 :7 |
| C.该反应中NH3既作还原剂又起到碱的作用 |
| D.NH4Cl中存在非极性共价键和离子键 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
11. 下列实验操作错误或不能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 配制240mL0.1mol·L-1NaOH溶液 | 称取1.0gNaOH,经溶解(冷却)、转移、洗涤、定容等操作,然后取240mL配好的溶液 |
| B | 干燥试管、烧杯、量筒等玻璃仪器 | 将试管、烧杯、量筒等玻璃仪器洗涤后放入烤箱中使其干燥 |
| C | 除去溴苯中的少量溴 | 加入适量NaOH溶液,振荡、静置、分液 |
| D | 检验淀粉是否水解完全 | 在水解液中滴加碘水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
12. 已知:(SCN)2性质与卤素单质类似,其氧化性介于Br2和I2之间。将等体积等浓度的稀FeCl3溶液和稀KSCN溶液混合,发生反应:Fe3+ +3SCN-  Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是
Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是
 Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是
Fe( SCN)3 ,得到浅红色的溶液。下列有关说法错误的是| A.元素电负性大小顺序:N>S>C |
| B.通入适量Cl2 ,平衡向逆反应方向移动 |
| C.滴加浓KSCN溶液,平衡向正反应方向移动 |
| D.滴加NaOH稀溶液,溶液颜色加深 |
【知识点】 化学平衡的移动解读 浓度对化学平衡移动的影响解读
您最近一年使用:0次
单选题
|
适中(0.65)
13. 美国科技研究人员以溶有四烷基胺氟盐的氟代醚溶液为电解质,Cu/LaF3(LaF3具有惰性,不参与电池反应)为正极、铈/三氟化铈( Ce/CeF3)为负极组装成完整的电池器件并进行性能测试,发现电池在25℃、10 μA的放电电流下实现了可逆的稳定循环,这是氟离子电池首次实现在室温下的稳定可遵循环,使得氟离子电池展现出成为下一代高比能储能电池的强劲潜力。该电池的装置原理如图所示。

已知:CuF2微溶于水,CeF3难溶于水。下列说法错误的是

已知:CuF2微溶于水,CeF3难溶于水。下列说法错误的是
| A.四烷基胺氟盐的氟代醚溶液有自由移动的F- |
| B.负极反应为Ce-3e- =Ce3+ |
| C.正极的LaF3外壳能有效保护中心的Cu核免于溶解 |
| D.充电过程中,阳极溶解的金属与阴极析出的金属质量比为24:35 |
【知识点】 原电池原理 原电池电极反应式书写解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
14. 氮的氧化物对环境造成了极大的危害,研究消除氮的氧化物的污染是科技工作者的重要课题。如图是研究自由基CNS·与NO的会反应历程,4条反应路径中能量变化如图所示。已知: IM11 :IM12:
:IM12: ( 虚线表示未形成化学键,实线表示单键、双键等化学键)。下列说法错误的是
( 虚线表示未形成化学键,实线表示单键、双键等化学键)。下列说法错误的是

 :IM12:
:IM12: ( 虚线表示未形成化学键,实线表示单键、双键等化学键)。下列说法错误的是
( 虚线表示未形成化学键,实线表示单键、双键等化学键)。下列说法错误的是
A.自由基CNS·的电子式是: |
| B.反应速率的大小顺序:①>②>③>④ |
| C.反应路径④经过了2个中间体和3个过渡态 |
| D.IM12转化为OCS和N2时,需断裂O-N键和C-N键 |
【知识点】 化学反应原理综合考查解读
您最近一年使用:0次
单选题
|
较难(0.4)
15. 保持溶液常温不变,忽略溶液体积的变化,将粉末状态的NaOH逐渐加入到0.10 mol ·L-1的酸HX的水溶液中,溶液中lg 与溶液中的pH的关系如图所示。下列判断正确的是
与溶液中的pH的关系如图所示。下列判断正确的是

 与溶液中的pH的关系如图所示。下列判断正确的是
与溶液中的pH的关系如图所示。下列判断正确的是
| A.常温时,Ka(HX)=1.0 ×10-2.12 |
| B.a点混合液中:2c(X-) +c(H+) -c(OH-) <0. 10 mol·L-1 |
| C.b点混合液中:lgc(Na+) - lgc(HX) =2.38 |
| D.从a点到c点过程中,溶液中水的电离程度先减小后增大 |
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
16. 埃马纽埃尔·卡彭蒂耶( Emmanuelle Charpentier)和詹妮弗·杜德纳(JenniferA.Doudna)“凭借开发基因组编辑方法”方面作出的贡献而斩获2020年诺贝尔化学奖。利用基因组编辑可改良或生产已知的蛋白质,如我国科学家利用基因改良过的酵母菌可生产青蒿酸,1立方米的发酵罐,三四天时间就可以获得25公斤青蒿酸。

回答下列问题:
(1)构成蛋白质的元素有C、H、O、N,其中电负性最强的元素是___________ (写元素符号,下同),第一电离能最大的元素是___________ 。
(2)部分蛋白质的组成中含有P、S等元素,其简单氢化物的稳定性较强的___________ (写化学式)。某蛋白质水解产物中有下列结构的氨基酸,其分子式为___________ 。
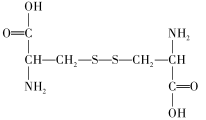
(3)血红蛋白(如下图乙)是一种含Fe的蛋白质:

①基态Fe原子的简化电子排布式是___________ ,图 甲中的有机化合物与亚铁离子结合生成血红蛋白,血红蛋白中的铁处于基态时,其最高能级中的单电子数是___________ 个。
②甲、乙结构中相同的官能团名称是___________ 。
③甲中含有的非极性共价键是___________ 。

回答下列问题:
(1)构成蛋白质的元素有C、H、O、N,其中电负性最强的元素是
(2)部分蛋白质的组成中含有P、S等元素,其简单氢化物的稳定性较强的
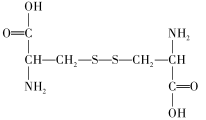
(3)血红蛋白(如下图乙)是一种含Fe的蛋白质:

①基态Fe原子的简化电子排布式是
②甲、乙结构中相同的官能团名称是
③甲中含有的非极性共价键是
【知识点】 物质结构与性质综合考查解读
您最近一年使用:0次
解答题-实验探究题
|
较易(0.85)
解题方法
17. 绿矾可用作媒染剂、鞣革剂、净水剂、木材防腐剂及消毒剂等。实验室采用下列流程中的方法制备少量FeSO4·7H2O。

“反应”阶段的实验装置如下图所示:

回答下列问题:
(1)仪器A的名称是___________ 。将一定量3.6g Fe粉和一定浓度一定体积的稀H2SO4加入仪器A中,加热并保持温度70 ~ 80℃ ,采用的最佳加热方式是___________ 。 实验装置中“侧管”的作用是___________ 。
(2)滤渣的成分是___________ ,如果操作I时 无滤渣生成,则制备的FeSO4溶液中会含有一种杂质离子,该离子是___________ 。
(3)蒸发浓缩用到的仪器有玻璃棒、___________ (写标号),停止加热的时机是___________ 。

(4)实验结束后,称取干燥的滤渣质量为0.8 g;过滤、洗涤、干燥得到11.4 g绿矾,则该制备过程的产率是___________ (保留2位有效数字)。

“反应”阶段的实验装置如下图所示:

回答下列问题:
(1)仪器A的名称是
(2)滤渣的成分是
(3)蒸发浓缩用到的仪器有玻璃棒、

(4)实验结束后,称取干燥的滤渣质量为0.8 g;过滤、洗涤、干燥得到11.4 g绿矾,则该制备过程的产率是
【知识点】 亚铁盐溶液的配制与保存解读 常见无机物的制备解读
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
解题方法
18. 对碳的氧化物和氮的氧化物的无害化处理是人类面临的一个重大课题。回答下列问题:
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =___________ kJ·mol-1,若反应III的正反应的活化能为Ea kJ·mol-1 ,则其逆反应的活化能为___________ kJ·mol-1。
②在某容积为2.00L的密闭容器中按照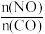 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
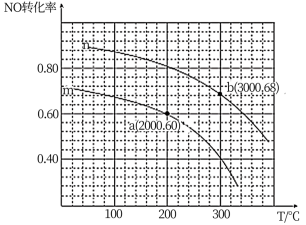
曲线n所代表的压强___________ (填“ >”或“<”)曲线m所代表的压强。测得a点对于反应容器体系中c(CO)=0.10 mol ·L-1,则该条件下容器体系中n(NO) =___________ mol,该温度下平衡常数K=___________ 。
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
则ΔH___________ (填“>”或“<”)0,写出提高CO2的平衡转化率的措施有______ (写出1条即可),测得250℃时,平衡体系压强为1.0 ×106 Pa,则平衡常数Kp=______ 。
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =
②在某容积为2.00L的密闭容器中按照
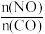 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
曲线n所代表的压强
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:| T/℃ | 100 | 150 | 200 | 250 | 300 | 350 |
| 转化率/% | 0.64 | 0.58 | 0.53 | 0.50 | 0.48 | 0.47 |
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
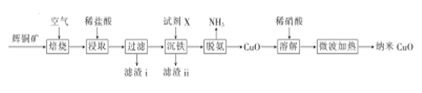
19. 纳米CuO是一种很好的工业催化剂或催化剂载体,用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)和其他无机物制备纳米CuO的工艺流程如下:
已知:Ksp[ Fe(OH)3]=1.0 ×10- 38
回答下列问题:
(1)焙烧时发生的主要反应的化学方程式为___________ 。通入的空气速率要控制在一定范围内,不能太快,也不能太慢,分析这样操作的理由:___________ 。
(2)浸取时需保证焙烧物中的Cu元素能完全浸出,提高浸取速率的方法有:______ (写出 1条即可)。
(3)滤渣i的主要成分的化学式是_____ 。
(4)沉铁时的离子方程式为_____ , 沉铁后测得滤液在常温时的pH=3,则滤液中c(Fe3+) =_______ mol·L-1

已知:Ksp[ Fe(OH)3]=1.0 ×10- 38
回答下列问题:
(1)焙烧时发生的主要反应的化学方程式为
(2)浸取时需保证焙烧物中的Cu元素能完全浸出,提高浸取速率的方法有:
(3)滤渣i的主要成分的化学式是
(4)沉铁时的离子方程式为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质
试卷题型(共 19题)
题型
数量
单选题
14
多选题
1
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 明矾的净水作用及原理 石油裂化、裂解 化学在农业中的应用 化学在工业中的应用 | |
| 2 | 0.65 | 盐类水解的应用 易水解的盐溶液的配制 制备与水解有关的物质 沉淀溶解平衡的应用 | |
| 3 | 0.65 | 乙醇的物理性质 乙醇与钠反应 有机物的检验 | |
| 4 | 0.65 | 与氧化剂、还原剂有关的计算 | |
| 5 | 0.85 | 化学反应中能量变化的原因 | |
| 6 | 0.65 | 元素周期律、元素周期表的推断 | |
| 7 | 0.65 | 氢氧化亚铁的制备 测定某些反应的反应速率 温度对化学平衡移动的影响 根据相关反应设计原电池 | |
| 8 | 0.65 | 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 水的电离 盐类水解规律 | |
| 10 | 0.65 | 能层与能级 电负性 | |
| 11 | 0.85 | 配制一定物质的量浓度的溶液的步骤、操作 物质分离、提纯的常见化学方法 物质检验和鉴别的基本方法选择及应用 | |
| 12 | 0.65 | 化学平衡的移动 浓度对化学平衡移动的影响 | |
| 13 | 0.65 | 原电池原理 原电池电极反应式书写 | |
| 14 | 0.65 | 化学反应原理综合考查 | |
| 15 | 0.4 | 影响水电离的因素 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 二、多选题 | |||
| 9 | 0.65 | 离子反应的发生及书写 离子方程式的正误判断 漂白粉和漂粉精 氢氧化铝的制备 | |
| 三、解答题 | |||
| 16 | 0.65 | 物质结构与性质综合考查 | 结构与性质 |
| 17 | 0.85 | 亚铁盐溶液的配制与保存 常见无机物的制备 | 实验探究题 |
| 18 | 0.65 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡的有关计算 化学平衡图像分析 | 原理综合题 |
| 19 | 0.65 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |



