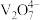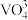1 . 某学习小组为探究Mg与酸、碱、盐溶液的反应。完成如下实验:
回答下列问题:
(1)实验前除去镁表面氧化物的方法是______ 。
(2)实验Ⅰ的离子方程式为____________ 。
(3)经实验分析,实验Ⅲ中产生的气体为 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是____________ 。
(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
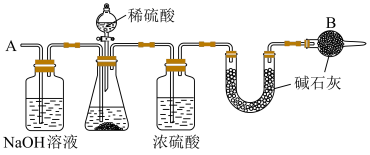
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量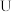 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为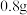 。
。____________ 。
②固体充分高温灼烧后,需要放在______ (填仪器名称)中冷却后才能称量。称量时______ (选填“是”“不是”)采用托盘天平称量。
(5)依据以上分析,实验Ⅲ中发生反应的方程式为____________ 。通过以上实验得出结论: 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
编号 | 操作 | 现象 |
Ⅰ | 将镁条放入 | 迅速放出大量气体,试管壁发热 |
Ⅱ | 将镁条放入pH为 | 无明显现象 |
Ⅲ | 将镁条放入pH为 | 放出气体,溶液中有白色沉淀生成 |
(1)实验前除去镁表面氧化物的方法是
(2)实验Ⅰ的离子方程式为
(3)经实验分析,实验Ⅲ中产生的气体为
 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体
 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量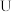 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为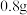 。
。
②固体充分高温灼烧后,需要放在
(5)依据以上分析,实验Ⅲ中发生反应的方程式为
 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
您最近一年使用:0次
名校
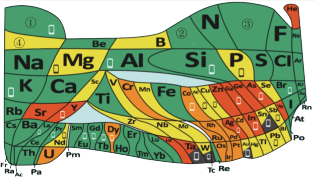
2 . 化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与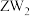 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
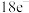 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 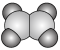 b.
b.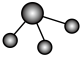 c.
c. 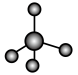 d.
d.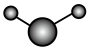
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
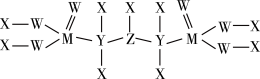
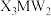 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则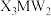 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与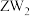 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
名校
3 . 请回答下列问题:
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
①制作冷敷袋常利用吸热的化学变化来实现,以下组合最能满足的是___________ 。(填字母)
A.冰 B.硝酸铵+水 C.硝酸铵+水合碳酸钠
②下列过程中的热量变化与冰袋一致的有___________ 。(填字母)
a. b.盐酸和镁条
b.盐酸和镁条
c.盐酸和碳酸氢钠 d. 和氯化铵
和氯化铵
e. 分解
分解
③某课外实验小组利用压强传感器、温度传感器、数据采集器和计算机等数字化实验设备,探究镁与一定量盐酸的反应速率,测得产生 的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为___________ ;在20s内用H+浓度表示的平均反应速率
___________ (20s时溶液体积为50mL,气体摩尔体积为25L/mol)。 ,是一个常见的放热反应。回答下列问题。
,是一个常见的放热反应。回答下列问题。
t℃时,向填充有催化剂、体积为2L的刚性容器中充入一定量的 和
和 合成氨,实验中测得
合成氨,实验中测得 随时间的变化如表所示:
随时间的变化如表所示:
①4-6min内 的平均反应速率
的平均反应速率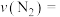
___________ 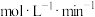
②下列情况能说明反应达到平衡状态的是___________ (填标号)。
A.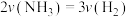 B.混合气体的平均相对分子质量不再变化
B.混合气体的平均相对分子质量不再变化
C. 体积分数不再变化 D.混合气体的密度保持不变
体积分数不再变化 D.混合气体的密度保持不变
③如表列出了在不同温度和压强下,反应达到平衡时 的百分含量
的百分含量 。
。
从表中数据得出,合成氨最优的条件是___________ 。
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
①制作冷敷袋常利用吸热的化学变化来实现,以下组合最能满足的是
A.冰 B.硝酸铵+水 C.硝酸铵+水合碳酸钠
②下列过程中的热量变化与冰袋一致的有
a.
 b.盐酸和镁条
b.盐酸和镁条c.盐酸和碳酸氢钠 d.
 和氯化铵
和氯化铵e.
 分解
分解③某课外实验小组利用压强传感器、温度传感器、数据采集器和计算机等数字化实验设备,探究镁与一定量盐酸的反应速率,测得产生
 的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
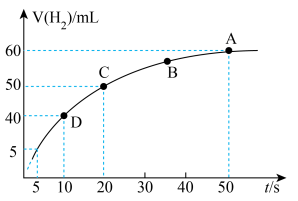
 ,是一个常见的放热反应。回答下列问题。
,是一个常见的放热反应。回答下列问题。t℃时,向填充有催化剂、体积为2L的刚性容器中充入一定量的
 和
和 合成氨,实验中测得
合成氨,实验中测得 随时间的变化如表所示:
随时间的变化如表所示:①4-6min内
 的平均反应速率
的平均反应速率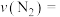
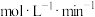
| 时间/min | 2 | 4 | 6 | 8 | 10 | 12 |
 / / | 0.04 | 0.10 | 0.14 | 0.16 | 0.16 | 0.16 |
A.
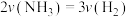 B.混合气体的平均相对分子质量不再变化
B.混合气体的平均相对分子质量不再变化C.
 体积分数不再变化 D.混合气体的密度保持不变
体积分数不再变化 D.混合气体的密度保持不变③如表列出了在不同温度和压强下,反应达到平衡时
 的百分含量
的百分含量 。
。压强/MPa % %温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.5 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
您最近一年使用:0次
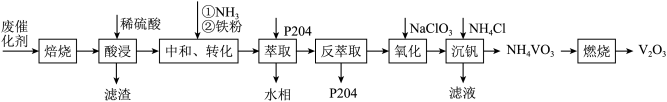
4 . 某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、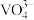 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,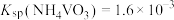
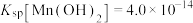


回答下列问题:
(1)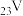 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中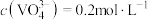 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中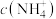 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,
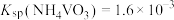
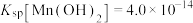


回答下列问题:
(1)
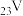 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是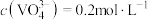 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中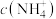 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。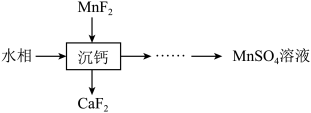
您最近一年使用:0次
名校
解题方法
5 . 碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上常以碲铜废料(主要成分是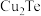 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下: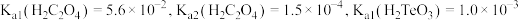 ,
,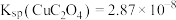 。
。
(1) 中碲元素的化合价为
中碲元素的化合价为_______ 。碲在元素周期表中的位置为_______ 。
(2)“氧化酸浸”得到 和
和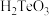 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)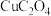 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为_______ 。(保留两位有效数字){已知:反应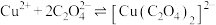 的平衡常数
的平衡常数 }
}
(4)“还原”在 50 ℃条件下进行: ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为_______ 。
(5)“还原”时, 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有_______ 。
(6)将一定质量的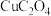 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为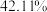 ,则剩余固体的化学式为
,则剩余固体的化学式为_______ 。
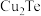 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下:
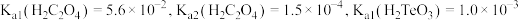 ,
,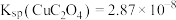 。
。(1)
 中碲元素的化合价为
中碲元素的化合价为(2)“氧化酸浸”得到
 和
和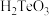 ,该反应的化学方程式为
,该反应的化学方程式为(3)
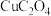 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为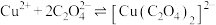 的平衡常数
的平衡常数 }
}(4)“还原”在 50 ℃条件下进行:
 ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为(5)“还原”时,
 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有(6)将一定质量的
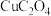 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为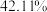 ,则剩余固体的化学式为
,则剩余固体的化学式为
您最近一年使用:0次
名校
6 . 尿素是一种重要化工生产原料。工业上以液氨和二氧化碳为原料,在高温高压条件下直接合成尿素,主要反应如下:
①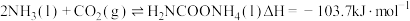
②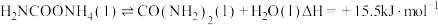
回答下列问题:
(1)
_______  。
。
(2)在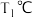 和
和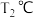 时
时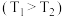 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: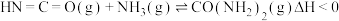 。
。
平衡时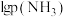 与
与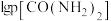 的关系如图所示,
的关系如图所示,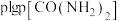 为物质的分压(单位为
为物质的分压(单位为 ),若
),若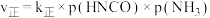 ,
,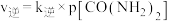 。
。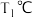 时,
时,
_______ 。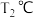 时此反应的标准平衡常数
时此反应的标准平衡常数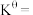
_______ 。{已知:分压 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: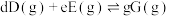 ,其中
,其中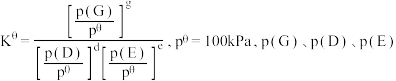 为各组分的平衡分压}
为各组分的平衡分压}_______ 。
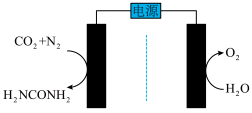
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源_______ 相连,其反应方程式为_______ 。
①
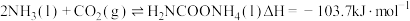
②
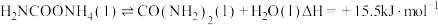
回答下列问题:
(1)

 。
。(2)在
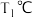 和
和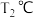 时
时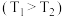 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: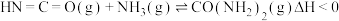 。
。平衡时
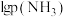 与
与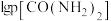 的关系如图所示,
的关系如图所示,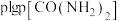 为物质的分压(单位为
为物质的分压(单位为 ),若
),若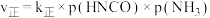 ,
,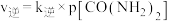 。
。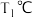 时,
时,
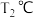 时此反应的标准平衡常数
时此反应的标准平衡常数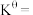
 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: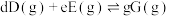 ,其中
,其中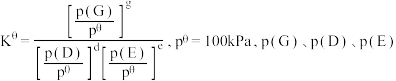 为各组分的平衡分压}
为各组分的平衡分压}
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源
您最近一年使用:0次
名校
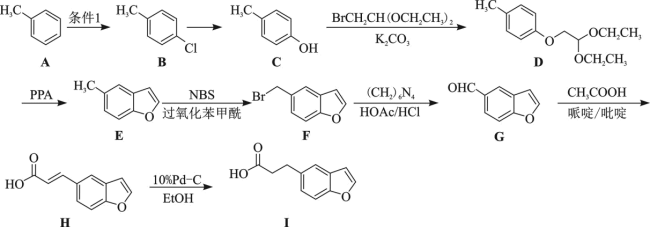
7 . 有机物I是制备治疗失眠症药物雷美替胺的中间体,可由甲苯经以下路线合成:
(1)C的名称为__________ ;F所含非含氧官能团的名称为__________ 。
(2)条件1是__________ ; 的反应类型是
的反应类型是__________ 。
(3)B在高温高压下与足量的氢氧化钠溶液反应的化学方程式为__________ 。
(4)1molE与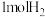 发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有
发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有__________ 种(不考虑立体异构);
①含有苯环且再无其它的环
②遇 溶液发生显色反应
溶液发生显色反应
(5)G生成H经历了加成反应和消去反应,反应过程如图所示:__________ 。
(1)C的名称为
(2)条件1是
 的反应类型是
的反应类型是(3)B在高温高压下与足量的氢氧化钠溶液反应的化学方程式为
(4)1molE与
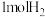 发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有
发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有①含有苯环且再无其它的环
②遇
 溶液发生显色反应
溶液发生显色反应(5)G生成H经历了加成反应和消去反应,反应过程如图所示:

您最近一年使用:0次
真题
解题方法
8 . 铍用于宇航器件的构筑。一种从其铝硅酸盐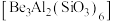 中提取铍的路径为:
中提取铍的路径为: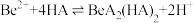
回答下列问题:
(1)基态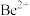 的轨道表示式为
的轨道表示式为_______ 。
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是_______ 。
(3)“萃取分液”的目的是分离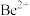 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是_______ 。
(4)写出反萃取生成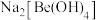 的化学方程式
的化学方程式_______ 。“滤液2”可以进入_______ 步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_______ 。
(6) 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为_______ 。
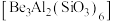 中提取铍的路径为:
中提取铍的路径为: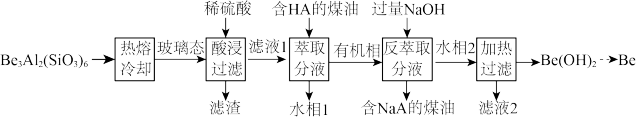
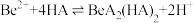
回答下列问题:
(1)基态
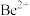 的轨道表示式为
的轨道表示式为(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3)“萃取分液”的目的是分离
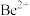 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是(4)写出反萃取生成
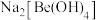 的化学方程式
的化学方程式(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6)
 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为
您最近一年使用:0次
真题
解题方法
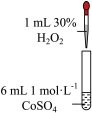
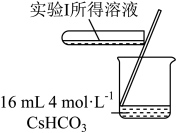
9 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、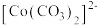 为红色、
为红色、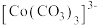 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
(1)配制 的
的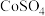 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明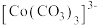 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、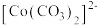 为红色、
为红色、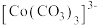 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b.  c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是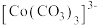 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
名校
解题方法
10 . 利用煤化工的副产物甲醇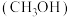 制丙烯
制丙烯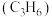 可缓解对石油的依赖。298K,100kPa下主反应为:
可缓解对石油的依赖。298K,100kPa下主反应为:
(1)在298K,100kPa下,由元素最稳定的单质生成1mol物质时的热效应叫做标准生成焓 。几种物质的标准生成焓
。几种物质的标准生成焓 数据如下:
数据如下:
则主反应的
___________  。
。
(2)450℃时,各物质均为气体,向容积为 的恒容密闭容器中通入
的恒容密闭容器中通入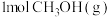 仅发生主反应,10min后达到平衡,此时容器中
仅发生主反应,10min后达到平衡,此时容器中 ,则10min内反应速率
,则10min内反应速率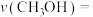
___________  ,该反应平衡常数K=
,该反应平衡常数K=___________ 。
(3)铝硅分子筛(表示为HAlSiO)催化 生成
生成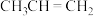 的机理如图:
的机理如图:
b.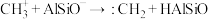
c.
①反应a中生成的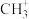 会继续参与反应生成某中性有机物,其结构简式为
会继续参与反应生成某中性有机物,其结构简式为___________ 。
②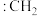 称为卡宾,有两种结构,如下图A、B所示,C原子采用
称为卡宾,有两种结构,如下图A、B所示,C原子采用 杂化的是
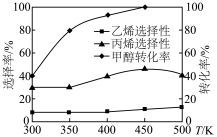
杂化的是___________ ,请利用电子排布规律判断基态时结构更为稳定___________ (填字母代号)。___________ ,温度超过450℃后,丙烯选择性降低的原因是___________ 。
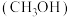 制丙烯
制丙烯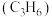 可缓解对石油的依赖。298K,100kPa下主反应为:
可缓解对石油的依赖。298K,100kPa下主反应为:
(1)在298K,100kPa下,由元素最稳定的单质生成1mol物质时的热效应叫做标准生成焓
 。几种物质的标准生成焓
。几种物质的标准生成焓 数据如下:
数据如下: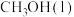 |  |  | |
 | -201.9 | -241.8 | 20.4 |

 。
。(2)450℃时,各物质均为气体,向容积为
 的恒容密闭容器中通入
的恒容密闭容器中通入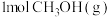 仅发生主反应,10min后达到平衡,此时容器中
仅发生主反应,10min后达到平衡,此时容器中 ,则10min内反应速率
,则10min内反应速率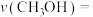
 ,该反应平衡常数K=
,该反应平衡常数K=(3)铝硅分子筛(表示为HAlSiO)催化
 生成
生成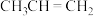 的机理如图:
的机理如图:

b.
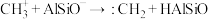
c.

①反应a中生成的
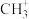 会继续参与反应生成某中性有机物,其结构简式为
会继续参与反应生成某中性有机物,其结构简式为②
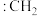 称为卡宾,有两种结构,如下图A、B所示,C原子采用
称为卡宾,有两种结构,如下图A、B所示,C原子采用 杂化的是
杂化的是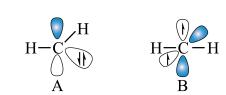
您最近一年使用:0次

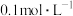 稀硫酸中
稀硫酸中 的
的 溶液中
溶液中