名校
解题方法
1 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①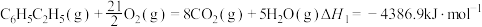
②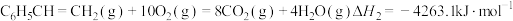
③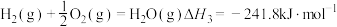
计算反应④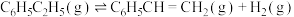 的
的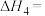
_______  ;
;
(2)在某温度、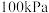 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______  水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);
(3)在 、
、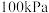 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤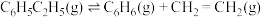
⑥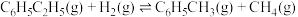
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______ ,理由是_______ ; 的描述错误的是_______;
的描述错误的是_______;
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。
,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。
(5)引发剂 中活性最高的是
中活性最高的是_______ ;
(6)室温下,① 在配体L的水溶液中形成
在配体L的水溶液中形成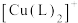 ,其反应平衡常数为K;
,其反应平衡常数为K;
②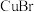 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知,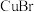 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为_______ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
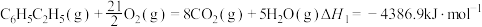
②
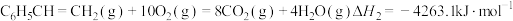
③
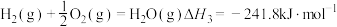
计算反应④
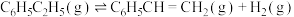 的
的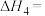
 ;
;(2)在某温度、
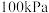 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);(3)在
 、
、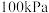 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
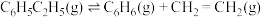
⑥
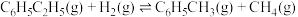
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是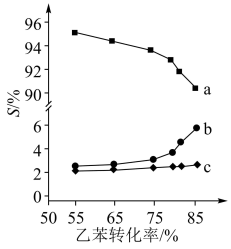
 的描述错误的是_______;
的描述错误的是_______;A. 不能改变反应热效应 不能改变反应热效应 |
B. 可改变乙苯平衡转化率 可改变乙苯平衡转化率 |
C. 降低了乙苯脱氢反应的活化能 降低了乙苯脱氢反应的活化能 |
D.改变 颗粒大小不影响反应速率 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某
 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。
,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。(5)引发剂
 中活性最高的是
中活性最高的是(6)室温下,①
 在配体L的水溶液中形成
在配体L的水溶液中形成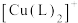 ,其反应平衡常数为K;
,其反应平衡常数为K;②
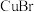 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知,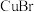 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为
您最近一年使用:0次
名校
2 . 锌在生产生活中应用广泛,同时,锌也是人体必需的微量元素之一,起着极其重要的作用。
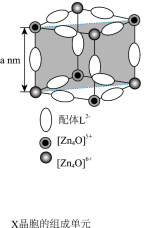
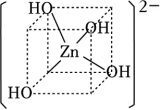
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。_______ 。
②L2-所含元素中,第一电离能从小到大的顺序为_______ ;每个L2-中采取sp2杂化的C原子数目为_______ 个。
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入_______ 。(假设X晶胞形状不变)。
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。_______ g•cm-3(列出化简的计算式)。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因:_______ 。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构_______ 。
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。

②L2-所含元素中,第一电离能从小到大的顺序为
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构
您最近一年使用:0次
名校
解题方法
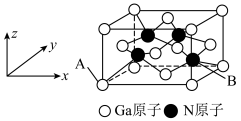
3 . 金属镓被称为“电子工业脊梁”,GaN凭借其出色的功率性能、频率性能以及散热性能,不仅应用于5G技术中,也让高功率、更快速充电由渴望变为现实。
【方法一】工业上利用粉煤灰(主要成分为 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下: mol/L时,可认为已除尽。
mol/L时,可认为已除尽。
(1)“焙烧”的主要目的是_______ 。
(2)“滤渣1”主要成分为_______ 。
(3)“二次酸化”中Na[Ga(OH4)]与过量 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“电解”可得金属Ga,写出阴极电极反应式_______ 。
(5)常温下,反应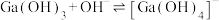 的平衡常数K的值为
的平衡常数K的值为_______ 。
【方法二】溶胶凝胶法
(6)步骤一:溶胶—凝胶过程包括水解和缩聚两个过程
①水解过程
②缩聚过程:在之后较长时间的成胶过程中,通过失水和失醇缩聚形成 无机聚合凝胶
无机聚合凝胶
失水缩聚: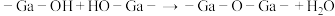
失醇缩聚:_______  (在下划线将失醇缩聚方程补充完整)
(在下划线将失醇缩聚方程补充完整)
(7)步骤二:高温氨化(原理: )
)
已知:GaN在空气中加热到800℃时开始氧化,生成氧化镓。
该实验操作为:将 无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再_______ (补充实验操作),得到纯净的GaN粉末。
【方法一】工业上利用粉煤灰(主要成分为
 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下: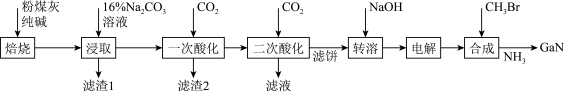
 mol/L时,可认为已除尽。
mol/L时,可认为已除尽。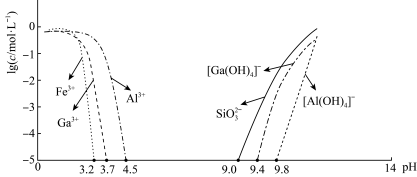
(1)“焙烧”的主要目的是
(2)“滤渣1”主要成分为
(3)“二次酸化”中Na[Ga(OH4)]与过量
 发生反应的离子方程式为
发生反应的离子方程式为(4)“电解”可得金属Ga,写出阴极电极反应式
(5)常温下,反应
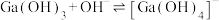 的平衡常数K的值为
的平衡常数K的值为【方法二】溶胶凝胶法
(6)步骤一:溶胶—凝胶过程包括水解和缩聚两个过程
①水解过程
②缩聚过程:在之后较长时间的成胶过程中,通过失水和失醇缩聚形成
 无机聚合凝胶
无机聚合凝胶失水缩聚:
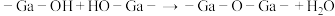
失醇缩聚:
 (在下划线将失醇缩聚方程补充完整)
(在下划线将失醇缩聚方程补充完整)(7)步骤二:高温氨化(原理:
 )
)已知:GaN在空气中加热到800℃时开始氧化,生成氧化镓。
该实验操作为:将
 无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
您最近一年使用:0次
名校
解题方法
4 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓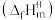 数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
则

_______  ,该反应在
,该反应在_______ (填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①: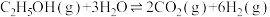
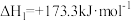
反应②: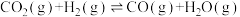
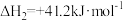
(2)向恒容密闭容器中充入1mol 和3mol
和3mol  发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时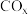 的分布分数
的分布分数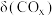 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。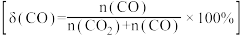
_______ (写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:_______ 。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内
___ 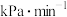 ,该温度下,反应②的
,该温度下,反应②的
_______ (保留小数点后两位)。
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:_______ ,当转移1.2mol电子时,正极消耗的氧气的体积为_______ L(标准状况下)。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓
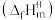 数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。| 物质 |  |  |  |  |
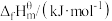 | 0 | -393.5 | -241.8 | -200.7 |


 ,该反应在
,该反应在Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①:
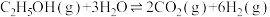
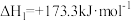
反应②:
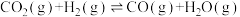
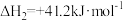
(2)向恒容密闭容器中充入1mol
 和3mol
和3mol  发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时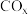 的分布分数
的分布分数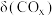 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。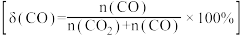

②200℃以后,解释曲线a随温度变化趋势的原因:
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内

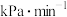 ,该温度下,反应②的
,该温度下,反应②的
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:

您最近一年使用:0次
7日内更新
|
136次组卷
|
3卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
解题方法
5 . 人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为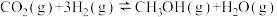
 。回答下列问题:
。回答下列问题:
(1)已知:①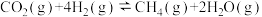
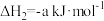 。
。
②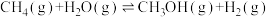
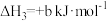 。
。
③a、b均为大于零的数,且a>b。
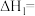
_______ (用含a、b的式子表示) 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为_______ 。_______ 。 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。_______ 。
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是_______ 。
(4)在T℃时,将6mol (g)和8mol
(g)和8mol (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生
 ,测得体系中剩余
,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。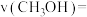
_______ 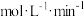 ,反应在该状态下达到平衡时
,反应在该状态下达到平衡时 的转化率为
的转化率为_______ ,若保持投料量不变,反应在状态Ⅱ下达到平衡后容器内的压强为P kPa,则该条件下反应的平衡常数
_______  。(用平衡分压代替平衡浓度计算,列出计算式)
。(用平衡分压代替平衡浓度计算,列出计算式)
②保持投料量不变,仅改变某一个条件后,测得 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是_______ 。
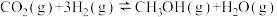
 。回答下列问题:
。回答下列问题:(1)已知:①
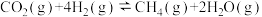
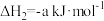 。
。②
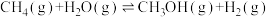
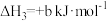 。
。③a、b均为大于零的数,且a>b。
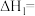
 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为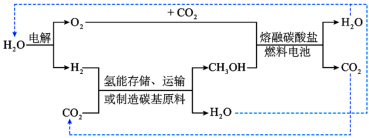
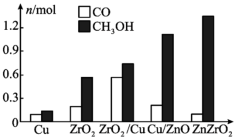
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。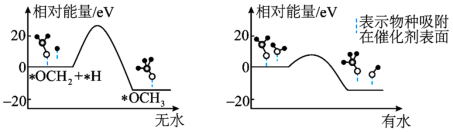
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是
(4)在T℃时,将6mol
 (g)和8mol
(g)和8mol (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生
 ,测得体系中剩余
,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。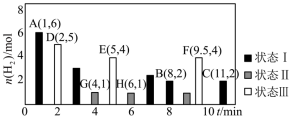
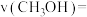
 ,反应在该状态下达到平衡时
,反应在该状态下达到平衡时 的转化率为
的转化率为
 。(用平衡分压代替平衡浓度计算,列出计算式)
。(用平衡分压代替平衡浓度计算,列出计算式)②保持投料量不变,仅改变某一个条件后,测得
 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
您最近一年使用:0次
名校
解题方法
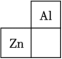
6 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。
解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(6)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为 ___________ g•cm-3(用含a、c、M、NA的代数式表示)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(6)ZnF2晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
名校
7 . 温室气体 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
Ⅰ. 工业上利用 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为
反应①: CH4(g)+ CO2(g) 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 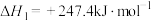
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g) CO(g) + H2O (g)
CO(g) + H2O (g) 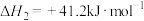
反应③:2 CO(g) CO2 (g) + C (s)
CO2 (g) + C (s) 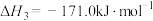
反应④:CH4(g) 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
将 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
_______ 。
(2)500℃时,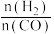 比较小,此时发生的副反应以
比较小,此时发生的副反应以_______ (选填②、③、④中一种)为主。升高温度,产物中 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是_______ 。
Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:_______ 。
(4)N点对应温度下,该反应的KP =_______ (MPa)2 (保留两位有效数字)
Ⅲ.用光电化学法将 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: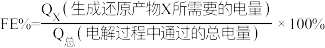 ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为_______ 。
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为_______ 。
 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。Ⅰ. 工业上利用
 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为反应①: CH4(g)+ CO2(g)
 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 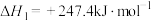
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g)
 CO(g) + H2O (g)
CO(g) + H2O (g) 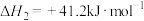
反应③:2 CO(g)
 CO2 (g) + C (s)
CO2 (g) + C (s) 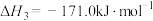
反应④:CH4(g)
 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
将
 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示: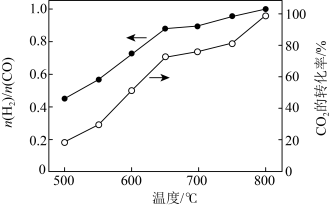

(2)500℃时,
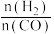 比较小,此时发生的副反应以
比较小,此时发生的副反应以 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示: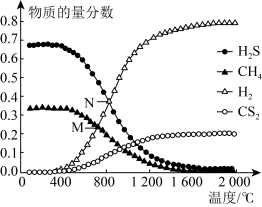
(4)N点对应温度下,该反应的KP =
Ⅲ.用光电化学法将
 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: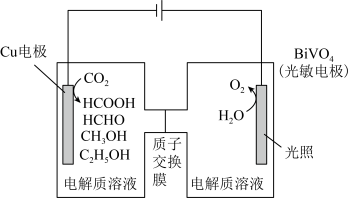
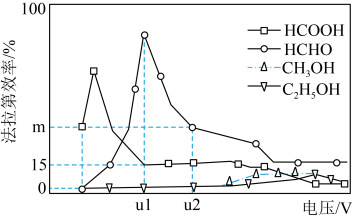
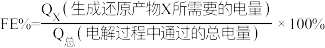 ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为
您最近一年使用:0次
名校
解题方法
8 . 铬是人体内微量元素之一,是重要的血糖调节剂。
(1)铬在元素周期表中的位置为___________ ,其基态原子核外电子占据的原子轨道数为___________ 。
(2)已知 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。
①该配合物中提供孤电子对形成配位键的原子是___________ 。
②配体中中心原子的杂化方式为___________ (填字母)。
a.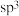 b.
b.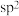 c.sp d.
c.sp d.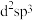
③该物质中, 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是___________ 。
(3)钛铬合金是一种高温结构材料,第二电离能
___________ (填“ ”或“
”或“ ”)
”)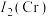 ,原因是
,原因是___________ 。
(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为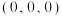 ,则B点分数坐标为
,则B点分数坐标为___________ ,已知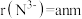 ,
,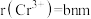 ,则AB间距离为
,则AB间距离为___________ nm。
(1)铬在元素周期表中的位置为
(2)已知
 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。①该配合物中提供孤电子对形成配位键的原子是
②配体中中心原子的杂化方式为
a.
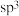 b.
b.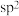 c.sp d.
c.sp d.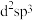
③该物质中,
 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是(3)钛铬合金是一种高温结构材料,第二电离能

 ”或“
”或“ ”)
”)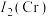 ,原因是
,原因是(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为
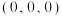 ,则B点分数坐标为
,则B点分数坐标为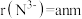 ,
,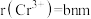 ,则AB间距离为
,则AB间距离为
您最近一年使用:0次
解题方法
9 . 一种以磷铁渣(主要含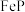 ,以及少量
,以及少量 、
、 等杂质)、
等杂质)、 为原料制备磷酸锰
为原料制备磷酸锰 的实验过程如下:
的实验过程如下:
(1)溶解。将一定量的磷铁渣加入如图所示装置的三颈烧瓶中,维持温度60℃,边搅拌边向三颈烧瓶中加入一定量的硫酸和 溶液,反应后有
溶液,反应后有 、
、 和
和 生成。反应后过滤。
生成。反应后过滤。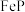 反应的离子方程式:
反应的离子方程式:___________ 。
②实验中当观察到某种现象时可不再加入 溶液,该现象是:
溶液,该现象是:___________ 。
③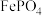 难溶于水,反应
难溶于水,反应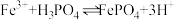 的平衡常数为
的平衡常数为___________ 。[已知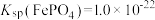 ,
, 的电离平衡常数
的电离平衡常数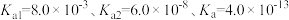 ]。
]。
④实验中需不断补充稀硫酸控制溶液的 。
。 过大会降低
过大会降低 的浸出率和消耗过多的
的浸出率和消耗过多的 ,原因是
,原因是___________ 。
(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的 。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用
。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用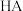 表示)萃取溶液中
表示)萃取溶液中 时发生如下反应:
时发生如下反应: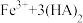 (有机层)
(有机层)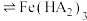 (有机层)
(有机层) ,反萃取回收萃取剂的方法是
,反萃取回收萃取剂的方法是___________ 。
(3)制 。由萃取后所得水层中
。由萃取后所得水层中 、
、 制纯净
制纯净 固体的实验方案,请补充完整:取萃取后所得水层溶液
固体的实验方案,请补充完整:取萃取后所得水层溶液 [其中
[其中 ],向其中滴加
],向其中滴加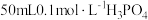 ,再滴加
,再滴加 溶液,至溶液
溶液,至溶液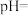
___________ ,过滤,洗涤沉淀至最后一次洗涤滤液中加入盐酸和 溶液
溶液___________ ,后干燥沉淀,得 固体。(已知溶液的
固体。(已知溶液的 对所得沉淀中锰磷比
对所得沉淀中锰磷比 和
和 的沉淀率影响如图所示。)
的沉淀率影响如图所示。)
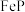 ,以及少量
,以及少量 、
、 等杂质)、
等杂质)、 为原料制备磷酸锰
为原料制备磷酸锰 的实验过程如下:
的实验过程如下:(1)溶解。将一定量的磷铁渣加入如图所示装置的三颈烧瓶中,维持温度60℃,边搅拌边向三颈烧瓶中加入一定量的硫酸和
 溶液,反应后有
溶液,反应后有 、
、 和
和 生成。反应后过滤。
生成。反应后过滤。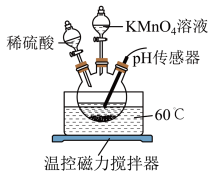
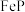 反应的离子方程式:
反应的离子方程式:②实验中当观察到某种现象时可不再加入
 溶液,该现象是:
溶液,该现象是:③
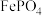 难溶于水,反应
难溶于水,反应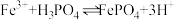 的平衡常数为
的平衡常数为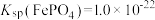 ,
, 的电离平衡常数
的电离平衡常数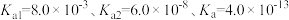 ]。
]。④实验中需不断补充稀硫酸控制溶液的
 。
。 过大会降低
过大会降低 的浸出率和消耗过多的
的浸出率和消耗过多的 ,原因是
,原因是(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的
 。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用
。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用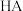 表示)萃取溶液中
表示)萃取溶液中 时发生如下反应:
时发生如下反应: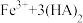 (有机层)
(有机层)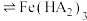 (有机层)
(有机层) ,反萃取回收萃取剂的方法是
,反萃取回收萃取剂的方法是(3)制
 。由萃取后所得水层中
。由萃取后所得水层中 、
、 制纯净
制纯净 固体的实验方案,请补充完整:取萃取后所得水层溶液
固体的实验方案,请补充完整:取萃取后所得水层溶液 [其中
[其中 ],向其中滴加
],向其中滴加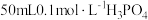 ,再滴加
,再滴加 溶液,至溶液
溶液,至溶液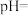
 溶液
溶液 固体。(已知溶液的
固体。(已知溶液的 对所得沉淀中锰磷比
对所得沉淀中锰磷比 和
和 的沉淀率影响如图所示。)
的沉淀率影响如图所示。)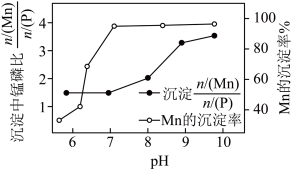
您最近一年使用:0次
名校
解题方法
10 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数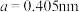 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
(3) 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为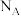 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 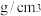 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数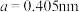 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
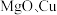 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图: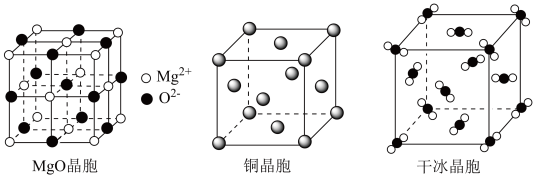
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为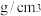 。
。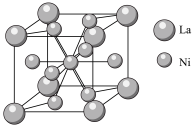
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次



