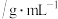名校
解题方法
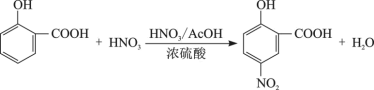
1 . 5-硝基水杨酸具有抑制炎症和治疗溃疡性结肠炎的作用,可由水杨酸通过硝化反应制备,其反应为:
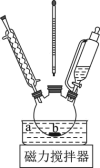
Ⅰ、产品合成:将水杨酸13.8g(0.1mol)和水(15mL)加入下图反应装置中,在搅拌下缓缓滴加68%硝酸(18mL)和浓硫酸(1.8mL)组成的混酸液。逐渐升温至70-80℃,并在此温度下保温回流2h。
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为__________(填标号)。
(2)在70-80℃反应时温度计水银球置于__________ (填“a”或“b”)处。
(3)硝化步骤中制取“混酸液”的具体操作是__________ 。
(4)合成过程中需要防暴沸却不需要额外添加沸石的原因是______________________________ 。
(5)“操作1”的名称是__________ 。
(6)5-硝基水杨酸的产率为__________ (保留三位有效数字)。
(7)硝化反应是硝酸在浓硫酸作用下,硝酸质子化后失水,产生硝酰正离子( ),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
已知:羧基是吸电子基团,羟基是推电子基团。
则水杨酸中有助于发生硝化反应的基团是____________________ 。
名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度 | 溶解性 |
水杨酸 | 138 | 158-161 | 336.3 | 1.375 | 微溶于冷水,易溶于热水、乙醇、乙醚和丙酮 |
5-硝基水杨酸 | 183 | 229-233 | 399.1 | 1.6 | 不溶于冷水,微溶于热水,易溶于乙醇、乙醚 |
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为__________(填标号)。
| A.100mL | B.250mL | C.500mL | D.1000mL |
(3)硝化步骤中制取“混酸液”的具体操作是
(4)合成过程中需要防暴沸却不需要额外添加沸石的原因是
(5)“操作1”的名称是
(6)5-硝基水杨酸的产率为
(7)硝化反应是硝酸在浓硫酸作用下,硝酸质子化后失水,产生硝酰正离子(
 ),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。已知:羧基是吸电子基团,羟基是推电子基团。
则水杨酸中有助于发生硝化反应的基团是
您最近一年使用:0次
名校
解题方法
2 . 利用煤化工的副产物甲醇 制丙烯
制丙烯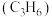 可缓解对石油的依赖。298K,100kPa下主反应为:
可缓解对石油的依赖。298K,100kPa下主反应为:
(1)在298K,100kPa下,由元素最稳定的单质生成1mol物质时的热效应叫做标准生成焓 。几种物质的标准生成焓
。几种物质的标准生成焓 数据如下:
数据如下:
则主反应的
___________  。
。
(2)450℃时,各物质均为气体,向容积为 的恒容密闭容器中通入
的恒容密闭容器中通入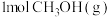 仅发生主反应,10min后达到平衡,此时容器中
仅发生主反应,10min后达到平衡,此时容器中 ,则10min内反应速率
,则10min内反应速率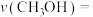
___________  ,该反应平衡常数K=
,该反应平衡常数K=___________ 。
(3)铝硅分子筛(表示为HAlSiO)催化 生成
生成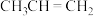 的机理如图:
的机理如图:
b.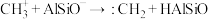
c.
①反应a中生成的 会继续参与反应生成某中性有机物,其结构简式为
会继续参与反应生成某中性有机物,其结构简式为___________ 。
②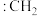 称为卡宾,有两种结构,如下图A、B所示,C原子采用
称为卡宾,有两种结构,如下图A、B所示,C原子采用 杂化的是
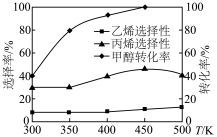
杂化的是___________ ,请利用电子排布规律判断基态时结构更为稳定___________ (填字母代号)。___________ ,温度超过450℃后,丙烯选择性降低的原因是___________ 。
 制丙烯
制丙烯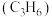 可缓解对石油的依赖。298K,100kPa下主反应为:
可缓解对石油的依赖。298K,100kPa下主反应为:
(1)在298K,100kPa下,由元素最稳定的单质生成1mol物质时的热效应叫做标准生成焓
 。几种物质的标准生成焓
。几种物质的标准生成焓 数据如下:
数据如下: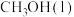 |  |  | |
 | -201.9 | -241.8 | 20.4 |

 。
。(2)450℃时,各物质均为气体,向容积为
 的恒容密闭容器中通入
的恒容密闭容器中通入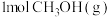 仅发生主反应,10min后达到平衡,此时容器中
仅发生主反应,10min后达到平衡,此时容器中 ,则10min内反应速率
,则10min内反应速率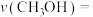
 ,该反应平衡常数K=
,该反应平衡常数K=(3)铝硅分子筛(表示为HAlSiO)催化
 生成
生成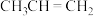 的机理如图:
的机理如图:

b.
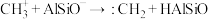
c.

①反应a中生成的
 会继续参与反应生成某中性有机物,其结构简式为
会继续参与反应生成某中性有机物,其结构简式为②
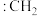 称为卡宾,有两种结构,如下图A、B所示,C原子采用
称为卡宾,有两种结构,如下图A、B所示,C原子采用 杂化的是
杂化的是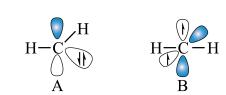
您最近一年使用:0次
3 . 从“钛磁铁矿”冶炼金属铁后的“含钛高炉渣”中提取金属钛的工艺流程如下:
②“水浸”溶液的 。
。
请回答下列问题:
(1)“熔融”时,为了使反应物充分受热融化反应,可以采取的措施有___________ 。
(2)某实验小组模拟“熔融”过程的反应,将固体 与
与 按物质的量1:2混合反应生成
按物质的量1:2混合反应生成 反应过程的热重曲线如图所示。
反应过程的热重曲线如图所示。 的方程式为
的方程式为___________ 。
②“水浸”后滤渣主要有___________ 。
(3)整合剂EDTA(乙二胺四乙酸三钠, )能够与金属阳离子按1:1反应形成非常稳定的整合物(
)能够与金属阳离子按1:1反应形成非常稳定的整合物(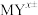 )。已知
)。已知 ,
,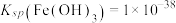
①“水解”步骤加入EDTA的目的是___________ 。
②常温下,某溶液中 和Fe3+浓度均为:
和Fe3+浓度均为: 的溶液中,用氨水调pH至4时溶液中的
的溶液中,用氨水调pH至4时溶液中的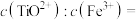
___________ 。
(4)一种 晶体结构如图(黑球表示
晶体结构如图(黑球表示 ,白球表示
,白球表示 ),其熔点为1850℃。
),其熔点为1850℃。 的配位数为
的配位数为___________ 。
②“电解”时,以覆盖氮化硼的石墨电极为阳极,电解 的共熔物得到金属钛,
的共熔物得到金属钛, 的作用是
的作用是___________ 。
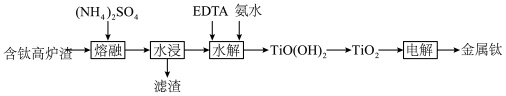
| 组分 |  |  |  |  |  |  | 其他 |
| 质量分数% | 34 | 6~16 | 17~19 | 14~16 | 8.0~9.0 | 3.0~4.2 | 0.8 |
 。
。请回答下列问题:
(1)“熔融”时,为了使反应物充分受热融化反应,可以采取的措施有
(2)某实验小组模拟“熔融”过程的反应,将固体
 与
与 按物质的量1:2混合反应生成
按物质的量1:2混合反应生成 反应过程的热重曲线如图所示。
反应过程的热重曲线如图所示。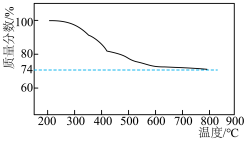
 的方程式为
的方程式为②“水浸”后滤渣主要有
(3)整合剂EDTA(乙二胺四乙酸三钠,
 )能够与金属阳离子按1:1反应形成非常稳定的整合物(
)能够与金属阳离子按1:1反应形成非常稳定的整合物(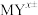 )。已知
)。已知 ,
,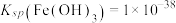
①“水解”步骤加入EDTA的目的是
②常温下,某溶液中
 和Fe3+浓度均为:
和Fe3+浓度均为: 的溶液中,用氨水调pH至4时溶液中的
的溶液中,用氨水调pH至4时溶液中的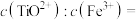
(4)一种
 晶体结构如图(黑球表示
晶体结构如图(黑球表示 ,白球表示
,白球表示 ),其熔点为1850℃。
),其熔点为1850℃。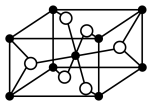
 的配位数为
的配位数为②“电解”时,以覆盖氮化硼的石墨电极为阳极,电解
 的共熔物得到金属钛,
的共熔物得到金属钛,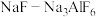 的作用是
的作用是
您最近一年使用:0次
名校
4 . 锑白(Sb2O3,两性氧化物)可用作白色颜料和阻燃剂。一种制备Sb2O3的实验步骤如下:
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器A中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。
①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水,二者极性都较小。
回答下列问题:
(1)仪器a的名称为___________ ,装置B中的试剂X为___________ 。
(2)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式___________ 。
(3)A中通入氨气需要控制碱性不能太强,原因是___________ 。
(4)如果将乙二醇改为乙醇用上述同样方法制备Sb2O3,往往得到Sb2O3混晶,解释原因___________ 。
(5)取ag产品于锥形瓶中,用盐酸等试剂预处理后,用cmol/L碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为:Sb3++I2=Sb5++2I-。
①滴定终点颜色变化为___________ 。
②产品中Sb元素的质量分数是___________ %。
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器A中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。

①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水,二者极性都较小。
回答下列问题:
(1)仪器a的名称为
(2)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式
(3)A中通入氨气需要控制碱性不能太强,原因是
(4)如果将乙二醇改为乙醇用上述同样方法制备Sb2O3,往往得到Sb2O3混晶,解释原因
(5)取ag产品于锥形瓶中,用盐酸等试剂预处理后,用cmol/L碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为:Sb3++I2=Sb5++2I-。
①滴定终点颜色变化为
②产品中Sb元素的质量分数是
您最近一年使用:0次
名校
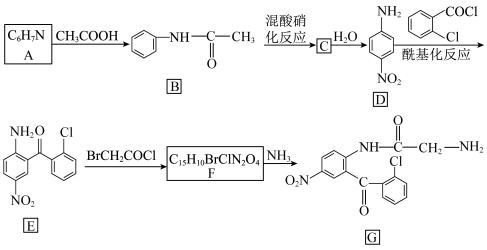
5 . 某研究小组通过下列路线合成镇静药物氯硝西泮的中间体G。
(1)化合物A的名称为___________ ;化合物B的官能团名称为___________ ;化合物C→D的反应类型为___________ 。
(2)写出化合物B到C的化学方程式___________ 。
(3)化合物E转化为F的另一种产物是___________ 。
(4)下列说法正确的是___________。
(5)写出同时符合下列条件的化合物B的同分异构体的结构简式___________ (任写一种)。
①分子中含有苯环,可以发生银镜反应。
②核磁共振氢谱显示分子中有5种不同化学环境的氢,且峰面积之比为1:2:2:2:2。
(6)检验F中溴原子需要用到的试剂为___________ 。
(1)化合物A的名称为
(2)写出化合物B到C的化学方程式
(3)化合物E转化为F的另一种产物是
(4)下列说法正确的是___________。
| A.化合物A的碱性比化合物D弱 |
| B.化合物A→D的过程中,采用了保护氨基的方法 |
| C.化合物B与足量H2加成后的产物存在手性碳原子 |
| D.化合物G既可与盐酸反应,也可与NaOH反应 |
(5)写出同时符合下列条件的化合物B的同分异构体的结构简式
①分子中含有苯环,可以发生银镜反应。
②核磁共振氢谱显示分子中有5种不同化学环境的氢,且峰面积之比为1:2:2:2:2。
(6)检验F中溴原子需要用到的试剂为
您最近一年使用:0次
6 . 磷锂铝石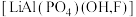 是一种含锂、铝的氟磷酸盐,常含
是一种含锂、铝的氟磷酸盐,常含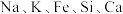 等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料
等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料 的工艺流程如图所示:
的工艺流程如图所示:
(1)滤渣1的成分为 和
和__________ (填化学式)。
(2)“氧化”的目的是____________________ (语言叙述),滤渣2的成分为__________ 。
(3) 的溶解度曲线如图所示。图中a、b对应温度下
的溶解度曲线如图所示。图中a、b对应温度下 的溶度积之比
的溶度积之比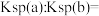
__________ ,“沉锂”时,控制温度为 ,饱和
,饱和 的浓度约为
的浓度约为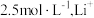
_________ (填“可能”或“不可能”)沉淀完全。[ 饱和溶液的密度近似为
饱和溶液的密度近似为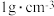 ,
,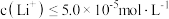 认为沉淀完全]。
认为沉淀完全]。 ,测得
,测得 沉淀率随温度升高而增加,其原因是
沉淀率随温度升高而增加,其原因是_________ (任写一条即可)。
(5)“沉锂”后分离得到 的操作是蒸发结晶、
的操作是蒸发结晶、________ 、洗涤、干燥。
(6)“合成”在高温下进行,写出该反应的化学方程式:__________ (葡萄糖→ )。
)。
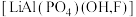 是一种含锂、铝的氟磷酸盐,常含
是一种含锂、铝的氟磷酸盐,常含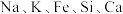 等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料
等元素,是含锂较高的工业矿物之一。以磷锂铝石为原料制备锂离子动力电池正极材料 的工艺流程如图所示:
的工艺流程如图所示: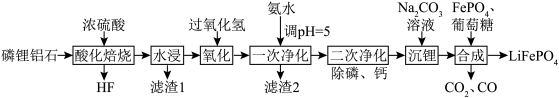
(1)滤渣1的成分为
 和
和(2)“氧化”的目的是
(3)
 的溶解度曲线如图所示。图中a、b对应温度下
的溶解度曲线如图所示。图中a、b对应温度下 的溶度积之比
的溶度积之比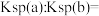
 ,饱和
,饱和 的浓度约为
的浓度约为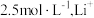
 饱和溶液的密度近似为
饱和溶液的密度近似为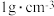 ,
,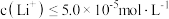 认为沉淀完全]。
认为沉淀完全]。
 ,测得
,测得 沉淀率随温度升高而增加,其原因是
沉淀率随温度升高而增加,其原因是(5)“沉锂”后分离得到
 的操作是蒸发结晶、
的操作是蒸发结晶、(6)“合成”在高温下进行,写出该反应的化学方程式:
 )。
)。
您最近一年使用:0次
7 . 锌是一种应用广泛的金属。以闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料,制备金属锌的流程如图所示:
(1)“焙烧”过程产生大量的SO2,可用氨水吸收再氧化得到一种氮肥,该氮肥的主要成分为___________ 。
(2)①用稀硫酸完全溶浸后,过滤所得滤渣1的主要成分为___________ 。滤渣1、滤渣2、滤渣3均需洗涤,证明三种滤渣洗涤干净的共同方法是___________ 。
②常温下,有关金属离子沉淀的pH如下表所示(当离子浓度小于1.0×10-5mol/L时认为沉淀完全)。
“氧化除杂”中调pH的范围是___________ 。
(3)“还原除杂”中反应的离子方程式为___________ 。
(4)“还原除杂”后的滤液经操作___________ 、过滤,洗涤,干燥,可得ZnSO4·7H2O晶体。
(5)用惰性电极电解硫酸锌溶液,如阴极生成10molZn,理论上阳极产物的物质的量为___________ mol。电解后的电解液可返回___________ 工序继续使用。

(1)“焙烧”过程产生大量的SO2,可用氨水吸收再氧化得到一种氮肥,该氮肥的主要成分为
(2)①用稀硫酸完全溶浸后,过滤所得滤渣1的主要成分为
②常温下,有关金属离子沉淀的pH如下表所示(当离子浓度小于1.0×10-5mol/L时认为沉淀完全)。
| Fe3+ | Zn2+ | Cd2+ | |
| 开始沉淀pH | 2.3 | 6.2 | 7.4 |
| 沉淀完全pH | 3.3 | 8.7 | 9.4 |
(3)“还原除杂”中反应的离子方程式为
(4)“还原除杂”后的滤液经操作
(5)用惰性电极电解硫酸锌溶液,如阴极生成10molZn,理论上阳极产物的物质的量为
您最近一年使用:0次
名校
解题方法
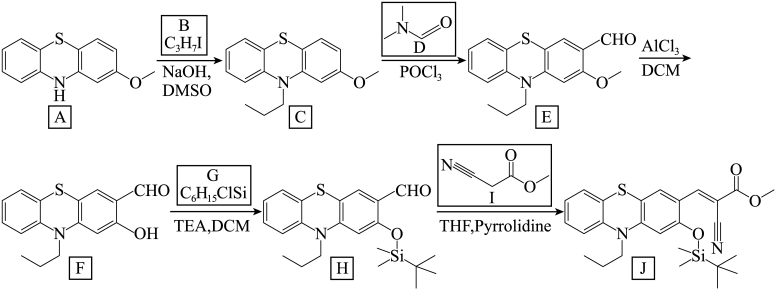
8 . 人体摄入少量氟可预防龋齿,增强免疫力,但摄入过量会导致氟斑牙、氟骨症和肿瘤的发生,因此需要对氟离子进行定量检测。化合物J可以定量检测氟离子,其合成路线如下
(1)按照系统命名法,B的名称为_______ 。
(2)D中所含官能团的名称为_______ 。
(3)G的结构简式为_______ 。
(4)已知RCN在酸性条件下水解生成RCOOH,I在酸性条件下充分水解的离子方程式为____ 。
(5)H→J分2步进行,反应类型依次为_______ 、_______ 。
(6)I的同分异构体中,同时满足下列条件的共有____ 种(不考虑立体异构)。其中,含有手性碳的异构体的结构简式为_____ 。
①具有链状结构且含有硝基。②碳原子不全在一条直线上。
(7)J检测氟离子时,J转化为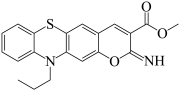 释放出较强的荧光信号,同时生成氟硅烷,从结构的角度分析Si-O转换为Si-F的原因:
释放出较强的荧光信号,同时生成氟硅烷,从结构的角度分析Si-O转换为Si-F的原因:_______ 。
(1)按照系统命名法,B的名称为
(2)D中所含官能团的名称为
(3)G的结构简式为
(4)已知RCN在酸性条件下水解生成RCOOH,I在酸性条件下充分水解的离子方程式为
(5)H→J分2步进行,反应类型依次为
(6)I的同分异构体中,同时满足下列条件的共有
①具有链状结构且含有硝基。②碳原子不全在一条直线上。
(7)J检测氟离子时,J转化为
 释放出较强的荧光信号,同时生成氟硅烷,从结构的角度分析Si-O转换为Si-F的原因:
释放出较强的荧光信号,同时生成氟硅烷,从结构的角度分析Si-O转换为Si-F的原因:
您最近一年使用:0次
名校
解题方法
9 . 检验甲醛用银-Ferrozine法灵敏度较高。测定原理为甲醛与银氨溶液反应生成 ,产生的
,产生的 与
与 定量反应生成
定量反应生成 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。
与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。 ;毛细管内径不超过
;毛细管内径不超过 。
。
回答下列问题:
(1)A装置中反应的化学方程式为________ ,用饱和食盐水代替水制备 的原因是
的原因是_________ 。
(2)B中装有硝酸银溶液,仪器B的名称为_______ 。
(3)银氨溶液的制备。关闭 ,打开
,打开 ,打开
,打开______ ,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中______ ,停止通入
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开 ,将滑动隔板慢慢由最右端抽到最左端,吸入
,将滑动隔板慢慢由最右端抽到最左端,吸入 室内空气,关闭
室内空气,关闭 ;后续操作是
;后续操作是_______ ;重复上述操作共进行3次。毛细管的作用是___________ 。
②甲醛与银氨溶液反应,甲醛被氧化生成一种正盐,其化学方程式为__________ 。
③向上述B中充分反应后的溶液中加入稀硫酸调节溶液 ,再加入足量
,再加入足量 溶液,充分反应后立即加入菲洛嗪,
溶液,充分反应后立即加入菲洛嗪, 与菲洛嗪形成有色物质,在
与菲洛嗪形成有色物质,在 处测定吸光度,测得生成
处测定吸光度,测得生成 ,空气中甲醛的含量为
,空气中甲醛的含量为______  。
。
 ,产生的
,产生的 与
与 定量反应生成
定量反应生成 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。
与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。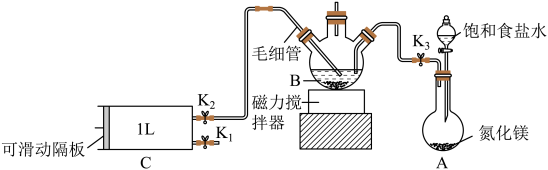
 ;毛细管内径不超过
;毛细管内径不超过 。
。回答下列问题:
(1)A装置中反应的化学方程式为
 的原因是
的原因是(2)B中装有硝酸银溶液,仪器B的名称为
(3)银氨溶液的制备。关闭
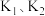 ,打开
,打开 ,打开
,打开
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开
 ,将滑动隔板慢慢由最右端抽到最左端,吸入
,将滑动隔板慢慢由最右端抽到最左端,吸入 室内空气,关闭
室内空气,关闭 ;后续操作是
;后续操作是②甲醛与银氨溶液反应,甲醛被氧化生成一种正盐,其化学方程式为
③向上述B中充分反应后的溶液中加入稀硫酸调节溶液
 ,再加入足量
,再加入足量 溶液,充分反应后立即加入菲洛嗪,
溶液,充分反应后立即加入菲洛嗪, 与菲洛嗪形成有色物质,在
与菲洛嗪形成有色物质,在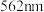 处测定吸光度,测得生成
处测定吸光度,测得生成 ,空气中甲醛的含量为
,空气中甲醛的含量为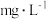 。
。
您最近一年使用:0次
名校
10 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。 (
( 或
或 )的萃取原理:
)的萃取原理: 。
。
回答下列问题:
(1)“高温氢化”时 不参与反应,固体产物为
不参与反应,固体产物为 、
、 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为________ ,实际生产中少量的 与空气接触会转化为
与空气接触会转化为________ ,所以为降低锂在固体残余物中的含量应用 “酸洗”。
“酸洗”。
(2)若“洗液”中 ,加入
,加入 固体后,为使沉淀
固体后,为使沉淀 中
中 元素含量不小于
元素含量不小于 元素总量的95%,则
元素总量的95%,则 “洗液”中至少需要加入
“洗液”中至少需要加入 的物质的量为
的物质的量为________  [忽略溶液体积变化,
[忽略溶液体积变化, ]。
]。
(3)“沉锰”过程中 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。 的离子方程式为
的离子方程式为________________ 。
②该工艺条件下, 开始沉淀的
开始沉淀的 为2,
为2, 开始沉淀的
开始沉淀的 为3。“沉锰”过程中应选择的最佳
为3。“沉锰”过程中应选择的最佳 为
为________ , 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是________ 。
(4)“反萃取”的目的是将有机层中 、
、 转移到水层,为使
转移到水层,为使 、
、 尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有________ 。
 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。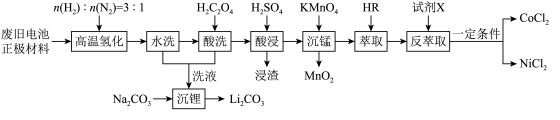
 (
( 或
或 )的萃取原理:
)的萃取原理: 。
。回答下列问题:
(1)“高温氢化”时
 不参与反应,固体产物为
不参与反应,固体产物为 、
、 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 与空气接触会转化为
与空气接触会转化为 “酸洗”。
“酸洗”。(2)若“洗液”中
 ,加入
,加入 固体后,为使沉淀
固体后,为使沉淀 中
中 元素含量不小于
元素含量不小于 元素总量的95%,则
元素总量的95%,则 “洗液”中至少需要加入
“洗液”中至少需要加入 的物质的量为
的物质的量为 [忽略溶液体积变化,
[忽略溶液体积变化, ]。
]。(3)“沉锰”过程中
 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。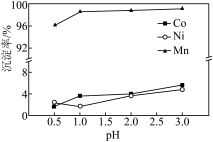
 的离子方程式为
的离子方程式为②该工艺条件下,
 开始沉淀的
开始沉淀的 为2,
为2, 开始沉淀的
开始沉淀的 为3。“沉锰”过程中应选择的最佳
为3。“沉锰”过程中应选择的最佳 为
为 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是(4)“反萃取”的目的是将有机层中
 、
、 转移到水层,为使
转移到水层,为使 、
、 尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
尽可能多地转移到水层,可适当增大盐酸的浓度,还应采取的实验操作有
您最近一年使用:0次