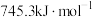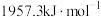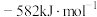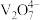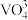名校
1 . 钛被称为“二十一世纪的金属”,绿矾是重要的化工原料,用钛铁矿[主要成分是钛酸亚铁( ),含少量
),含少量 、MgO、
、MgO、 等杂质]作原料生产金属钛和绿矾(
等杂质]作原料生产金属钛和绿矾( )等产品的一种工艺流程如下:
)等产品的一种工艺流程如下:___________ 。
(2)矿渣的主要成分是___________ ;试剂A为___________ (填化学式)。
(3)“操作Ⅱ”为___________ 、___________ 、过滤、洗涤、干燥。
(4)对所得到的绿矾晶体常用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为___________ 。
(5)沸腾氯化中,氯气与矿料逆流而行,目的是___________ ,充分反应后,混合气体中CO与 的分压之比为1∶2,该温度下,
的分压之比为1∶2,该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为___________ 。
(6)俄罗斯科学家于20世纪60年代提出了用金属氢化物还原法生产钛粉这一技术构想,并进行了试验研究。俄罗斯图拉化工冶金厂以 为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式___________ 。
 ),含少量
),含少量 、MgO、
、MgO、 等杂质]作原料生产金属钛和绿矾(
等杂质]作原料生产金属钛和绿矾( )等产品的一种工艺流程如下:
)等产品的一种工艺流程如下: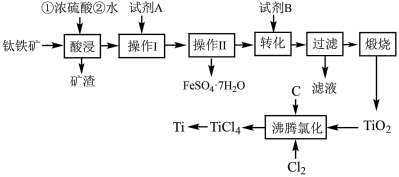
(2)矿渣的主要成分是
(3)“操作Ⅱ”为
(4)对所得到的绿矾晶体常用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为
(5)沸腾氯化中,氯气与矿料逆流而行,目的是
 的分压之比为1∶2,该温度下,
的分压之比为1∶2,该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为(6)俄罗斯科学家于20世纪60年代提出了用金属氢化物还原法生产钛粉这一技术构想,并进行了试验研究。俄罗斯图拉化工冶金厂以
 为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
为原料,采用在1100℃-1200℃条件下氢化钙还原生产钛粉的方法并产生一种气体,请写出相关反应方程式
您最近一年使用:0次
名校
2 . 铜及其化合物在生活、生产中用途广泛。回答下列问题:
(1)基态铁原子的价层电子的轨道表示式为__________ ,其原子核外电子的空间运动状态有__________ 种。
(2)高温下CuO能转化为 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是__________ 。
(3)在水溶液中 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以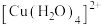 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释__________ 。
(注:水合能指的是气态基态离子与水分子结合生成 水合离子时所释放的能量。)
水合离子时所释放的能量。)
(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。__________ ,加热时,M首先失去的组分分子空间结构名称为__________ 。
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为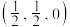 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为__________ 。晶胞参数分别为 ,
, 、
、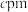 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为__________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
(1)基态铁原子的价层电子的轨道表示式为
(2)高温下CuO能转化为
 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是(3)在水溶液中
 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释第一电离能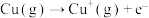 | 第二电离能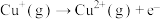 | 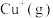 水合能( 水合能( ) ) | 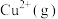 水合能( 水合能( ) ) |
|
|
|
|
 水合离子时所释放的能量。)
水合离子时所释放的能量。)(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。
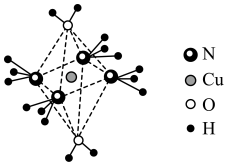
(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为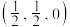 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 ,
, 、
、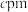 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
3 . 我国航天事业高速发展,火箭推进剂的研究一直是航天工业的热点课题。火箭推进剂燃料有肼( )、液氢等,常见氧化剂有
)、液氢等,常见氧化剂有 、液氧等。回答下列问题:
、液氧等。回答下列问题:
(1)已知下列反应的热化学方程式如下:
ⅰ.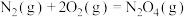
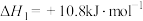
ⅱ.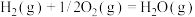
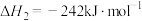
ⅲ.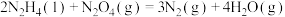
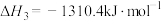
①则

__________  。
。
②反应ⅲ可自发进行的原因是__________ 。
③火箭推进器内氢氧燃烧的简化反应历程如图所示:__________ 。
(2)利用甲烷和水蒸气催化制氢主要存在如下两个反应:
a: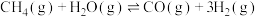
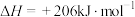
b:
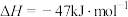
恒定压强为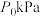 时,将物质的量之比为
时,将物质的量之比为 的
的 与
与 混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
①下列操作中,能提高 平衡转化率的是
平衡转化率的是__________ (填字母)。
A.提高 与
与 的投料比 B.移除CO
的投料比 B.移除CO
C.选择合适的催化剂 D.恒温恒压下通入Ar气
②已知 为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
__________ 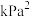 (列出计算式)。
(列出计算式)。
③平衡体系中 的物质的量分数随温度
的物质的量分数随温度 的变化如图,解释原因
的变化如图,解释原因__________ 。
 )、液氢等,常见氧化剂有
)、液氢等,常见氧化剂有 、液氧等。回答下列问题:
、液氧等。回答下列问题:(1)已知下列反应的热化学方程式如下:
ⅰ.
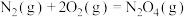
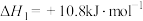
ⅱ.
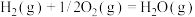
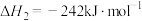
ⅲ.
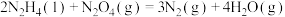
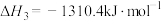
①则


 。
。②反应ⅲ可自发进行的原因是
③火箭推进器内氢氧燃烧的简化反应历程如图所示:
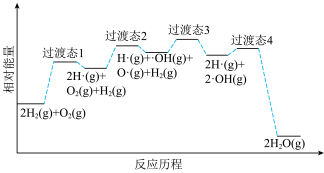
(2)利用甲烷和水蒸气催化制氢主要存在如下两个反应:
a:
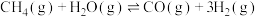
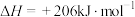
b:

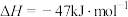
恒定压强为
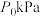 时,将物质的量之比为
时,将物质的量之比为 的
的 与
与 混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:物质 |
|
|
|
|
物质的量分数 | 0.04 | 0.32 | 0.50 | 0.08 |
 平衡转化率的是
平衡转化率的是A.提高
 与
与 的投料比 B.移除CO
的投料比 B.移除COC.选择合适的催化剂 D.恒温恒压下通入Ar气
②已知
 为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
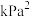 (列出计算式)。
(列出计算式)。③平衡体系中
 的物质的量分数随温度
的物质的量分数随温度 的变化如图,解释原因
的变化如图,解释原因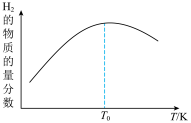
您最近一年使用:0次
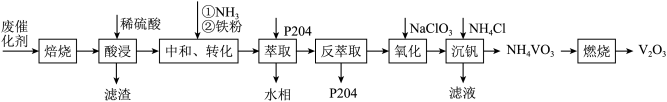
4 . 某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、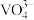 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,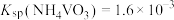
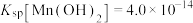


回答下列问题:
(1)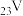 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中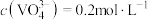 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中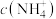 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,


回答下列问题:
(1)
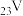 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是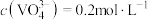 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中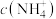 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。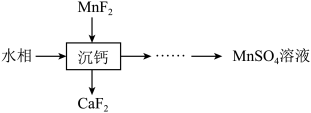
您最近一年使用:0次
名校
5 . 铋酸钠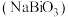 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,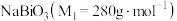 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;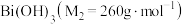 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题:_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
(3)装置B的作用为_______ 。
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是_______ 、过滤、洗涤、干燥。
(5) 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为_______ 。
(6)取上述 样品
样品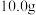 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的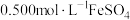 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为_______ ,假设终点时消耗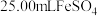 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为_______ %(结果保留小数点后一位)。
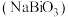 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,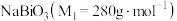 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;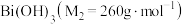 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题: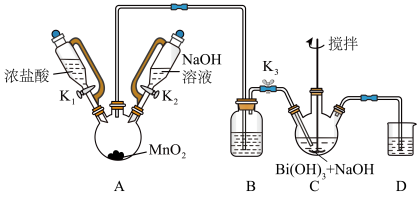
(2)装置C中发生反应的离子方程式为
(3)装置B的作用为
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是
(5)
 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为(6)取上述
 样品
样品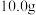 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的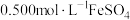 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为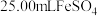 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为
您最近一年使用:0次
名校
解题方法
6 . A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是___________ ;A和C形成供氧剂的电子式___________ 。
(2) A、C、D、E离子半径由小到大的顺序为___________ 。(用离子符号表示)
(3)F的某种氯化物的饱和溶液滴加到沸水中可以形成胶体,写出此反应的化学反应方程式:___________ 。
(4)A和C形成的供氧剂与C的氢化物反应的化学方程式是:___________ 。
(5)E的单质与A的最高价氧化物的水化物反应的离子方程式为___________ 。
(6)红热的B单质与D的最高价氧化物对应水化物的浓溶液反应的化学方程式:___________ 。
| 元素 | 原子结构或性质 |
| A | 原子的最外层电子数是电子层数的 ,其含氧化合物可作为供氧剂 ,其含氧化合物可作为供氧剂 |
| B | 其形成的一种同位素原子在考古中可推测化石的年代 |
| C | 地壳中含量最多的元素 |
| D | 其单质位于火山口附近 |
| E | 与D同周期,且最外层电子数等于电子层数 |
| F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
(1)B在元素周期表中的位置是
(2) A、C、D、E离子半径由小到大的顺序为
(3)F的某种氯化物的饱和溶液滴加到沸水中可以形成胶体,写出此反应的化学反应方程式:
(4)A和C形成的供氧剂与C的氢化物反应的化学方程式是:
(5)E的单质与A的最高价氧化物的水化物反应的离子方程式为
(6)红热的B单质与D的最高价氧化物对应水化物的浓溶液反应的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 材料是经济增长与社会发展的重要物质基础,请回答下列问题。
(1)硅是重要的半导体材料,广泛应用于电子产品领域,工业上以硅石 为原料制备冶金级高纯硅的工艺流程如图所示:
为原料制备冶金级高纯硅的工艺流程如图所示: 室温下为易挥发、易水解的无色液体。
室温下为易挥发、易水解的无色液体。
①写出上述过程中氧化过程的化学方程式:___________ ;
② 极易水解且生成某种可燃性气体,写出化学反应方程式:
极易水解且生成某种可燃性气体,写出化学反应方程式:___________ ;
③上述工艺生产中需要在无水、无氧的条件下进行的操作有:___________ 。
(2)某MOFs多孔材料能高选择性吸附 ,其孔径大小和形状恰好将
,其孔径大小和形状恰好将 “固定”。废气中的
“固定”。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为 。原理示意图如下。
。原理示意图如下。
①写出反应中转化为 的化学反应方程式
的化学反应方程式___________ ;
②每生成 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为___________ 。
(3)甲醇是重要的化工原料之一,其制备和用途研究一直是化学工业热门研究方向。
工业上利用 和
和 合成甲醇,反应方程式为
合成甲醇,反应方程式为 ,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入
,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入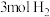 和
和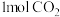 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如图所示。
浓度随时间变化如图所示。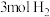 和
和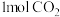 充分反应后,放出的能量
充分反应后,放出的能量___________ (填“>”“<”或“=”)89kJ;
②从0到10min,
___________ ;
③达到平衡时 的体积分数
的体积分数
___________ 。
(1)硅是重要的半导体材料,广泛应用于电子产品领域,工业上以硅石
 为原料制备冶金级高纯硅的工艺流程如图所示:
为原料制备冶金级高纯硅的工艺流程如图所示: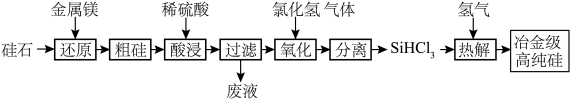
 室温下为易挥发、易水解的无色液体。
室温下为易挥发、易水解的无色液体。①写出上述过程中氧化过程的化学方程式:
②
 极易水解且生成某种可燃性气体,写出化学反应方程式:
极易水解且生成某种可燃性气体,写出化学反应方程式:③上述工艺生产中需要在无水、无氧的条件下进行的操作有:
(2)某MOFs多孔材料能高选择性吸附
 ,其孔径大小和形状恰好将
,其孔径大小和形状恰好将 “固定”。废气中的
“固定”。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为 。原理示意图如下。
。原理示意图如下。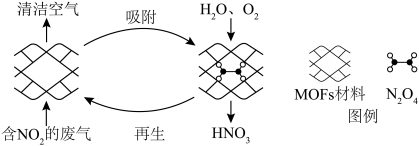

①写出反应中转化为
 的化学反应方程式
的化学反应方程式②每生成
 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为(3)甲醇是重要的化工原料之一,其制备和用途研究一直是化学工业热门研究方向。
工业上利用
 和
和 合成甲醇,反应方程式为
合成甲醇,反应方程式为 ,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入
,每生成1mol甲醇反应放出89kJ的能量,在一恒温恒容密闭容器中充入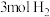 和
和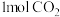 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如图所示。
浓度随时间变化如图所示。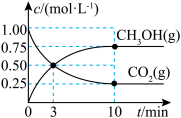
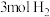 和
和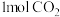 充分反应后,放出的能量
充分反应后,放出的能量②从0到10min,

③达到平衡时
 的体积分数
的体积分数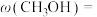
您最近一年使用:0次
名校
解题方法
8 . 碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上常以碲铜废料(主要成分是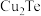 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下: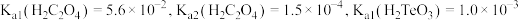 ,
,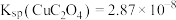 。
。
(1) 中碲元素的化合价为
中碲元素的化合价为_______ 。碲在元素周期表中的位置为_______ 。
(2)“氧化酸浸”得到 和
和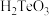 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)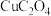 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为_______ 。(保留两位有效数字){已知:反应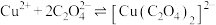 的平衡常数
的平衡常数 }
}
(4)“还原”在 50 ℃条件下进行: ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为_______ 。
(5)“还原”时, 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有_______ 。
(6)将一定质量的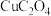 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为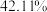 ,则剩余固体的化学式为
,则剩余固体的化学式为_______ 。
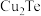 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下:
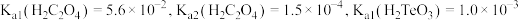 ,
,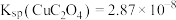 。
。(1)
 中碲元素的化合价为
中碲元素的化合价为(2)“氧化酸浸”得到
 和
和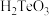 ,该反应的化学方程式为
,该反应的化学方程式为(3)
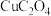 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为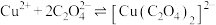 的平衡常数
的平衡常数 }
}(4)“还原”在 50 ℃条件下进行:
 ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为(5)“还原”时,
 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有(6)将一定质量的
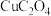 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为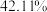 ,则剩余固体的化学式为
,则剩余固体的化学式为
您最近一年使用:0次
名校
9 . 尿素是一种重要化工生产原料。工业上以液氨和二氧化碳为原料,在高温高压条件下直接合成尿素,主要反应如下:
①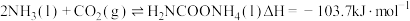
②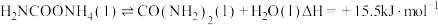
回答下列问题:
(1)
_______  。
。
(2)在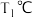 和
和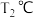 时
时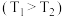 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: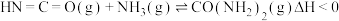 。
。
平衡时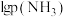 与
与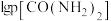 的关系如图所示,
的关系如图所示,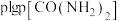 为物质的分压(单位为
为物质的分压(单位为 ),若
),若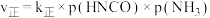 ,
,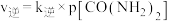 。
。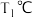 时,
时,
_______ 。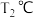 时此反应的标准平衡常数
时此反应的标准平衡常数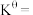
_______ 。{已知:分压 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: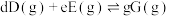 ,其中
,其中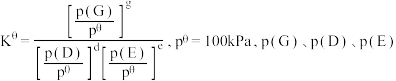 为各组分的平衡分压}
为各组分的平衡分压}_______ 。
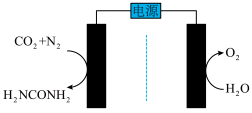
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源_______ 相连,其反应方程式为_______ 。
①
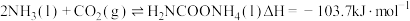
②
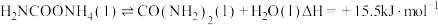
回答下列问题:
(1)

 。
。(2)在
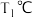 和
和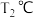 时
时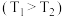 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: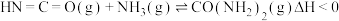 。
。平衡时
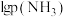 与
与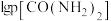 的关系如图所示,
的关系如图所示,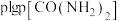 为物质的分压(单位为
为物质的分压(单位为 ),若
),若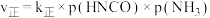 ,
,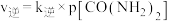 。
。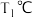 时,
时,
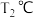 时此反应的标准平衡常数
时此反应的标准平衡常数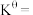
 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: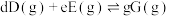 ,其中
,其中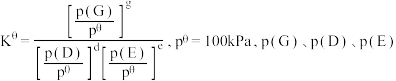 为各组分的平衡分压}
为各组分的平衡分压}
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源
您最近一年使用:0次
名校
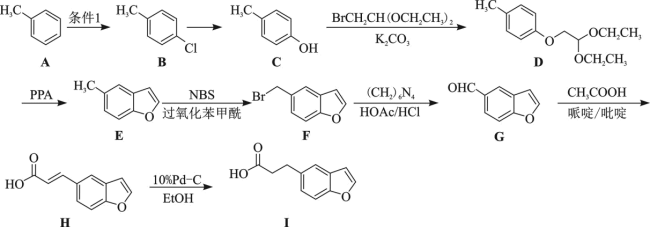
10 . 有机物I是制备治疗失眠症药物雷美替胺的中间体,可由甲苯经以下路线合成:
(1)C的名称为__________ ;F所含非含氧官能团的名称为__________ 。
(2)条件1是__________ ; 的反应类型是
的反应类型是__________ 。
(3)B在高温高压下与足量的氢氧化钠溶液反应的化学方程式为__________ 。
(4)1molE与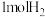 发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有
发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有__________ 种(不考虑立体异构);
①含有苯环且再无其它的环
②遇 溶液发生显色反应
溶液发生显色反应
(5)G生成H经历了加成反应和消去反应,反应过程如图所示:__________ 。
(1)C的名称为
(2)条件1是
 的反应类型是
的反应类型是(3)B在高温高压下与足量的氢氧化钠溶液反应的化学方程式为
(4)1molE与
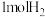 发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有
发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有①含有苯环且再无其它的环
②遇
 溶液发生显色反应
溶液发生显色反应(5)G生成H经历了加成反应和消去反应,反应过程如图所示:

您最近一年使用:0次