名校
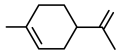
1 . Ⅰ 重庆奉节的脐橙闻名遐迩,从脐橙果皮中提取的橙油具有抗菌抑菌、抗氧化、祛痰平喘等多种作用,常用于医药、食品加工、日化等多个领域。橙油的主要成分是柠檬烯,其结构简式如下。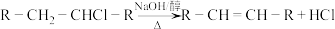 R为烃基或H
R为烃基或H
(1)柠檬烯的分子式______ ,官能团名称______ 。
(2)柠檬烯的一氯代物:______ 种。
(3)写出A→B的化学方程式:______ 。
(4)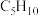 不属于烯烃的同分异构体有
不属于烯烃的同分异构体有______ 种。
(5)E的结构简式:______ 。
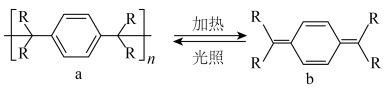
Ⅱ 高分子的循环利用过程如下图所示。______ 。
(7)b与 发生加成反应最多可生成
发生加成反应最多可生成______ 种二溴代物。

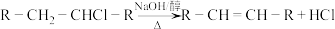 R为烃基或H
R为烃基或H(2)
(1)柠檬烯的分子式
(2)柠檬烯的一氯代物:
(3)写出A→B的化学方程式:
(4)
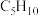 不属于烯烃的同分异构体有
不属于烯烃的同分异构体有(5)E的结构简式:
Ⅱ 高分子的循环利用过程如下图所示。
 (R为
(R为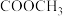 )
)
(7)b与
 发生加成反应最多可生成
发生加成反应最多可生成
您最近一年使用:0次
名校
2 . 肼( )是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
)是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
(1)火箭发射可以用肼(液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。
已知: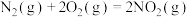
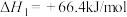
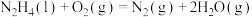
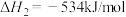
请写出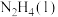 与
与 反应的热化学方程式
反应的热化学方程式______ 。
(2)向恒容密闭容器内加入一定量 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:
Ⅰ.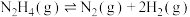
Ⅱ.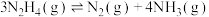
在较高温度肼几乎分解完全,分解产物的物质的量随温度变化如图:______ 。
②在较高温度肼几乎分解完全的原因可能是______ 。
③N点时,体系内 为
为______ 。
(3) 是二元弱碱,
是二元弱碱, 在水溶液中存在如下两步电离:
在水溶液中存在如下两步电离:
①
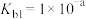 ;
;
②__________________________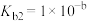 。
。
①写出 在水溶液中的第②步电离方程式:
在水溶液中的第②步电离方程式:______ 。
②25℃时,向 的水溶液中加入稀硫酸,欲使
的水溶液中加入稀硫酸,欲使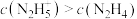 ,同时
,同时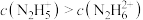 ,应控制溶液的
,应控制溶液的 范围为
范围为______ (用含a、b的式子表示)。
(4)利用 燃料电池电解
燃料电池电解 溶液并制备
溶液并制备 ,装置如图所示(
,装置如图所示(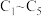 均为石墨电极,假设各装置在工作过程中溶液体积不变)。
均为石墨电极,假设各装置在工作过程中溶液体积不变)。 电极反应式为
电极反应式为______ 。
②若甲装置 电极上消耗标准状况下1.12L的
电极上消耗标准状况下1.12L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少______ g。
 )是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
)是一种强还原性的高能物质,在航天、能源等领域有广泛应用。(1)火箭发射可以用肼(液态)作燃料,
 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。已知:
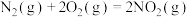
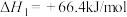
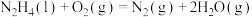
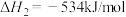
请写出
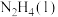 与
与 反应的热化学方程式
反应的热化学方程式(2)向恒容密闭容器内加入一定量
 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:Ⅰ.
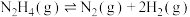
Ⅱ.
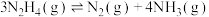
在较高温度肼几乎分解完全,分解产物的物质的量随温度变化如图:
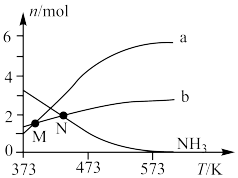
②在较高温度肼几乎分解完全的原因可能是
③N点时,体系内
 为
为(3)
 是二元弱碱,
是二元弱碱, 在水溶液中存在如下两步电离:
在水溶液中存在如下两步电离:①

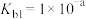 ;
;②__________________________
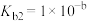 。
。①写出
 在水溶液中的第②步电离方程式:
在水溶液中的第②步电离方程式:②25℃时,向
 的水溶液中加入稀硫酸,欲使
的水溶液中加入稀硫酸,欲使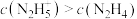 ,同时
,同时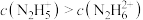 ,应控制溶液的
,应控制溶液的 范围为
范围为(4)利用
 燃料电池电解
燃料电池电解 溶液并制备
溶液并制备 ,装置如图所示(
,装置如图所示(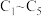 均为石墨电极,假设各装置在工作过程中溶液体积不变)。
均为石墨电极,假设各装置在工作过程中溶液体积不变)。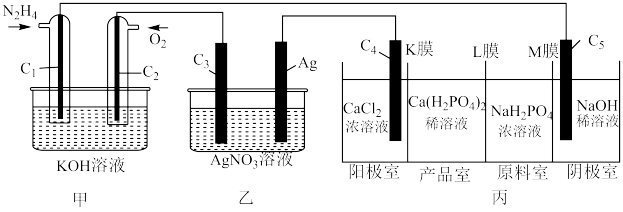
 电极反应式为
电极反应式为②若甲装置
 电极上消耗标准状况下1.12L的
电极上消耗标准状况下1.12L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少
您最近一年使用:0次
名校
解题方法
3 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有Li、B、C、N、P、Ni、Fe等元素。回答下列问题:
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是___________(填标号)。
(2)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。___________ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为___________ 。
③立方相氮化硼晶胞边长为apm,NA代表阿伏加德罗常数的值,则该晶体的密度为___________ g∙cm-3。
(3)FeSO4∙7H2O的结构如图所示,其中∠1、∠2、∠3由大到小的顺序是___________ 。___________ 。
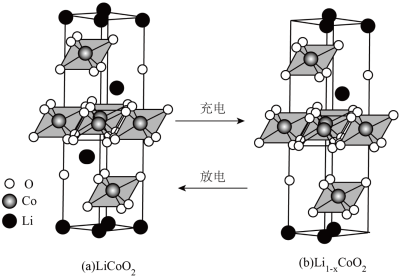
(5)锂离子电池具有可靠性高、寿命长、没有记忆效应等优势,能够提高飞船靠泊时间,是解决空间站问题的重要举措。正极材料LiCoO2的晶胞结构如图(a)(Li位于晶胞顶点和内部,部分O位于晶胞之外),每个晶胞中含有___________ 个O;充电时,LiCoO2脱出部分Li+,形成Li1-xCoO2,结构如图(b),则n(Co3+):n(Co4+)=___________ 。
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是___________(填标号)。
A.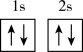 | B.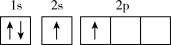 |
C. | D.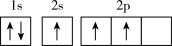 |
(2)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。
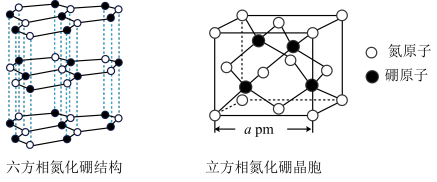
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
③立方相氮化硼晶胞边长为apm,NA代表阿伏加德罗常数的值,则该晶体的密度为
(3)FeSO4∙7H2O的结构如图所示,其中∠1、∠2、∠3由大到小的顺序是

(5)锂离子电池具有可靠性高、寿命长、没有记忆效应等优势,能够提高飞船靠泊时间,是解决空间站问题的重要举措。正极材料LiCoO2的晶胞结构如图(a)(Li位于晶胞顶点和内部,部分O位于晶胞之外),每个晶胞中含有
您最近一年使用:0次
名校
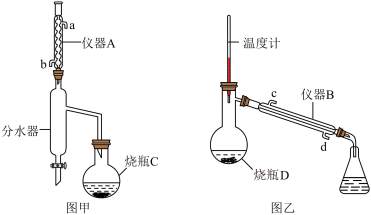
4 . 苯甲酸乙酯可用于配制香水香精和人造精油,还可以作为食用香精用于食品中。实验室可用苯甲酸与乙醇为原料制备苯甲酸乙酯,制备装置如图所示(部分装置已省略)
(2)制备方法:
①在烧瓶C中加入一定量的下列物质(如下表)。按图甲所示安装好装置,加热烧瓶C.反应一段时间后,停止加热。
②将烧瓶C中的反应液倒入盛有30mL水的烧杯中,加入Na2CO3至溶液呈中性。
③用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,二者合并,加入图乙的烧瓶D中,加入沸石并加入无水硫酸镁,加热蒸馏,制得产品2.6mL。回答下列问题:
(1)仪器A的名称是___________ 。
(2)苯甲酸与乙醇制备苯甲酸乙酯的化学方程式为___________ 。
(3)环己烷、乙醇与水可形成共沸物,沸点为62.1℃,烧瓶C的最佳加热方式是___________ 。分水器“分水”的过程为___________ 。
(4)Na2CO3的作用是___________ 。
(5)采用图乙装置进行蒸馏操作,加入无水硫酸镁的目的是___________ ,在锥形瓶中,收集___________ ℃的馏分。
(6)该制备方法中苯甲酸乙酯的产率是___________ 。
| 物质 | 乙醇 | 苯甲酸 | 环己烷 | 乙醚 | 苯甲酸乙酯 |
| 密度/( g∙cm-3) | 0.7893 | 1.2659 | 0.7785 | 0.7318 | 1.0500 |
| 熔点/℃ | -114.0 | 122.1 | 6.5 | -116.3 | -34.6 |
| 沸点/℃ | 78.5 | 249.0 | 80.0 | 34.5 | 211.0~213.0 |
①在烧瓶C中加入一定量的下列物质(如下表)。按图甲所示安装好装置,加热烧瓶C.反应一段时间后,停止加热。
| 物质 | 苯甲酸 | 乙醇 | 环己烷 | 浓硫酸 |
| 用量 | 2.44g |  |  |  |
③用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,二者合并,加入图乙的烧瓶D中,加入沸石并加入无水硫酸镁,加热蒸馏,制得产品2.6mL。回答下列问题:
(1)仪器A的名称是
(2)苯甲酸与乙醇制备苯甲酸乙酯的化学方程式为
(3)环己烷、乙醇与水可形成共沸物,沸点为62.1℃,烧瓶C的最佳加热方式是
(4)Na2CO3的作用是
(5)采用图乙装置进行蒸馏操作,加入无水硫酸镁的目的是
(6)该制备方法中苯甲酸乙酯的产率是
您最近一年使用:0次
名校
5 . 钼酸铵[(NH4)2MoO4]是生产高纯度钼制品、钼催化剂、钼颜料等的基本原料。一种以钼精矿(主要含MoS2,还含有少量SiO2、As、Sn、P、Cu、Pb、CaO)为原料制备钼酸铵的工艺流程如图所示: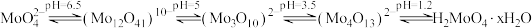 回答下列问题:
回答下列问题:
(1)锡为主族元素,在周期表中的位置是___________ ,(NH4)2MoO4中Mo元素的化合价为___________ 价。
(2)“氧化焙烧”时MoS2转化为MoO3,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(3)“除铜”时选择在60~80℃的条件下进行的原因为___________ 。
(4)“沉淀”过程中加入H2SO4调节溶液pH=2.1,则所得沉淀的化学式为___________ ,加入氨水后生成(NH4)2MoO4的化学方程式为___________ 。
(5)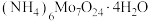 的热重曲线如图所示:
的热重曲线如图所示: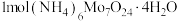 在A点失去H2O的物质的量为
在A点失去H2O的物质的量为___________ ,B点所得的物质为___________ (填化学式)。

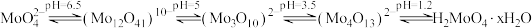 回答下列问题:
回答下列问题:(1)锡为主族元素,在周期表中的位置是
(2)“氧化焙烧”时MoS2转化为MoO3,该反应中氧化剂与还原剂的物质的量之比为
(3)“除铜”时选择在60~80℃的条件下进行的原因为
(4)“沉淀”过程中加入H2SO4调节溶液pH=2.1,则所得沉淀的化学式为
(5)
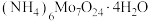 的热重曲线如图所示:
的热重曲线如图所示: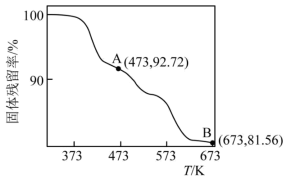
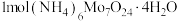 在A点失去H2O的物质的量为
在A点失去H2O的物质的量为
您最近一年使用:0次
名校
6 . 我国将力争在2030年前实现碳达峰,2060年前实现碳中和的目标,因此二氧化碳的固定以及转化将成为重要的研究课题。
I.在 催化下CO2和H2反应生成甲醇:
催化下CO2和H2反应生成甲醇: 。
。
II.新型 水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。
水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。
请回答下列问题:
(1)I中涉及的CO2、H2、CH3OH、H2O,属于非极性分子的是___________ ,基态O原子核外有___________ 种不同空间运动状态的电子。
(2)HCOOH分子中σ键和π键数目之比为___________ 。
(3)反应 中,碳原子的杂化方式由
中,碳原子的杂化方式由___________ 转变为___________ 。CH3OH的沸点高于CH3SH,原因是___________ 。
(4)一种铜的配合物为 ,其配体为
,其配体为___________ 。
I.在
 催化下CO2和H2反应生成甲醇:
催化下CO2和H2反应生成甲醇: 。
。II.新型
 水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。
水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。请回答下列问题:
(1)I中涉及的CO2、H2、CH3OH、H2O,属于非极性分子的是
(2)HCOOH分子中σ键和π键数目之比为
(3)反应
 中,碳原子的杂化方式由
中,碳原子的杂化方式由(4)一种铜的配合物为
 ,其配体为
,其配体为
您最近一年使用:0次
7 .  在冶金、化工、电子等多个领域有着广泛的应用,以硫酸工业产生的废钒催化剂为原料(含
在冶金、化工、电子等多个领域有着广泛的应用,以硫酸工业产生的废钒催化剂为原料(含 、
、 、
、 、
、 以及少量的
以及少量的 等)制备
等)制备 的工艺流程如下。
的工艺流程如下。 、
、 形式存在,
形式存在, 较大时
较大时 可转化为
可转化为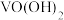 沉淀,
沉淀,
(1) 中
中 为
为___________ (填“过渡元素”或“主族元素”)。
(2)“酸浸还原”过程中。
①硫酸的用量会影响钒的浸出率, 需保持在1.2以下,说明原因
需保持在1.2以下,说明原因___________ 。
②写出 发生反应的离子方程式
发生反应的离子方程式___________ 。
③除 被还原外,写出还可能被还原的离子
被还原外,写出还可能被还原的离子___________ (写离子符号)。
④若以磷酸为介质处理废钒催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如下图所示,形成配位键时 提供
提供___________ (填“孤对电子”或“空轨道”)。 (有机层)
(有机层) (有几层),则“反萃取”进行的条件是
(有几层),则“反萃取”进行的条件是___________ (填“酸性”“中性”或“碱性”)。
(4)从上述流程中___________ (填“滤渣”“水溶液”或“滤液”)中可提取回收 。
。
(5)若“焙烧”时得到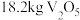 ,计算理论上消耗空气中的
,计算理论上消耗空气中的 在标准状况下的体积
在标准状况下的体积___________ ( ,不要求计算过程)。
,不要求计算过程)。
 在冶金、化工、电子等多个领域有着广泛的应用,以硫酸工业产生的废钒催化剂为原料(含
在冶金、化工、电子等多个领域有着广泛的应用,以硫酸工业产生的废钒催化剂为原料(含 、
、 、
、 、
、 以及少量的
以及少量的 等)制备
等)制备 的工艺流程如下。
的工艺流程如下。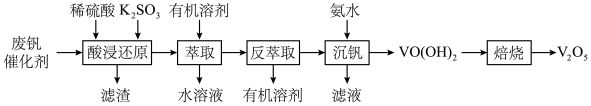
 、
、 形式存在,
形式存在, 较大时
较大时 可转化为
可转化为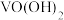 沉淀,
沉淀,(1)
 中
中 为
为(2)“酸浸还原”过程中。
①硫酸的用量会影响钒的浸出率,
 需保持在1.2以下,说明原因
需保持在1.2以下,说明原因②写出
 发生反应的离子方程式
发生反应的离子方程式③除
 被还原外,写出还可能被还原的离子
被还原外,写出还可能被还原的离子④若以磷酸为介质处理废钒催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如下图所示,形成配位键时
 提供
提供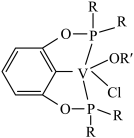
 (有机层)
(有机层)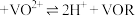 (有几层),则“反萃取”进行的条件是
(有几层),则“反萃取”进行的条件是(4)从上述流程中
 。
。(5)若“焙烧”时得到
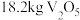 ,计算理论上消耗空气中的
,计算理论上消耗空气中的 在标准状况下的体积
在标准状况下的体积 ,不要求计算过程)。
,不要求计算过程)。
您最近一年使用:0次
解题方法
8 . 佐米曲坦(化合物 )是治疗偏头疼的药物,其合成路线之一如下(部分反应条件省略):
)是治疗偏头疼的药物,其合成路线之一如下(部分反应条件省略): 的化学名称
的化学名称___________ ;写出 中含氧官能团的名称
中含氧官能团的名称___________ 。
(2)写出 的反应类型
的反应类型___________ 。
(3)写出 反应的化学方程式
反应的化学方程式___________ 。
(4)在一定条件下, 发生加聚反应可制得导电聚合物,写出其反应的化学方程式
发生加聚反应可制得导电聚合物,写出其反应的化学方程式___________ 。
(5)同时满足下列条件的 的同分异构体有
的同分异构体有___________ 种(不考虑立体异构)。
③既能发生水解反应也能发生银镜反应。
写出核磁共振氢谱有6组峰,且峰面积之比为3:2:2:2:1:1的结构简式___________ (任写一种)。
 )是治疗偏头疼的药物,其合成路线之一如下(部分反应条件省略):
)是治疗偏头疼的药物,其合成路线之一如下(部分反应条件省略):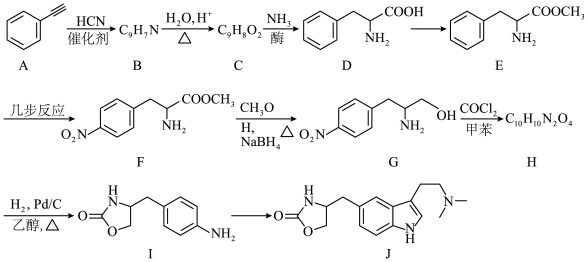
 的化学名称
的化学名称 中含氧官能团的名称
中含氧官能团的名称(2)写出
 的反应类型
的反应类型(3)写出
 反应的化学方程式
反应的化学方程式(4)在一定条件下,
 发生加聚反应可制得导电聚合物,写出其反应的化学方程式
发生加聚反应可制得导电聚合物,写出其反应的化学方程式(5)同时满足下列条件的
 的同分异构体有
的同分异构体有①含有
③既能发生水解反应也能发生银镜反应。
写出核磁共振氢谱有6组峰,且峰面积之比为3:2:2:2:1:1的结构简式
您最近一年使用:0次
9 . 近些年,全球变暖明显,尽快实现碳达峰、碳中和成为紧迫目标。为实现该目标,一方面要减少 的排放量,另一方面可以利用
的排放量,另一方面可以利用 参与反应,实现能源再生。
参与反应,实现能源再生。
(1) 催化加氢制甲醇能有效利用
催化加氢制甲醇能有效利用 资源,涉及的反应如下:
资源,涉及的反应如下:
反应Ⅰ:

反应Ⅱ:
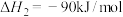
①写出 催化加氢直接合成甲醇反应的热化学方程式
催化加氢直接合成甲醇反应的热化学方程式___________ ,写出该反应能自发进行的条件___________ 。
②其他条件相同时, 催化加氢制甲醇,
催化加氢制甲醇, 的平衡总转化率随着反应温度的升高先减小后增大,说明原因
的平衡总转化率随着反应温度的升高先减小后增大,说明原因___________ 。
(2) 与烷烃的耦合反应有利于减少空气中
与烷烃的耦合反应有利于减少空气中 含量,已知
含量,已知 与
与 发生耦合反应时涉及的反应如下:
发生耦合反应时涉及的反应如下:
反应Ⅰ:
反应Ⅱ: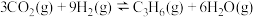
反应Ⅲ:
①在恒温恒容密闭容器中充入一定量的 ,若只发生反应Ⅰ,达到平衡时压强增大
,若只发生反应Ⅰ,达到平衡时压强增大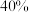 ,计算平衡时
,计算平衡时 的转化率
的转化率___________ (不要求计算过程)。
②在某恒温恒压的容器中充入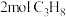 和
和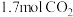 ,达平衡后,容器中
,达平衡后,容器中 、
、 、
、 分别为
分别为 、
、 、
、 ,反应III的压力平衡常数
,反应III的压力平衡常数 ,计算平衡时容器中
,计算平衡时容器中 的物质的量
的物质的量___________ (不要求计算过程)。
③为提高丙烷与 耦合过程中
耦合过程中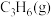 的产率,写出采取的措施
的产率,写出采取的措施___________ (请举一例)。
(3)一种二甲醚和 直接制备碳酸二甲酯(
直接制备碳酸二甲酯( )的电化学方法如下图所示。
)的电化学方法如下图所示。 电极连接的直流电源的电极名称
电极连接的直流电源的电极名称___________ ,写出 电极的电极反应式
电极的电极反应式___________ 。
 的排放量,另一方面可以利用
的排放量,另一方面可以利用 参与反应,实现能源再生。
参与反应,实现能源再生。(1)
 催化加氢制甲醇能有效利用
催化加氢制甲醇能有效利用 资源,涉及的反应如下:
资源,涉及的反应如下:反应Ⅰ:


反应Ⅱ:

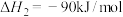
①写出
 催化加氢直接合成甲醇反应的热化学方程式
催化加氢直接合成甲醇反应的热化学方程式②其他条件相同时,
 催化加氢制甲醇,
催化加氢制甲醇, 的平衡总转化率随着反应温度的升高先减小后增大,说明原因
的平衡总转化率随着反应温度的升高先减小后增大,说明原因(2)
 与烷烃的耦合反应有利于减少空气中
与烷烃的耦合反应有利于减少空气中 含量,已知
含量,已知 与
与 发生耦合反应时涉及的反应如下:
发生耦合反应时涉及的反应如下:反应Ⅰ:

反应Ⅱ:
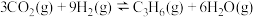
反应Ⅲ:

①在恒温恒容密闭容器中充入一定量的
 ,若只发生反应Ⅰ,达到平衡时压强增大
,若只发生反应Ⅰ,达到平衡时压强增大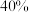 ,计算平衡时
,计算平衡时 的转化率
的转化率②在某恒温恒压的容器中充入
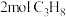 和
和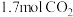 ,达平衡后,容器中
,达平衡后,容器中 、
、 、
、 分别为
分别为 、
、 、
、 ,反应III的压力平衡常数
,反应III的压力平衡常数 ,计算平衡时容器中
,计算平衡时容器中 的物质的量
的物质的量③为提高丙烷与
 耦合过程中
耦合过程中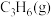 的产率,写出采取的措施
的产率,写出采取的措施(3)一种二甲醚和
 直接制备碳酸二甲酯(
直接制备碳酸二甲酯( )的电化学方法如下图所示。
)的电化学方法如下图所示。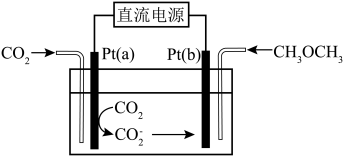
 电极连接的直流电源的电极名称
电极连接的直流电源的电极名称 电极的电极反应式
电极的电极反应式
您最近一年使用:0次
解题方法
10 . 亚氯酸钠 和
和 都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
(1)用 和硫酸酸化的草酸
和硫酸酸化的草酸 反应可制得
反应可制得 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(2)用二氧化氯 可制备用途广泛的亚氯酸钠
可制备用途广泛的亚氯酸钠 ,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。 沸点为
沸点为 ,可溶于水,有毒,浓度较高时易发生爆炸。
,可溶于水,有毒,浓度较高时易发生爆炸。
② 饱和溶液高于
饱和溶液高于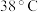 时析出
时析出 ,高于
,高于 时
时 分解为
分解为 和
和 。
。
①实验过程中需持续通入一定量的 ,说明原因
,说明原因___________ ;反应结束后需再通入一定量的 ,说明原因
,说明原因___________ 。
②写出装置 中的化学反应方程式
中的化学反应方程式___________ 。
③通入 中的
中的 与
与 中物质恰好完全反应,若从反应后的溶液中得到
中物质恰好完全反应,若从反应后的溶液中得到 固体,写出实验操作的方法
固体,写出实验操作的方法___________ 。
(3)某水样用 处理后,有少量
处理后,有少量 残留在水中,可用碘量法检测。
残留在水中,可用碘量法检测。
①取 水样,加入过量的
水样,加入过量的 ,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出
,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出 与
与 反应的离子方程式
反应的离子方程式___________ 。
②已知: ,向所得溶液中加入适量
,向所得溶液中加入适量 溶液,将溶液调节为弱酸性,再用
溶液,将溶液调节为弱酸性,再用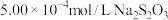 标准溶液进行滴定,恰好反应时消耗
标准溶液进行滴定,恰好反应时消耗 溶液
溶液 。计算水样中
。计算水样中 的浓度
的浓度___________ (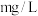 ,不要求计算过程)。
,不要求计算过程)。
 和
和 都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。(1)用
 和硫酸酸化的草酸
和硫酸酸化的草酸 反应可制得
反应可制得 ,写出该反应的离子方程式
,写出该反应的离子方程式(2)用二氧化氯
 可制备用途广泛的亚氯酸钠
可制备用途广泛的亚氯酸钠 ,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
 沸点为
沸点为 ,可溶于水,有毒,浓度较高时易发生爆炸。
,可溶于水,有毒,浓度较高时易发生爆炸。②
 饱和溶液高于
饱和溶液高于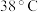 时析出
时析出 ,高于
,高于 时
时 分解为
分解为 和
和 。
。①实验过程中需持续通入一定量的
 ,说明原因
,说明原因 ,说明原因
,说明原因②写出装置
 中的化学反应方程式
中的化学反应方程式③通入
 中的
中的 与
与 中物质恰好完全反应,若从反应后的溶液中得到
中物质恰好完全反应,若从反应后的溶液中得到 固体,写出实验操作的方法
固体,写出实验操作的方法(3)某水样用
 处理后,有少量
处理后,有少量 残留在水中,可用碘量法检测。
残留在水中,可用碘量法检测。①取
 水样,加入过量的
水样,加入过量的 ,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出
,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出 与
与 反应的离子方程式
反应的离子方程式②已知:
 ,向所得溶液中加入适量
,向所得溶液中加入适量 溶液,将溶液调节为弱酸性,再用
溶液,将溶液调节为弱酸性,再用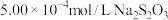 标准溶液进行滴定,恰好反应时消耗
标准溶液进行滴定,恰好反应时消耗 溶液
溶液 。计算水样中
。计算水样中 的浓度
的浓度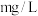 ,不要求计算过程)。
,不要求计算过程)。
您最近一年使用:0次



