名校
解题方法
1 . 回答下列问题:
(1)室温下,2 mol H2完全燃烧生成液态水放出a kJ的能量,写出氢气燃烧热的热化学方程式:_______ 。
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇。其常见合成方法为:CO(g)+2H2(g)=CH3OH(g) ΔH,已知反应①中相关的化学键键能数据如下:
由此计算ΔH =_______ kJ/mol;
(3)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol。
现有H2与CH4的混合气体112 L (标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8 kJ,则原混合气体中H2与CH4的物质的量之比是_______ 。
(4)一定条件下,在水溶液中所含离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
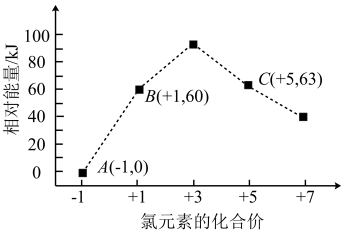
则反应3ClO-(aq) =ClO (aq)+2Cl-(aq)的ΔH=
(aq)+2Cl-(aq)的ΔH=_______ kJ/mol。
(5)乙烷在一定条件可发生反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
ΔH=_______ kJ/mol。
(6)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ/mol
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ/mol
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_______ 。
(7)在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+ O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
2S(g)=S2(g) ΔH4,则ΔH4的正确表达式为_______ 。
(1)室温下,2 mol H2完全燃烧生成液态水放出a kJ的能量,写出氢气燃烧热的热化学方程式:
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇。其常见合成方法为:CO(g)+2H2(g)=CH3OH(g) ΔH,已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E /(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
(3)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol。
现有H2与CH4的混合气体112 L (标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8 kJ,则原混合气体中H2与CH4的物质的量之比是
(4)一定条件下,在水溶液中所含离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
则反应3ClO-(aq) =ClO
 (aq)+2Cl-(aq)的ΔH=
(aq)+2Cl-(aq)的ΔH=(5)乙烷在一定条件可发生反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/(kJ/mol ) | -1560 | -1411 | -286 |
(6)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ/mol
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ/mol
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
(7)在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+
 O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1②2H2S(g)+SO2(g)=
 S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2③H2S(g)+
 O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH32S(g)=S2(g) ΔH4,则ΔH4的正确表达式为
您最近一年使用:0次
名校
解题方法
2 . 已知水在25℃和100℃时的电离平衡曲线如图所示。
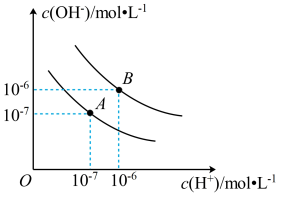
(1)25℃时水的电离平衡曲线应为_______ (填“A”或“B”)。25℃时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ 。
(2)100℃时,若10体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_______ 。
(3)在曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用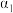 、
、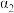 表示,则
表示,则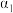
_______ 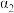 (填“大于”“小于”“等于”或“无法确定”,下同);若将二者等体积混合,则混合液的pH
(填“大于”“小于”“等于”或“无法确定”,下同);若将二者等体积混合,则混合液的pH_______ 7,判断的理由是_______ 。
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=_______ 。

(1)25℃时水的电离平衡曲线应为
(2)100℃时,若10体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
(3)在曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用
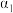 、
、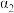 表示,则
表示,则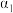
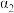 (填“大于”“小于”“等于”或“无法确定”,下同);若将二者等体积混合,则混合液的pH
(填“大于”“小于”“等于”或“无法确定”,下同);若将二者等体积混合,则混合液的pH(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
您最近一年使用:0次
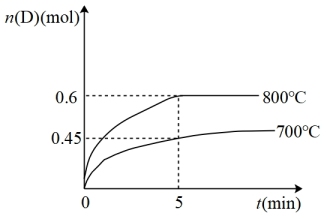
3 . 在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为_______ 。
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=_______ ,该反应为_______ 反应(填“吸热”或“放热”)。
(4)已知 2CH3OH(g) CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
①判断该反应的∆H_______ 0(填“>”、“<”或“=”)。若此时系统温度400℃,比较正、逆反应速率的大小:υ正_______ υ逆(填“>”、“<”或“=”)。
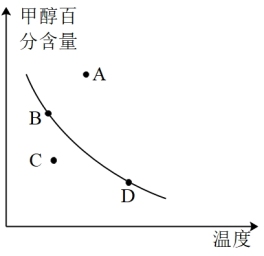
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中_______ 点,比较图中B、D两点所对应的正反应速率B_______ D(填“>”、“<”或“=”)。
 C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
| A.容器中压强不变 | B.混合气体中c(A)不变 |
| C.v正(B)=2v逆(D) | D.c(A)=c(C) |
(4)已知 2CH3OH(g)
 CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol·L-1) | 0.54 | 0 68 68 | 0.68 |
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中
您最近一年使用:0次
解题方法
4 . 完成下列各题
(1)一氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,反应原理为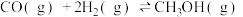
 。若已知CO、
。若已知CO、 、
、 的燃烧热分别为
的燃烧热分别为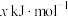 、
、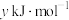 、
、 ,则
,则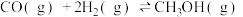

______ 。
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为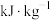 。已知下列物质的燃烧热(25℃、101Kpa):
。已知下列物质的燃烧热(25℃、101Kpa):
据上表数据计算:
①试写出表示辛烷燃烧热的热化学方程式:_______________________________________ 。
② 的热值为
的热值为______ 。(保留3位有效数字)
③上表所列燃料的热值最大的是______________________ (填化学式)。
(3)中和热是反应热的一种。
①取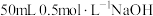 溶液和
溶液和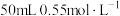 盐酸溶液进行实验,若实验测得的反应前后温度差平均值
盐酸溶液进行实验,若实验测得的反应前后温度差平均值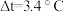 。若近似认为
。若近似认为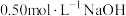 溶液和
溶液和 盐酸溶液的密度都是
盐酸溶液的密度都是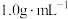 ,中和后生成溶液的比热容
,中和后生成溶液的比热容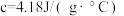 ,则生成
,则生成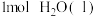 时的反应热
时的反应热
______ (取小数点后一位)。
②强酸与强碱的稀溶液发生中和反应生成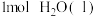 时的反应热
时的反应热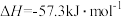 。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为______ (取小数点后一位)。
(1)一氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,反应原理为
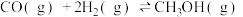
 。若已知CO、
。若已知CO、 、
、 的燃烧热分别为
的燃烧热分别为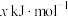 、
、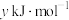 、
、 ,则
,则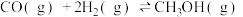

(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为
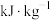 。已知下列物质的燃烧热(25℃、101Kpa):
。已知下列物质的燃烧热(25℃、101Kpa):| 燃料 |  | CO |  | 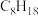 (辛烷) (辛烷) |
燃烧热/ | 285.8 | 283.0 | 890.3 | 5518 |
据上表数据计算:
①试写出表示辛烷燃烧热的热化学方程式:
②
 的热值为
的热值为③上表所列燃料的热值最大的是
(3)中和热是反应热的一种。
①取
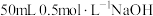 溶液和
溶液和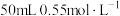 盐酸溶液进行实验,若实验测得的反应前后温度差平均值
盐酸溶液进行实验,若实验测得的反应前后温度差平均值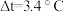 。若近似认为
。若近似认为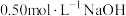 溶液和
溶液和 盐酸溶液的密度都是
盐酸溶液的密度都是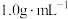 ,中和后生成溶液的比热容
,中和后生成溶液的比热容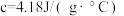 ,则生成
,则生成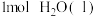 时的反应热
时的反应热
②强酸与强碱的稀溶液发生中和反应生成
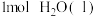 时的反应热
时的反应热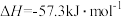 。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为
您最近一年使用:0次
解题方法
5 . 完成下列各题:
(1)磷的一种化合物叫亚磷酸( )。已知:
)。已知:
(i)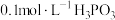 溶液的
溶液的 ;
;
(ii) 与NaOH反应只生成
与NaOH反应只生成 和
和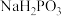 ;
;
(iii) 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加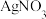 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。
①关于 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是______ 。(填序号)
A.bdf B.ade C.bcf D. bce
②Na2HPO3为__________ (填“正盐”或“酸式盐”)
(2)常温下,氨水的pH>7,用离子方程式解释其原因:_____________________________ 。
(3)25℃时, 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。
①加水稀释至相同的倍数,此时 溶液的pH
溶液的pH______ (填“大于”“小于”或“等于”)盐酸的pH。
②加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
(4)常温下, 溶液中
溶液中
______ (用含 和
和 的代数式表示)。
的代数式表示)。
(5)25℃时,现有 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水______ mL;如果加入 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液______ mL(假定溶液体积有加和性,下同)。
(6)某温度下,纯水中的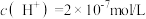 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为______ mol/L。
(1)磷的一种化合物叫亚磷酸(
 )。已知:
)。已知:(i)
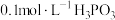 溶液的
溶液的 ;
;(ii)
 与NaOH反应只生成
与NaOH反应只生成 和
和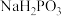 ;
;(iii)
 和碘水反应,碘水棕黄色褪去,再加
和碘水反应,碘水棕黄色褪去,再加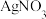 溶液有黄色沉淀生成。
溶液有黄色沉淀生成。①关于
 的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是
的说法:a.强酸;b.弱酸;c.二元酸;d.三元酸;e.氧化性酸;f.还原性酸,其中正确的是A.bdf B.ade C.bcf D. bce
②Na2HPO3为
(2)常温下,氨水的pH>7,用离子方程式解释其原因:
(3)25℃时,
 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。①加水稀释至相同的倍数,此时
 溶液的pH
溶液的pH②加水稀释至相同的pH,此时加入
 溶液中水的体积
溶液中水的体积(4)常温下,
 溶液中
溶液中
 和
和 的代数式表示)。
的代数式表示)。(5)25℃时,现有
 的HCl溶液100mL,要使它的
的HCl溶液100mL,要使它的 ,如果加入蒸馏水,需加水
,如果加入蒸馏水,需加水 的HCl溶液,需加入此HCl溶液
的HCl溶液,需加入此HCl溶液(6)某温度下,纯水中的
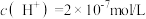 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
名校
6 . 磷的含氧酸有次磷酸 、亚磷酸
、亚磷酸 、磷酸
、磷酸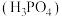 等多种,它们都是重要的化工原料。
等多种,它们都是重要的化工原料。
(1)已知次磷酸 的水溶液中存在
的水溶液中存在 分子,
分子, 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为
溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为___________ ,生成的盐属于___________ (填“正盐”或“酸式盐”)。
(2)查阅资料知25℃时,亚磷酸 的
的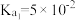 ,
,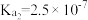 。25℃时,
。25℃时, 水解反应的
水解反应的
___________ (填数值);向 溶液中滴加
溶液中滴加 溶液,恰好完全反应时所得溶液的
溶液,恰好完全反应时所得溶液的
___________ 7(填“>”、“<”或“=”,下同);若用甲基橙做指示剂,用 溶液滴定,达到滴定终点时所得溶液的
溶液滴定,达到滴定终点时所得溶液的
____  。
。
(3)磷酸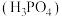 在水溶液中各种微粒的物质的量分数
在水溶液中各种微粒的物质的量分数 随
随 的变化曲线如图所示:
的变化曲线如图所示:

①向某浓度的磷酸溶液中滴加 溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是
溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是____ 。
②25℃条件下测得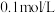 的
的 溶液的
溶液的 ,则
,则 的第一步水解的水解常数
的第一步水解的水解常数
____ (忽略 的第二、第三步水解,结果保留两位有效数字)。
的第二、第三步水解,结果保留两位有效数字)。
③从图中推断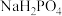 溶液中各种微粒浓度大小关系正确的是
溶液中各种微粒浓度大小关系正确的是____ 。(填字母)
A.
B.
C.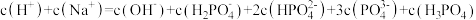
D.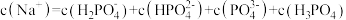
 、亚磷酸
、亚磷酸 、磷酸
、磷酸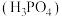 等多种,它们都是重要的化工原料。
等多种,它们都是重要的化工原料。(1)已知次磷酸
 的水溶液中存在
的水溶液中存在 分子,
分子, 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为
溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为(2)查阅资料知25℃时,亚磷酸
 的
的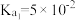 ,
,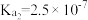 。25℃时,
。25℃时, 水解反应的
水解反应的
 溶液中滴加
溶液中滴加 溶液,恰好完全反应时所得溶液的
溶液,恰好完全反应时所得溶液的
 溶液滴定,达到滴定终点时所得溶液的
溶液滴定,达到滴定终点时所得溶液的
 。
。(3)磷酸
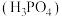 在水溶液中各种微粒的物质的量分数
在水溶液中各种微粒的物质的量分数 随
随 的变化曲线如图所示:
的变化曲线如图所示:
①向某浓度的磷酸溶液中滴加
 溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是
溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是②25℃条件下测得
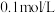 的
的 溶液的
溶液的 ,则
,则 的第一步水解的水解常数
的第一步水解的水解常数
 的第二、第三步水解,结果保留两位有效数字)。
的第二、第三步水解,结果保留两位有效数字)。③从图中推断
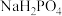 溶液中各种微粒浓度大小关系正确的是
溶液中各种微粒浓度大小关系正确的是A.

B.

C.
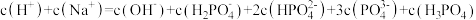
D.
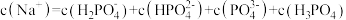
您最近一年使用:0次
名校
解题方法
7 . 芳香化合物在一定条件下可与卤代烃发生取代反应。某科研小组以苯、ClCCH3)3为反应物,无水AlCl3为催化剂,制备 (叔丁基苯)。反应原理如下:
(叔丁基苯)。反应原理如下:
 +ClC(CH3)3
+ClC(CH3)3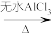
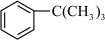 +HCl
+HCl
已知:
I.实验室模拟制备无水AlCl3的实验装置如图I所示:
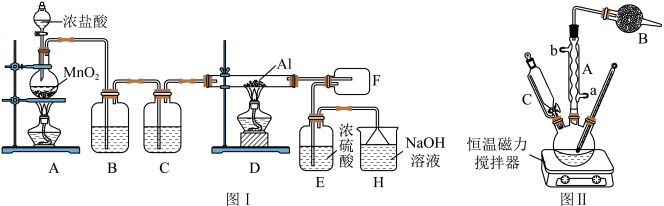
(1)写出装置A中发生反应的化学方程式:_____________ 。
(2)装置B中的试剂为_____________ ;加热顺序:应先点燃________ (填“A”或“D”)处酒精灯。
Ⅱ.实验室制取叔丁基苯的装置如图II所示:
①将35mL苯和足量的无水AlCl3加入三颈烧瓶中;
②滴加氯代叔丁烷[ClC(CH3)3]10mL;
③打开恒温磁力搅拌器反应一段时间;
④洗涤,将反应后的混合物依次用稀盐酸、Na2CO3溶液、H2O洗涤分离;
⑤在所得产物中加入少量无水MgSO4固体、静置,过滤,蒸馏;
⑥称量,得到叔丁基苯10.0g。
(1)用稀盐酸洗涤的目的是________________ ,“洗涤”后“分离”的操作名称是________ 。
(2)加无水MgSO4固体的作用是__________ ,蒸馏时为得到较为纯净的叔丁基苯,应选取蒸气温度在___________ 摄氏度左右的馏分。
(3)叔丁基苯的产率为___________ %(保留至小数点后1位)。
(4)叔丁基苯可以通过一系列反应制备对叔丁基苯甲酸和对叔丁基苯甲酸甲酯,二者均在工业上有重要用途。
①若要分离出未反应完的叔丁基苯进行回收利用(其中含有少量对叔丁基苯甲酸),可选用的实验方案为__________ 。
a.水;分液b.CCl4;蒸馏c.NaOH溶液;蒸馏d.NaOH溶液;分液
②对叔丁基苯甲酸甲酯广泛用于制化妆品、药品,请写出对叔丁基苯甲酸与甲醇反应制备对叔丁基苯甲酸甲酯的化学方程式____________________________________ 。
 (叔丁基苯)。反应原理如下:
(叔丁基苯)。反应原理如下: +ClC(CH3)3
+ClC(CH3)3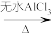
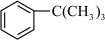 +HCl
+HCl已知:
相对分子质量 | 密度/g·cm–3 | 沸点/℃ | 溶解性 | |
AlCl3 | 133.5 | 2.41 | 181 | 极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | 80.1 | 难溶于水 |
ClC(CH3)3 | 92.5 | 0.85 | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | 169 | 难溶于水,易溶于苯 |

(1)写出装置A中发生反应的化学方程式:
(2)装置B中的试剂为
Ⅱ.实验室制取叔丁基苯的装置如图II所示:
①将35mL苯和足量的无水AlCl3加入三颈烧瓶中;
②滴加氯代叔丁烷[ClC(CH3)3]10mL;
③打开恒温磁力搅拌器反应一段时间;
④洗涤,将反应后的混合物依次用稀盐酸、Na2CO3溶液、H2O洗涤分离;
⑤在所得产物中加入少量无水MgSO4固体、静置,过滤,蒸馏;
⑥称量,得到叔丁基苯10.0g。
(1)用稀盐酸洗涤的目的是
(2)加无水MgSO4固体的作用是
(3)叔丁基苯的产率为
(4)叔丁基苯可以通过一系列反应制备对叔丁基苯甲酸和对叔丁基苯甲酸甲酯,二者均在工业上有重要用途。
①若要分离出未反应完的叔丁基苯进行回收利用(其中含有少量对叔丁基苯甲酸),可选用的实验方案为
a.水;分液b.CCl4;蒸馏c.NaOH溶液;蒸馏d.NaOH溶液;分液
②对叔丁基苯甲酸甲酯广泛用于制化妆品、药品,请写出对叔丁基苯甲酸与甲醇反应制备对叔丁基苯甲酸甲酯的化学方程式
您最近一年使用:0次
9-10高一下·江苏南通·期中
8 . 1体积某烃的蒸气完全燃烧生成的CO2比H2O(g)少1体积(同温同压下测定),0.1mol该烃完全燃烧的产物被碱石灰吸收后,碱石灰增重39g。
(1)求该烃的分子式___ 。
(2)已知该烃的一氯代物有3种,请写出该烃的结构简式且命名___ 。
(1)求该烃的分子式
(2)已知该烃的一氯代物有3种,请写出该烃的结构简式且命名
您最近一年使用:0次
名校
9 . (1)常温下,0.05 mol/L Ba(OH)2溶液中c(OH-)= _____ ,pH=______ 。
(2)某温度下,纯水中的c(H+)= 2×10-7mol/L,则此时溶液中的c(OH-)=____ ;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4 mol/L,则溶液中c(OH-)=____ ,此时溶液中由水电离产生的c(H+)= _____ 。
(3)已知:lg2=0.3,lg3=0.5,lg5=0.7。常温时,将pH为5的HCl溶液与pH为2的H2SO4溶液等体积混合,混合后溶液的pH约为___________ 。
(4)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈______ (填“酸性”,“中性”或“碱性”)。
(5)25℃时,已知 HF 的电离常数为3.6×10-4,H3PO4的电离常数K1 =7.5×10-3,K2=6.2×10-8,K3 =4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为_______________________________ 。
(2)某温度下,纯水中的c(H+)= 2×10-7mol/L,则此时溶液中的c(OH-)=
(3)已知:lg2=0.3,lg3=0.5,lg5=0.7。常温时,将pH为5的HCl溶液与pH为2的H2SO4溶液等体积混合,混合后溶液的pH约为
(4)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
(5)25℃时,已知 HF 的电离常数为3.6×10-4,H3PO4的电离常数K1 =7.5×10-3,K2=6.2×10-8,K3 =4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 蚊虫、蚂蚁等叮咬人时,常向人体血液)中注入一种含有蚁酸(即甲酸,分子式为HCOOH)的液体。
(1)甲酸同乙酸一样是一种有机弱酸,则在溶液中的电离方程式为___ 。取10mL的甲酸溶液,加入等体积的水,甲酸的电离程度___ (填“增大”、“减小”或“不变”),若加入少量甲酸钠固体,待固体溶解后,溶液中 的值将
的值将___ (填“增大”、“减小”或“无法确定”),甲酸的电离平衡常数___ (填“增大”、“减小”或“不变”)
(2)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:K=1.77×10-4,HCN:K=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下说法不正确的是( )
A.HCOOH+NaCN=HCOONa+HCN
B.Na2CO3+HCN=NaHCO3+NaCN
C.酸的强弱顺序:HCN>HCOOH
D.向碳酸钠溶液中加入甲酸溶液无气泡产生
(3)常温下,有pH=12的氢氧化钠溶液100mL,若将其pH变为11,用水稀释,则加入水的体积为___ mL;若用pH=10的氢氧化钠溶液,应加入___ mL。(均忽略混合后体积变化)
(4)95℃时,Kw=10-12将pH=9的NaOH溶液与pH=4的H2SO4溶液混合(忽略体积的变化),若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___ 。
(1)甲酸同乙酸一样是一种有机弱酸,则在溶液中的电离方程式为
 的值将
的值将(2)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:K=1.77×10-4,HCN:K=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下说法不正确的是
A.HCOOH+NaCN=HCOONa+HCN
B.Na2CO3+HCN=NaHCO3+NaCN
C.酸的强弱顺序:HCN>HCOOH
D.向碳酸钠溶液中加入甲酸溶液无气泡产生
(3)常温下,有pH=12的氢氧化钠溶液100mL,若将其pH变为11,用水稀释,则加入水的体积为
(4)95℃时,Kw=10-12将pH=9的NaOH溶液与pH=4的H2SO4溶液混合(忽略体积的变化),若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
您最近一年使用:0次



