解题方法
1 . 高铁酸盐( )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO饱和溶液与 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为___________ 。
(2)聚合硫酸铁[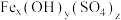 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式_______ (写出计算过程)。
 )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。(1)KClO饱和溶液与
 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为(2)聚合硫酸铁[
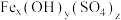 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用
 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。通过计算确定该聚合硫酸铁的化学式
您最近一年使用:0次
2 . 已知: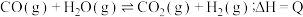 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。
(1)上述反应的化学平衡常数表达式为
___________ 。
(2) 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率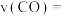
___________ 。
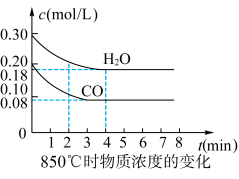
(3)若在 时进行,且
时进行,且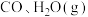 的起始浓度均为
的起始浓度均为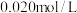 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为___________
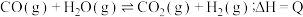 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。温度 | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为

(2)
 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率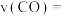

(3)若在
 时进行,且
时进行,且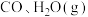 的起始浓度均为
的起始浓度均为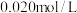 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为
您最近一年使用:0次
名校
解题方法
3 .  是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由
是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由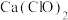 溶液氧化碱性
溶液氧化碱性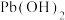 法制备
法制备 的步骤如下:
的步骤如下:

反应原理: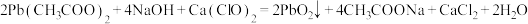 为测定产品(只含
为测定产品(只含 和PbO)中
和PbO)中 、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
 溶液(
溶液( 还原为
还原为 ,
, 被氧化为
被氧化为 )搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去
)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去 ,滤液酸化后用0.0400
,滤液酸化后用0.0400
 标准溶液滴定至终点(
标准溶液滴定至终点( 还原为
还原为 ,
, 被氧化为
被氧化为 ),消耗标准溶液10.00mL。计算产品中
),消耗标准溶液10.00mL。计算产品中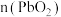 与
与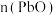 物质的量之比
物质的量之比______ (写出计算过程)。
 是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由
是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由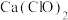 溶液氧化碱性
溶液氧化碱性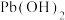 法制备
法制备 的步骤如下:
的步骤如下:
反应原理:
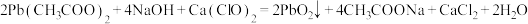 为测定产品(只含
为测定产品(只含 和PbO)中
和PbO)中 、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
 溶液(
溶液( 还原为
还原为 ,
, 被氧化为
被氧化为 )搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去
)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去 ,滤液酸化后用0.0400
,滤液酸化后用0.0400
 标准溶液滴定至终点(
标准溶液滴定至终点( 还原为
还原为 ,
, 被氧化为
被氧化为 ),消耗标准溶液10.00mL。计算产品中
),消耗标准溶液10.00mL。计算产品中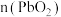 与
与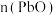 物质的量之比
物质的量之比
您最近一年使用:0次
名校
4 . 下列物质中:①CH3COOH②NH3③NH4Cl④盐酸⑤NaOH⑥NaHCO3溶液。
(1)属于弱电解质的是____ (填序号,下同),属于强电解质且其水溶液呈碱性的是____ 。
(2)在氨水中存在电离平衡:NH3•H2O NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是____ (填序号),此时c(OH-)____ (填“增大”“减小”或“不变”,下同), =
=____ 。
(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是____ (填化学式),反应过程中醋酸的电离程度____ (填“增大”“减小”或“不变”,下同),n(CH3COO-)____ ,水的电离程度逐渐____ ,水电离的c(H+)=____ 。
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=____ mol•L-1。
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为____ 。
(1)属于弱电解质的是
(2)在氨水中存在电离平衡:NH3•H2O
 NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是 =
=(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为
您最近一年使用:0次
2022-11-02更新
|
564次组卷
|
3卷引用:江苏省徐州市第七中学2023-2024学年高二下学期3月考试化学试题
解题方法
5 . 常温时,有关pH的计算。
(1)0.05 mol/L的硫酸溶液的pH=_______ 。
(2)10 mLpH=2的硫酸加水稀释至1000 mL,pH=_______ 。
(3)常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合所得溶液pH=3,则NaOH溶液与HCl溶液的体积比为_______ 。
(4)取5ml 0.002mol·L-1BaCl2与等体积的0.02mol·L-1Na2SO4混合,最终混合溶液中Ba2+的浓度为_______ 。(BaSO4的 Ksp=1.1×10-10)
(1)0.05 mol/L的硫酸溶液的pH=
(2)10 mLpH=2的硫酸加水稀释至1000 mL,pH=
(3)常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合所得溶液pH=3,则NaOH溶液与HCl溶液的体积比为
(4)取5ml 0.002mol·L-1BaCl2与等体积的0.02mol·L-1Na2SO4混合,最终混合溶液中Ba2+的浓度为
您最近一年使用:0次
名校
解题方法
6 . 已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220kJ·mol-1
请根据上面两个热化学方程式,回答下列问题:
(1)H2的燃烧热为_______ ,C3H8的燃烧热为_______ 。
(2)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为_______ 。
(3)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是_______ (写出具体过程)。
(4)已知H—H键能为436.4kJ·mol-1,Cl—Cl键能为242.7kJ·mol-1,H—Cl键能为431.8kJ·mol-1,1mol氢气和1mol氯气完全反应生成氯化氢气体_______ (吸收或放出)_______ 的热量。热化学方程式为_________ 。
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220kJ·mol-1
请根据上面两个热化学方程式,回答下列问题:
(1)H2的燃烧热为
(2)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为
(3)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是
(4)已知H—H键能为436.4kJ·mol-1,Cl—Cl键能为242.7kJ·mol-1,H—Cl键能为431.8kJ·mol-1,1mol氢气和1mol氯气完全反应生成氯化氢气体
您最近一年使用:0次
解题方法
7 . 电解金属锰阳极渣(主要成分MnO2,杂质为Pb、Fe、Cu元素的化合物)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
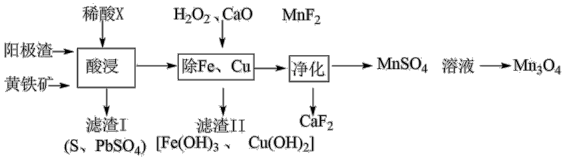
已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是_______ (填化学式)。
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。
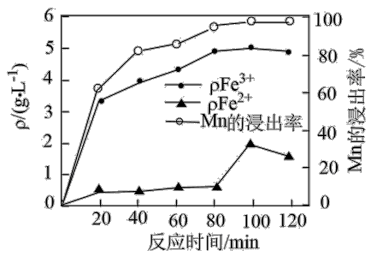
20~80 min内,浸出Mn元素的主要离子方程式为_______ 。
(3)室温下,反应MnF2(s)+Ca2+(aq) CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为
CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为_______ 。
(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O +8H+=3Mn2++2CO2↑+4H2O;2MnO
+8H+=3Mn2++2CO2↑+4H2O;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。________

已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。

20~80 min内,浸出Mn元素的主要离子方程式为
(3)室温下,反应MnF2(s)+Ca2+(aq)
 CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为
CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O
 +8H+=3Mn2++2CO2↑+4H2O;2MnO
+8H+=3Mn2++2CO2↑+4H2O;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
您最近一年使用:0次
解题方法
8 . 工业上常用软锰矿(主要成分 )为原料制备高锰酸钾。
)为原料制备高锰酸钾。
(1)将软锰矿和KOH固体粉碎后混合,鼓入空气充分焙烧,冷却后,将固体研细,用碱性溶液浸取,过滤得 溶液。再采用惰性电极阳离子交换膜法电解
溶液。再采用惰性电极阳离子交换膜法电解 溶液(装置如图所示),制得
溶液(装置如图所示),制得 。
。
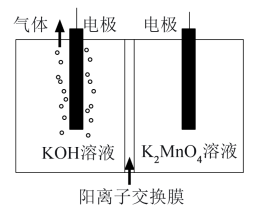
①原料经焙烧生成 ,焙烧时空气的作用是
,焙烧时空气的作用是___________ 。
②电解时,阳极的电极反应式为___________ 。
③研究发现,当未使用阳离子交换膜进行电解时, 的产率降低,其原因是
的产率降低,其原因是___________ 。
(2)测定 产品的纯度。
产品的纯度。
称取2.5000g样品溶于水,加入硫酸酸化后配成100.00mL溶液,取20.00mL置于锥形瓶中,用 标准
标准 溶液进行滴定。(反应原理为
溶液进行滴定。(反应原理为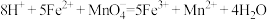 )
)
①滴定终点的现象是___________ 。
②记录实验消耗 溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时
溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时___________ (填字母)。
A.装液前,滴定管没有用标准液润洗
B.洗涤后,锥形瓶未干燥直接加入待测的 溶液
溶液
C.滴定前滴定管中尖嘴处有气泡,滴定结束后气泡消失
③数据处理。将后两次实验消耗 溶液体积取平均值为30.00mL。计算该
溶液体积取平均值为30.00mL。计算该 产品的质量分数
产品的质量分数___________ (写出计算过程)。
 )为原料制备高锰酸钾。
)为原料制备高锰酸钾。(1)将软锰矿和KOH固体粉碎后混合,鼓入空气充分焙烧,冷却后,将固体研细,用碱性溶液浸取,过滤得
 溶液。再采用惰性电极阳离子交换膜法电解
溶液。再采用惰性电极阳离子交换膜法电解 溶液(装置如图所示),制得
溶液(装置如图所示),制得 。
。
①原料经焙烧生成
 ,焙烧时空气的作用是
,焙烧时空气的作用是②电解时,阳极的电极反应式为
③研究发现,当未使用阳离子交换膜进行电解时,
 的产率降低,其原因是
的产率降低,其原因是(2)测定
 产品的纯度。
产品的纯度。称取2.5000g样品溶于水,加入硫酸酸化后配成100.00mL溶液,取20.00mL置于锥形瓶中,用
 标准
标准 溶液进行滴定。(反应原理为
溶液进行滴定。(反应原理为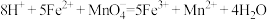 )
)①滴定终点的现象是
②记录实验消耗
 溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时
溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时A.装液前,滴定管没有用标准液润洗
B.洗涤后,锥形瓶未干燥直接加入待测的
 溶液
溶液C.滴定前滴定管中尖嘴处有气泡,滴定结束后气泡消失
③数据处理。将后两次实验消耗
 溶液体积取平均值为30.00mL。计算该
溶液体积取平均值为30.00mL。计算该 产品的质量分数
产品的质量分数
您最近一年使用:0次
名校
解题方法
9 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: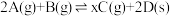 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
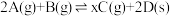 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题
江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
10 . 下表是不同温度下水的离子积数据:
试回答下列问题:
(1)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为_______ 。该温度下测得某H2SO4溶液中c(SO )=5×10-6 mol/L,该溶液中c(OH-)=
)=5×10-6 mol/L,该溶液中c(OH-)=_______ mol/L。
(2)在25℃时,将pH=5的H2SO4溶液稀释10倍,c(H+):c(SO )=
)=_______ ,将稀释后的溶液再稀释100倍,c(H+):c(SO )=
)=_______ 。
(3)在t2℃时,将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH=_______ 。
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | Kw | 1×10-12 |
试回答下列问题:
(1)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为
 )=5×10-6 mol/L,该溶液中c(OH-)=
)=5×10-6 mol/L,该溶液中c(OH-)=(2)在25℃时,将pH=5的H2SO4溶液稀释10倍,c(H+):c(SO
 )=
)= )=
)=(3)在t2℃时,将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH=
您最近一年使用:0次



