解题方法
1 . 用 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
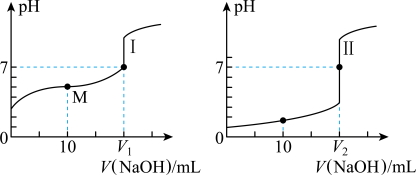
(1)用 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为______ (选填“酚酞”、“甲基橙”或“石蕊”),符合其滴定曲线的是______ (选填“Ⅰ”或“Ⅱ”)。
(2) 盐酸中,由水电离出的
盐酸中,由水电离出的
______  。
。
(3)图中 和
和 大小的比较:
大小的比较:
______ (选填“<”或“=”或“>”) 。
。
(4)在 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和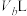 该
该 溶液。
溶液。
①若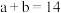 ,则
,则
______ (填数字)。
②若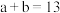 ,则
,则
______ (填数字)。
 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
(1)用
 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为(2)
 盐酸中,由水电离出的
盐酸中,由水电离出的
 。
。(3)图中
 和
和 大小的比较:
大小的比较:
 。
。(4)在
 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和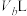 该
该 溶液。
溶液。①若
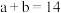 ,则
,则
②若
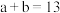 ,则
,则
您最近一年使用:0次
2 . 正常体温下,人体动脉血液的 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下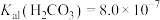 ,
,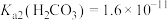 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。
(1)正常体温下,若某人动脉血 为
为 ,则属于
,则属于______ 中毒(选填“酸”或“碱”),他的血液中
______ 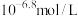 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(2)已知: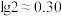 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中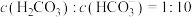 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。_____________________
 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下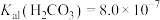 ,
,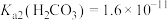 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。(1)正常体温下,若某人动脉血
 为
为 ,则属于
,则属于
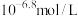 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(2)已知:
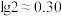 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中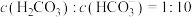 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。
您最近一年使用:0次
解题方法
3 . 回答下列问题:
(1)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和相应的能量图如图。
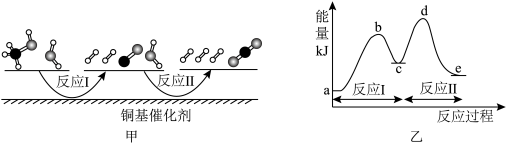
已知:a,b,c,d,e均表示能量值。
①选择优良的催化剂降低反应I和Ⅱ的活化能,有利于_____ (填“增加”或“减少”)过程中的能耗,反应Ⅱ的热化学方程式为_____ 。
②该反应属于_____ (填“放热”或“吸热”)反应,请写出总反应的热化学方程式:_____ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合并在高温下煅烧,所得物质可作耐高温材料:
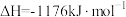 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为_____ 。
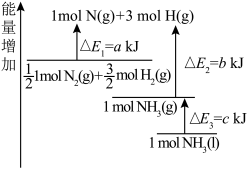
(3)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式为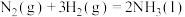

_____ 。
(4)下表是部分化学键的键能数据。
①已知1mol白磷完全燃烧生成固态 的反应热
的反应热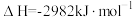 ,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
_____ 。
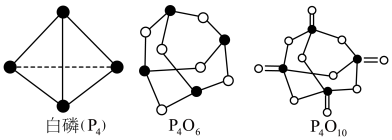
②0.5mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为_____ kJ。
(1)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和相应的能量图如图。

已知:a,b,c,d,e均表示能量值。
①选择优良的催化剂降低反应I和Ⅱ的活化能,有利于
②该反应属于
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合并在高温下煅烧,所得物质可作耐高温材料:

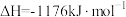 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(3)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式为
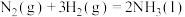


(4)下表是部分化学键的键能数据。
| 化学键 |  |  |  | 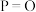 |
| 键能/(kJ·mol-1) | 198 | 360 | 498 |  |
 的反应热
的反应热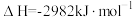 ,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
,白磷(P4)、P4O6、P4O10结构如图所示,则上表中

②0.5mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为
您最近一年使用:0次
2023-10-27更新
|
262次组卷
|
3卷引用:四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题
解题方法
4 . 取58.85g由NaCl和Na2CO3组成的固体样品,加入足量稀盐酸完全反应,生成的气体在标准状况下体积为11.2L。回答下列问题:
(1)发生反应的离子方程式为_______ 。
(2)列式计算固体样品中Na2CO3和NaCl的物质的量之比_______ 。
(1)发生反应的离子方程式为
(2)列式计算固体样品中Na2CO3和NaCl的物质的量之比
您最近一年使用:0次
名校
解题方法
5 . 在某温度(T℃)的水溶液中,c(H+)=10xmol∙L-1,c(OH-)=10ymol∙L-1,x与y关系如图所示。
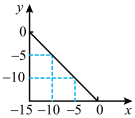
(1)该温度下,水的离子积为________ ,T℃_______ 25℃(填“>”“<”或“=”),纯水的pH________ 7(填“>”“<”或“=”)
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为________ 。(已知lg2=0.3)
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=_______ 。

(1)该温度下,水的离子积为
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=
您最近一年使用:0次
名校
解题方法
6 . 常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)已知 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤ 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是___________ (填序号)。
(2)Na2CO3溶液显碱性的原因___________ 。(用离子方程式表示)
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是_____ (填序号)。
(4)某温度下纯水的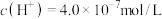 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使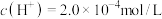 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的
_______ 。
(5)25℃时, 的
的 的
的 溶液与
溶液与 的
的 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系_______ 。
(6)向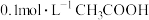 溶液中滴加
溶液中滴加 溶液至
溶液至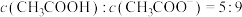 ,此时溶液
,此时溶液
_______ 。
(7)已知 的
的 ,
, 的
的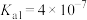 ,
,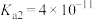 ,则反应
,则反应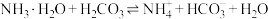 的平衡常数
的平衡常数
_______ 。
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
| 弱酸 |  |  |  |
| 电离平衡常数 |  |  | 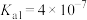 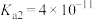 |
 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤ 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是(2)Na2CO3溶液显碱性的原因
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是
(4)某温度下纯水的
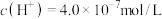 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使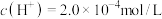 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的
(5)25℃时,
 的
的 的
的 溶液与
溶液与 的
的 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系(6)向
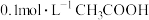 溶液中滴加
溶液中滴加 溶液至
溶液至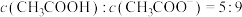 ,此时溶液
,此时溶液
(7)已知
 的
的 ,
, 的
的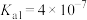 ,
,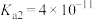 ,则反应
,则反应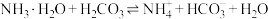 的平衡常数
的平衡常数
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
A. | B. | C.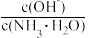 | D.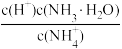 |
您最近一年使用:0次
解题方法
7 . 请回答下列问题
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+ O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为_____ kJ•mol-1(用含a、b、c的式子表示)。
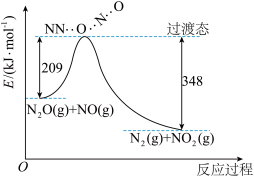
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为_____ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α=_____ %,反应平衡常数K=______ 。
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡______ (填“是”或“否”),此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+
 O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α=
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
您最近一年使用:0次
8 . t ℃时,将2mol A 和 6 mol B 充入容积固定为 2 L 的密闭容器中发生反应: A(g)+2B(g)  2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
(1)第 2 min 到第 4 min 内 A 的平均反应速率为_______
(2)t ℃时该反应的平衡常数为_______
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=_______ 。(写出三个题 完整计算过程,无计算过程不给分)
 2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:(1)第 2 min 到第 4 min 内 A 的平均反应速率为
(2)t ℃时该反应的平衡常数为
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=
您最近一年使用:0次
名校
解题方法
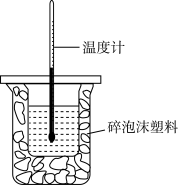
9 . Ⅰ、某实验小组用100mL0.55mol·L NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是___________ 。
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1___________ ΔH (填写<、>、=);若测得该反应放出的热量为2.84kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:___________
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为___________ 。
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

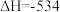 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:___________ 。
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为___________ kJ·mol 。
。
 NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

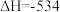 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol
 ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为 。
。
您最近一年使用:0次
2023-01-08更新
|
320次组卷
|
2卷引用:四川省遂宁中学校2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . 回答下列问题:
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中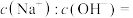
______
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入______ mL0.1mol/L的NaOH,可使反应所得的溶液pH=7(用含Ka的式子表达)
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=______
(4)常温下,设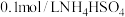 溶液的pH为a,则
溶液的pH为a,则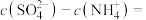
______ (用含a的精确式子表达)
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中
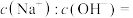
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的
 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=(4)常温下,设
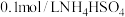 溶液的pH为a,则
溶液的pH为a,则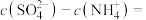
您最近一年使用:0次



