名校
解题方法
1 . 填空
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石___ (填“>”或“<”)石墨。
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1____ (填“>”或“<”)ΔH2。
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:________ 。
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=____ 。
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=______ 。
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是________ 。
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
2020-12-15更新
|
320次组卷
|
6卷引用:2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷
2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练河北省安平中学2017-2018学年高一下学期期末考试化学试题1贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题
名校
2 . 如图所示是“足球稀”分子中含有12个五边形,20个六边形,30个双键。
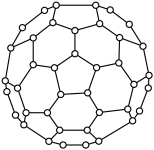
(1)平均每个五边形所含碳原子为______ 个,平均每个六边形所含的碳原子为_________ 个。
(2)“足球烯”分子的分子式为___________ 。
(3)“足球烯”分子含有的化学键单键数为___________ 。
(4)若某“足球烯”分子含12个正五边,25个正六边形,则其分子式为_________ 。

(1)平均每个五边形所含碳原子为
(2)“足球烯”分子的分子式为
(3)“足球烯”分子含有的化学键单键数为
(4)若某“足球烯”分子含12个正五边,25个正六边形,则其分子式为
您最近一年使用:0次
名校
3 . 蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___ ;基态硫原子的价电子排布式为______ 。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____ (填化学式)。1 mol CN-中含有的π键的数目为____ 。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____ ;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______ (填元素符号)。
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___ g·cm-3(列出计算式即可)。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=

您最近一年使用:0次
名校
4 . 铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___ 族,基态钴原子中未成对电子的个数为_____ 。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___ ;尿素分子中氮原子的杂化方式是___ ,尿素中所含非金属元素的电负性由大到小的顺序是___ 。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____ 。
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____ 堆积,其配位数是_____ ;一个晶胞中平均含有的π键的个数为_____ 。

图1
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____ 。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______ ,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____ pm(阿伏伽德罗常数的值用NA表示,写出计算式即可)。

图2
(1)钴位于元素周期表中第
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于

图1
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为

图2
您最近一年使用:0次
2019-05-07更新
|
755次组卷
|
4卷引用:四川省宜宾市叙州区第二中学2020届高三下学期第二次高考适应性考试理综化学试题
名校
5 . 人们利用焦炭制取水煤气的上艺已广泛用于工业生产中。
I.以焦炭制备水煤气
已知:①C(s)+H2O (g)=CO(g)+H2(g) H= +130.0KJ/mol
H= +130.0KJ/mol
②CO2(g)+H2(g)=CO(g)+H2O(g) H= +40.0KJ/mol
H= +40.0KJ/mol
(1)在工业上,反应①是煤的综合利用的一种途径,其名称是______ 。焦炭与水蒸气反应生成二氧化碳和氢气的热化学方程式为_____ 。
I I •焦炭废气的再利用
500°C时,在密闭容器中将焦炭废气中的CO2转化为二甲醚,其相关反应为:
主反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
副反应:CO2(g)+3H2(g) CH3OH(g)+2H2O(g)
CH3OH(g)+2H2O(g)
(2)测得不同时间段部分物质的浓度如下表:
①10〜20 m in内,CH3OCH3的平均反应速率V(CH3OCH3)=__________ 。②在上述特定条件下,已知主反应的速率方程为v=kca(CO2)×cb(H2)/cm(CH3OCH3) (k为速率常数,a、b、m均大于0 ) ,下列措施一定能提高主反应的反应速率的是______ (填字母序号)。
A .适当温度B .分离出二甲醚
C .恒压减小c(CO2)/c(H2) D .恒容下增大c(CO2)
②提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是______ 。若起始时CO2和H2的浓度比为1:3,根据以上数据计算,上述主反应的平衡常数的计算表达式K=______
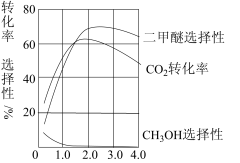
(3)对该反应实验研究得出:在相同温度下,CO2的转化率等物理量随催化剂的组成比的变化关系如图所示。若温度不变,催化剂中n(Mn)/n(Cu)约是______ 时最有利于二甲瞇的合成,此时,若增大反应投料比n(H2)/n(CO2),平衡常数K将____ (填“增大”、“减小”或“不变”).
I.以焦炭制备水煤气
已知:①C(s)+H2O (g)=CO(g)+H2(g)
 H= +130.0KJ/mol
H= +130.0KJ/mol②CO2(g)+H2(g)=CO(g)+H2O(g)
 H= +40.0KJ/mol
H= +40.0KJ/mol(1)在工业上,反应①是煤的综合利用的一种途径,其名称是
I I •焦炭废气的再利用
500°C时,在密闭容器中将焦炭废气中的CO2转化为二甲醚,其相关反应为:
主反应:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)副反应:CO2(g)+3H2(g)
 CH3OH(g)+2H2O(g)
CH3OH(g)+2H2O(g)(2)测得不同时间段部分物质的浓度如下表:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 |
| H2 | 1.00 | 0.68 | 0.40 | 0.30 | 0.30 |
| CH3OCH3 | 0 | 0.05 | 0.08 | 0.10 | 0.10 |
A .适当温度B .分离出二甲醚
C .恒压减小c(CO2)/c(H2) D .恒容下增大c(CO2)
②提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是

(3)对该反应实验研究得出:在相同温度下,CO2的转化率等物理量随催化剂的组成比的变化关系如图所示。若温度不变,催化剂中n(Mn)/n(Cu)约是
您最近一年使用:0次
6 . 硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
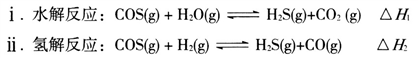
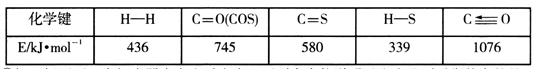
已知反应中相关的化学键键能数据如下表:
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率( )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________ 。(填标号)
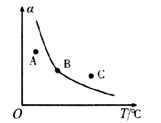
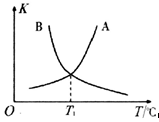
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________ (填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________ 。
(2)过二硫酸是一种强氧化性酸,其结构式为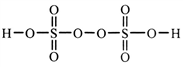
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________ 。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________ 。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________ 。②Ksp(HgS)=_____________________ 。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
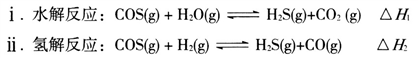
已知反应中相关的化学键键能数据如下表:

①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(
 )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是

(2)过二硫酸是一种强氧化性酸,其结构式为

①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq)
 HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。①NaHS的电子式为
您最近一年使用:0次
2018-03-13更新
|
488次组卷
|
3卷引用:四川省棠湖中学2018届高三3月月考理综化学试题
名校
7 . 有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是___________ ,_______________ 。
(2)通过计算确定该有机物的分子式__________________ 。
(3)若该物质能和钠反应产生氢气,试写出该物质的结构简式______________________ 。
(1)2.3 g A中所含氢原子、碳原子的物质的量各是
(2)通过计算确定该有机物的分子式
(3)若该物质能和钠反应产生氢气,试写出该物质的结构简式
您最近一年使用:0次
2017-11-09更新
|
343次组卷
|
4卷引用:四川省成都市七中实验学校2018届高三上学期入学考试化学试题
8 . 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L﹣1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:

(1)写出混合物溶于水时发生反应的离子方程式________________________________________________ 。
(2)写出AB段反应的离子方程式__________________ 。B点的沉淀物的化学式为______________ 。
(3)求原混合物中AlCl3的物质的量____________ ,NaOH的质量________________ 。
(4)求Q点加入的HCl溶液体积.______________________ 。

(1)写出混合物溶于水时发生反应的离子方程式
(2)写出AB段反应的离子方程式
(3)求原混合物中AlCl3的物质的量
(4)求Q点加入的HCl溶液体积.
您最近一年使用:0次
解题方法
9 . (1)已知:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________ (填“大于”“等于”或“小于”)192.9 kJ/mol。已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________________ 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____________________ 。
(3)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ/mol
O2(g)=FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+ O2(g)=Al2O3(s) ΔH2=-1675.7 kJ/mol
O2(g)=Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是___________________________________ 。某同学认为,铝热反应可用于工业炼铁,你的判断是________ (填“能”或“不能”),你的理由____________________________________ 。
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃、101 KPa下:
①H2(g)+ O2(g)=H2O(g) ΔH1=-242 kJ/mol
O2(g)=H2O(g) ΔH1=-242 kJ/mol
②CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH2=-676 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=-676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________________ 。
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol由上述方程式可知:CH3OH的燃烧热
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)已知:①Fe(s)+
 O2(g)=FeO(s) ΔH1=-272.0 kJ/mol
O2(g)=FeO(s) ΔH1=-272.0 kJ/mol②2Al(s)+
 O2(g)=Al2O3(s) ΔH2=-1675.7 kJ/mol
O2(g)=Al2O3(s) ΔH2=-1675.7 kJ/molAl和FeO发生铝热反应的热化学方程式是
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃、101 KPa下:
①H2(g)+
 O2(g)=H2O(g) ΔH1=-242 kJ/mol
O2(g)=H2O(g) ΔH1=-242 kJ/mol②CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH2=-676 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=-676 kJ/mol写出CO2和H2生成气态甲醇等产物的热化学方程式
您最近一年使用:0次
2017-06-24更新
|
672次组卷
|
2卷引用:四川省宜宾市叙州区第一中学2019届高三二诊模拟考试理综-化学试题
10 . 物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)将10.6 g Na2CO3溶于水配成1 L溶液
①该溶液中Na2CO3的物质的量浓度为_______,溶液中Na+的物质的量浓度为________。
②向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol·L-1(假设溶液体积不变)需加入NaCl的质量为_____,Cl-的物质的量浓度为_____ 。
(2)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 。
(3)在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为_______mol。生成1 mol Cu3P时,参加反应的P的物质的量为_______mol。
(1)将10.6 g Na2CO3溶于水配成1 L溶液
①该溶液中Na2CO3的物质的量浓度为_______,溶液中Na+的物质的量浓度为________。
②向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol·L-1(假设溶液体积不变)需加入NaCl的质量为_____,Cl-的物质的量浓度为_____ 。
(2)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 。
(3)在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为_______mol。生成1 mol Cu3P时,参加反应的P的物质的量为_______mol。
您最近一年使用:0次



