名校
解题方法
1 . 某同学在实验室模拟工业制备H2SO4,再用制得的浓H2SO4制备C2H4气体,并设计实验检验气体产物。
Ⅰ.制备H2SO4的重要一步是制SO3(熔点:16.8℃,沸点:44.8℃)
某同学在实验室中根据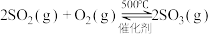 ,设计如图1所示实验装置来制备SO3固体。回答下列问题:
,设计如图1所示实验装置来制备SO3固体。回答下列问题:______ ;A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是____________________ 。
②装置D盛放的是______ 溶液,其作用是____________________ 。
③实验开始时的操作顺序为______ 。(选填“a”或“b”)
a.先点燃E处的酒精灯后将混合气体通入E。
b.先将混合气体通入E后点燃E处的酒精灯。
Ⅱ.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:____________________ 。操作中应迅速升温至______ ℃。
(3)反应前在②中放入几块碎瓷片的目的是____________________ 。
Ⅲ.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是______ (填序号),原因是____________________ 。
Ⅰ.制备H2SO4的重要一步是制SO3(熔点:16.8℃,沸点:44.8℃)
某同学在实验室中根据
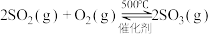 ,设计如图1所示实验装置来制备SO3固体。回答下列问题:
,设计如图1所示实验装置来制备SO3固体。回答下列问题: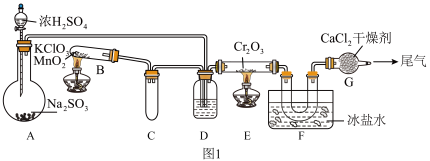
②装置D盛放的是
③实验开始时的操作顺序为
a.先点燃E处的酒精灯后将混合气体通入E。
b.先将混合气体通入E后点燃E处的酒精灯。
Ⅱ.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:

(3)反应前在②中放入几块碎瓷片的目的是
Ⅲ.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙烯 |
② | 澄清 | 变浑浊 | 产物含有CO2 |
③ | 通过品红溶液 | 红色褪去 | 产物含有SO2 |
您最近一年使用:0次
名校
2 . 回答下列问题
(1)基态Cu的价电子排布式为______ 。 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为______ ,配体为______ ,配位体所含元素中,电负性最大的是______ ,第一电离能最大的元素是______ 。
(2) 中心原子的价层电子对数目为
中心原子的价层电子对数目为______ ;叠氮酸根 的几何构型为
的几何构型为______ 。
(3)对羟基苯甲醛( )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是______ 。
(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):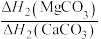
______ 1(选填“>”、“<”或“=”,下同);
②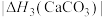
______ 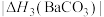 。
。
(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长:
______  (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是______ 。______ 。
②阿伏加德罗常数的值为 ,该晶体的摩尔体积为
,该晶体的摩尔体积为______  (列出计算式)。
(列出计算式)。
(1)基态Cu的价电子排布式为
 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为(2)
 中心原子的价层电子对数目为
中心原子的价层电子对数目为 的几何构型为
的几何构型为(3)对羟基苯甲醛(
 )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):

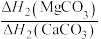
②
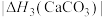
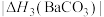 。
。(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长:
 (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是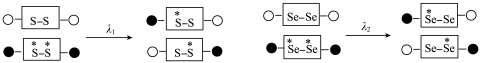
②阿伏加德罗常数的值为
 ,该晶体的摩尔体积为
,该晶体的摩尔体积为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
3 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图。
②
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______ 。(任写一种),除铁时溶液的pH值调控范围为:______ 。
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:____________________ 。
(3)常温下“除铁”时加入的试剂A可用______ ,若加A后溶液的pH调为5,则溶液中 的浓度为
的浓度为______  。
。
(4)沉锰的离子方程式为:____________________ 。滤液Ⅱ经蒸发结晶得到的盐主要是______ 。(写化学式)
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是______ 。
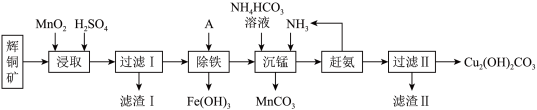
金属离子 |
|
|
|
|
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |

(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:
(3)常温下“除铁”时加入的试剂A可用
 的浓度为
的浓度为 。
。(4)沉锰的离子方程式为:
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
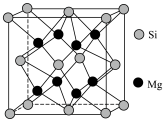
4 . 学习结构化学,有助于洞悉物质内部奥秘。回答下列问题:
(1)基态锰原子的价层电子排布图(轨道表示式)为___________ 。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的___________ 区。
(3)鉴定 Ni2+的特征反应如下所示,已知生成物II中N与Ni2+共平面:___________ ;
② II中Ni2+的杂化方式正确的是___________ 。
A.sp3 B.d2sp C. d2sp2 D.d2sp3
(4)已知:r(Fe2+)为 61pm,r(Co2+)为 65pm。在隔绝空气条件下分别加热 FeCO3和 CoCO3,实验测得 FeCO3的分解温度低于 CoCO3,原因是___________ 。
(5)Fe的第三电离能I3___________ (填“>”或“<”)Mn的第三电离能I3,二茂铁( )分子式为Fe(C5H5)2,是具有导电性的有机配合物,其配体C5H5-中的大π键表示为
)分子式为Fe(C5H5)2,是具有导电性的有机配合物,其配体C5H5-中的大π键表示为___________ 。(用π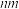 的形式表示)
的形式表示)
(6)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成 立方体空隙如图,电子对
立方体空隙如图,电子对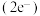 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对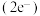 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了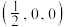 、
、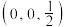 ,还有
,还有___________ 、___________ ;若晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,晶胞的边长
___________  (忽略电子对的质量,用含ρ,NA的代数式表示)。
(忽略电子对的质量,用含ρ,NA的代数式表示)。
(1)基态锰原子的价层电子排布图(轨道表示式)为
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3)鉴定 Ni2+的特征反应如下所示,已知生成物II中N与Ni2+共平面:

② II中Ni2+的杂化方式正确的是
A.sp3 B.d2sp C. d2sp2 D.d2sp3
(4)已知:r(Fe2+)为 61pm,r(Co2+)为 65pm。在隔绝空气条件下分别加热 FeCO3和 CoCO3,实验测得 FeCO3的分解温度低于 CoCO3,原因是
(5)Fe的第三电离能I3
 )分子式为Fe(C5H5)2,是具有导电性的有机配合物,其配体C5H5-中的大π键表示为
)分子式为Fe(C5H5)2,是具有导电性的有机配合物,其配体C5H5-中的大π键表示为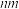 的形式表示)
的形式表示)(6)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成
 立方体空隙如图,电子对
立方体空隙如图,电子对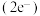 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对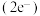 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了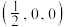 、
、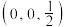 ,还有
,还有
 (忽略电子对的质量,用含ρ,NA的代数式表示)。
(忽略电子对的质量,用含ρ,NA的代数式表示)。 


您最近一年使用:0次
5 . 工业上用软锰矿(主要含 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。___________ 个未成对电子,Mn元素位于元素周期表的___________ 区。
(2)提高“酸浸”浸出率可采取的措施有_______ (写两条),“冰水沉积”的目的是_________ 。
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是___________ (填化学式)。
(4)“酸浸”时,PbS与 反应生成
反应生成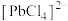 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式_______ 。
(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是___________ 。
(6)“氧化”时,发生的主要反应的离子方程式为___________ 。
 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。
(2)提高“酸浸”浸出率可采取的措施有
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是
(4)“酸浸”时,PbS与
 反应生成
反应生成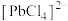 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是
(6)“氧化”时,发生的主要反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 据报道,新疆南部发现稀有金属、铅、锌、铁、锰和金矿带约600 m。回答下列问题:
(1)基态锰的价层电子排布式为___________ ;预测:锰的第三电离能(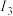 )
)___________ (填“大于”“小于”或“等于”)铁的第三电离能(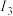 )。
)。
(2)氧化锰能催化氧化HCHO生成CO2和H2O。
①等物质的量的HCHO、CO2分子中π键数目之比为___________ 。
②在HCHO、CO2、H2O中,空间构型呈V形的分子是___________ 。
③HCHO中C原子的杂化类型是___________ 。
(3) 中不存在的作用力类型是___________(填字母)。
中不存在的作用力类型是___________(填字母)。
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:
___________ (填“>”“<”或“=”)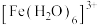 ,理由是
,理由是___________ 。
(5)铅晶胞如图所示。___________ ,它的配位数为___________ 。
②面心上六个铅原子相连构成的空间结构是___________ (填字母)。
A.正四方形 B.三角锥形 C.正八面体形 D.正四面体形
③已知:铅晶胞密度为 ,
, 代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为___________ pm。
(1)基态锰的价层电子排布式为
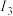 )
)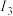 )。
)。(2)氧化锰能催化氧化HCHO生成CO2和H2O。
①等物质的量的HCHO、CO2分子中π键数目之比为
②在HCHO、CO2、H2O中,空间构型呈V形的分子是
③HCHO中C原子的杂化类型是
(3)
 中不存在的作用力类型是___________(填字母)。
中不存在的作用力类型是___________(填字母)。| A.非极性键 | B.配位键 | C.离子键 | D.金属键 |
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:

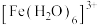 ,理由是
,理由是(5)铅晶胞如图所示。
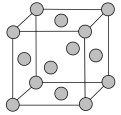
②面心上六个铅原子相连构成的空间结构是
A.正四方形 B.三角锥形 C.正八面体形 D.正四面体形
③已知:铅晶胞密度为
 ,
, 代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
您最近一年使用:0次
名校
解题方法
7 . 磷酸锌[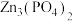 ]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: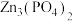 在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是___________ (填一条)。
(2)加入H2O2的作用___________
(3)经过滤2得到滤渣的主要成分是 和
和 ,则用NaOH溶液调节pH的范围是
,则用NaOH溶液调节pH的范围是___________ 。
(4)加入Na2HPO4溶液发生反应的离子方程式为___________ 。
(5)洗涤磷酸锌沉淀时应选用___________ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是___________ 。
(6)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,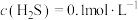 ,此时溶液中
,此时溶液中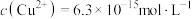 ,则CuS的溶度积
,则CuS的溶度积
___________ (已知:25℃时,H2S的电离平衡常数 ,
, )。
)。
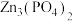 ]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: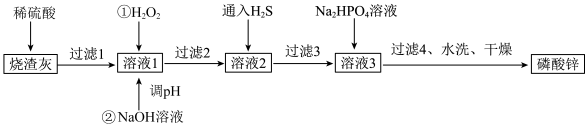
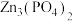 在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
在水中几乎不溶,其在水中的溶解度随温度的升高而降低;②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(2)加入H2O2的作用
(3)经过滤2得到滤渣的主要成分是
 和
和 ,则用NaOH溶液调节pH的范围是
,则用NaOH溶液调节pH的范围是(4)加入Na2HPO4溶液发生反应的离子方程式为
(5)洗涤磷酸锌沉淀时应选用
(6)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,
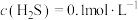 ,此时溶液中
,此时溶液中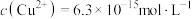 ,则CuS的溶度积
,则CuS的溶度积
 ,
, )。
)。
您最近一年使用:0次
名校
8 . 利用CH4与CO2进行催化重整,对温室气体的减排具有重要意义,催化重整时发生的反应: ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
(1)已知: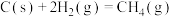
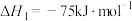
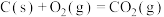
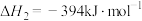
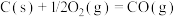
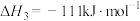
催化重整反应 的
的
______  。
。
(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为______ ;用H2表示的反应速率为______  。
。
(3)已知:常温下CH3COOH的电离常数 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、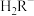 、
、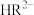 、
、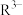 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显______ 性(选填“酸”或“碱”或“中”),常温下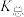 的数量级为
的数量级为______ 。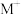 (
(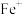 、
、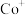 、
、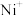 等)与O3反应可得
等)与O3反应可得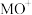 。
。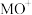 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: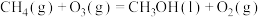 ;
;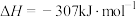 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应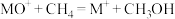 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是______ (填“a”或“b”)。300K、60 s时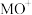 的转化率为
的转化率为______ (列出算式)。 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(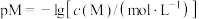 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
______ 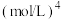 。
。
 ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:(1)已知:
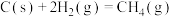
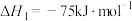
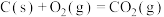
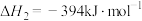
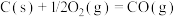
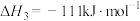
催化重整反应
 的
的
 。
。(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生
 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为 。
。(3)已知:常温下CH3COOH的电离常数
 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、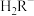 、
、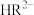 、
、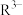 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显 的数量级为
的数量级为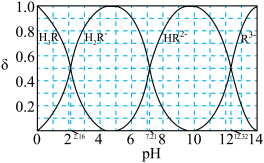
 (
(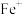 、
、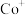 、
、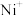 等)与O3反应可得
等)与O3反应可得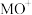 。
。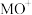 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: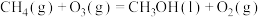 ;
;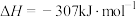 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应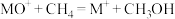 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是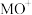 的转化率为
的转化率为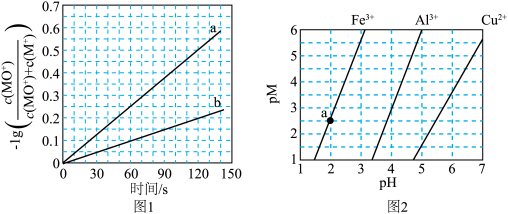
 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)( ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
 。
。
您最近一年使用:0次
解题方法
9 . 铁元素在地壳中含量丰富,应用广泛。回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用 ,则与之相反的用
,则与之相反的用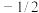 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为___________ 。
(2) 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子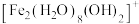 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角___________ (填“大于”、“小于”或“等于”) 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是___________ 键(填“a”或“b”)。 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为___________ , 的空间构型是
的空间构型是___________ ;尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是___________ 。
(4) 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为___________ , 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为___________  (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用
 ,则与之相反的用
,则与之相反的用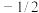 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为(2)
 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子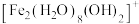 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是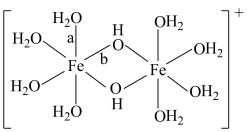
 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为 的空间构型是
的空间构型是(4)
 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为 (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。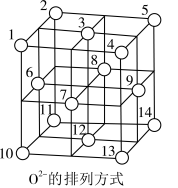
您最近一年使用:0次
名校
解题方法
10 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 (
( 与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
(1)盛放 粉末的仪器名称是
粉末的仪器名称是______ ,a中的试剂为_______ 。
(2)b中采用的加热方式是_______ ,c中化学反应的离子方程式是_____ ,采用冰水浴冷却的目的是_____ 。
(3)d的作用是____ ,可选用试剂____ (填标号)。
A. B.NaCl C.NaOH D.
B.NaCl C.NaOH D.
(4)反应结束后,取出b中试管,经冷却结晶,_______ ,______ ,干燥,得到 晶体。
晶体。
(5)取少量 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显____ 色。可知该条件下 的氧化能力
的氧化能力_____ NaClO(填“大于”或“小于”)。
 (
( 与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。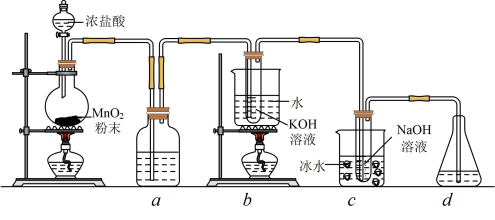
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)b中采用的加热方式是
(3)d的作用是
A.
 B.NaCl C.NaOH D.
B.NaCl C.NaOH D.
(4)反应结束后,取出b中试管,经冷却结晶,
 晶体。
晶体。(5)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显 的氧化能力
的氧化能力
您最近一年使用:0次

 溶液
溶液


