名校
1 . 中学教材对Cu与 的反应进行了讲解,但深入研究时用到了控制变量法,设计了如下的实验装置,并探讨了一些值得思考的问题。
的反应进行了讲解,但深入研究时用到了控制变量法,设计了如下的实验装置,并探讨了一些值得思考的问题。
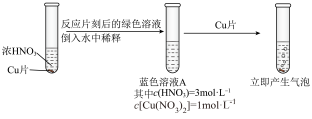
Ⅰ.利用如图装置完成Cu与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。_______
(2)用化学方程式解释C中液面上方为红棕色气体的原理_______
(3)将分液漏斗中液体换为稀硫酸和硝酸钠混合液也出现了溶解现象。此时烧瓶中发生反应的离子方程式为_______
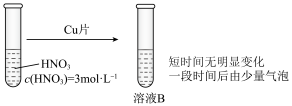
Ⅱ.深入研究时,有同学观察到了以下现象:实验1中蓝色溶液A遇铜片立即产生气泡;而相同条件下实验2中3mol/L硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如图:
分析蓝色溶液A的成分后,学习小组探究蓝色溶液A与铜片能够立即发生反应的原因。
实验验证:
(4)将少量硫酸铜固体加入到 硝酸中,溶液呈蓝色,放入铜片,无明显变化。该同学这样做是为了验证
硝酸中,溶液呈蓝色,放入铜片,无明显变化。该同学这样做是为了验证_______ (填化学式)对该反应是否有催化作用。该同学这样做不能得出该物质不是催化剂的正确结论,还应该考虑_______ 和_______ 的影响。
(5)某同学又提出可能是 对该反应有催化作用。为了得出该结论,应该补充的实验为
对该反应有催化作用。为了得出该结论,应该补充的实验为_______ (写实验操作及现象)。
 的反应进行了讲解,但深入研究时用到了控制变量法,设计了如下的实验装置,并探讨了一些值得思考的问题。
的反应进行了讲解,但深入研究时用到了控制变量法,设计了如下的实验装置,并探讨了一些值得思考的问题。Ⅰ.利用如图装置完成Cu与
 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
(2)用化学方程式解释C中液面上方为红棕色气体的原理
(3)将分液漏斗中液体换为稀硫酸和硝酸钠混合液也出现了溶解现象。此时烧瓶中发生反应的离子方程式为
Ⅱ.深入研究时,有同学观察到了以下现象:实验1中蓝色溶液A遇铜片立即产生气泡;而相同条件下实验2中3mol/L硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如图:
| 实验1 |
|
| 实验2 |
|
实验验证:
(4)将少量硫酸铜固体加入到
 硝酸中,溶液呈蓝色,放入铜片,无明显变化。该同学这样做是为了验证
硝酸中,溶液呈蓝色,放入铜片,无明显变化。该同学这样做是为了验证(5)某同学又提出可能是
 对该反应有催化作用。为了得出该结论,应该补充的实验为
对该反应有催化作用。为了得出该结论,应该补充的实验为
您最近一年使用:0次
名校
2 . 已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+  O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______ 。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:_______ 。
(3)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ΔH1 = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ΔH2 = -566.0 kJ·mol-1
①试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:_______
②甲醇作为燃料,优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用①中的热化学方程式计算,完全燃烧16g甲醇,生成二氧化碳和水蒸气时,放出的热量为_______ ,生成的CO2气体(标准状况下)体积是_______ ,转移电子_______ mol
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是_______
(5)已知C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ·mol-1,某同学根据该反应吸收的热量较小,认为由石墨变为金刚石很容易进行,但此反应却很难发生,需要很高的温度和压强,请你对此分析并阐述原因_______
 O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:(1)CO的燃烧热ΔH=
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:
(3)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ΔH1 = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ΔH2 = -566.0 kJ·mol-1
①试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
②甲醇作为燃料,优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用①中的热化学方程式计算,完全燃烧16g甲醇,生成二氧化碳和水蒸气时,放出的热量为
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是
(5)已知C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ·mol-1,某同学根据该反应吸收的热量较小,认为由石墨变为金刚石很容易进行,但此反应却很难发生,需要很高的温度和压强,请你对此分析并阐述原因
您最近一年使用:0次
名校
解题方法
3 . 利用铝与空气中的氧气发生反应,可设计为原电池,实现化学能转化为电能,实验装置如图:_______ ;发生的电极反应式是:_______ ,②消耗27g铝时,转移的电子数为:_______ mol。
(2)如图为甲烷燃料电池原理示意图。_______ ,当电路中累计有2mol电子通过时,消耗的氧气体积为(在标准状况下)_______ L。
(3)我国科学家开发Ni-N-C(Cl)催化剂实现高效催化CO2还原制备CO。装置如图所示(采用阳离子交换膜)。总反应为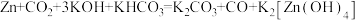 。其中正极反应式为
。其中正极反应式为_______ ,溶液中离子的移动顺序为_______ 。

(2)如图为甲烷燃料电池原理示意图。

(3)我国科学家开发Ni-N-C(Cl)催化剂实现高效催化CO2还原制备CO。装置如图所示(采用阳离子交换膜)。总反应为
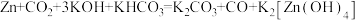 。其中正极反应式为
。其中正极反应式为
您最近一年使用:0次
名校
解题方法
4 . 饮料、糖果中常使用酯类香料。用烯烃来合成乙酸乙酯、丙烯酸乙酯的路线如图。已知A为最简单的烯烃,按要求回答下列问题:_______ 。
(2)F中所有官能团的名称是_______ ,G的结构简式为_______ 。
(3)鉴别B和C的方法_______ (阐述试剂及相关现象和结论),下列有机物中能使溴的四氯化碳溶液褪色的有_______ (填序号)。
A.丙烯酸 B.聚丙烯酸 C.丙烯 D.乙酸乙酯
(4)B+C→D的化学反应方程式_______ 。
(5)请写出丙烯(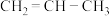 )与H2的反应
)与H2的反应_______ (写化学方程式),若与HCl发生加成反应时可能得到所有有机产物的结构简式_______ 。

(2)F中所有官能团的名称是
(3)鉴别B和C的方法
A.丙烯酸 B.聚丙烯酸 C.丙烯 D.乙酸乙酯
(4)B+C→D的化学反应方程式
(5)请写出丙烯(
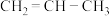 )与H2的反应
)与H2的反应
您最近一年使用:0次
名校
解题方法
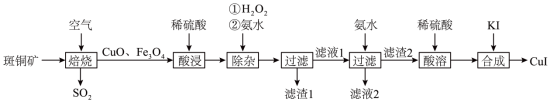
5 . 碘化亚铜(CuI)不溶于水和乙醇,可用作有机合成催化剂、树脂改性剂、人工降雨剂、阳极射线管覆盖物等。以斑铜矿(主要成分为Cu3FeS4)为原料制备碘化亚铜的工艺流程如图所示:
(1)为了加快焙烧速率,可采取的措施是___________ 。(写两种方法)
(2)检验“酸浸”后溶液中是否含Fe2+的试剂是___________ 。
(3)“除杂”操作中加H2O2的目的是___________ 。
(4)红褐色滤渣1为___________ (写化学式)。
(5)滤液2中溶质主要为(NH4)2SO4,检验SO 的方法是
的方法是___________ 。
(6)写出“合成”这一步骤的离子方程式___________ 。
(1)为了加快焙烧速率,可采取的措施是
(2)检验“酸浸”后溶液中是否含Fe2+的试剂是
(3)“除杂”操作中加H2O2的目的是
(4)红褐色滤渣1为
(5)滤液2中溶质主要为(NH4)2SO4,检验SO
 的方法是
的方法是(6)写出“合成”这一步骤的离子方程式
您最近一年使用:0次
名校
6 . 丙烯酸乙酯( )是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成丙烯酸乙酯的路线如图所示。
)是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成丙烯酸乙酯的路线如图所示。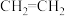 是重要的化工原料,
是重要的化工原料,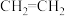 能使溴的四氯化碳溶液褪色,该反应的化学方程式为
能使溴的四氯化碳溶液褪色,该反应的化学方程式为___________ 。
(2)化合物B的分子式为___________ ,其含氧官能团的名称为___________ 。
(3)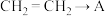 的反应类型为
的反应类型为___________ 。
(4)写出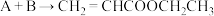 的化学方程式
的化学方程式___________ 。
(5)丙烯酸乙酯( )在一定条件下生成聚丙烯酸乙酯,请写出化学反应方程式
)在一定条件下生成聚丙烯酸乙酯,请写出化学反应方程式___________ 。
 )是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成丙烯酸乙酯的路线如图所示。
)是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成丙烯酸乙酯的路线如图所示。
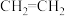 是重要的化工原料,
是重要的化工原料,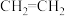 能使溴的四氯化碳溶液褪色,该反应的化学方程式为
能使溴的四氯化碳溶液褪色,该反应的化学方程式为(2)化合物B的分子式为
(3)
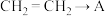 的反应类型为
的反应类型为(4)写出
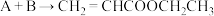 的化学方程式
的化学方程式(5)丙烯酸乙酯(
 )在一定条件下生成聚丙烯酸乙酯,请写出化学反应方程式
)在一定条件下生成聚丙烯酸乙酯,请写出化学反应方程式
您最近一年使用:0次
名校
7 . 较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁(假设实验中每步转化均是完全的;且实验装置可重复利用)。已知:①NO2的沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生反应生成氢氧化镁和氨气 ③NO可被酸性高锰酸钾溶液氧化为NO
(1)为达到上述实验目的,所选用仪器的正确连接方式是:A→_______ →F→B→F→E。
(2)装置D的作用_______ 。
(3)实验前需先打开开关K,向装置内通CO2气体,当_______ 时停止通入CO2。
(4)实验过程中,发现在装置D中产生预期现象的同时,装置C中溶液颜色慢慢褪去,试写出装置C中反应的离子方程式:_______ 。
(5)在装置A中反应开始时,某同学马上点燃装置B中的酒精灯,实验结束后通过测定发现装置B中的产品纯度不高,原因是_______ 。(用化学方程式回答)。
(6)验证装置B中有氮化镁生成的方法是_______ 。

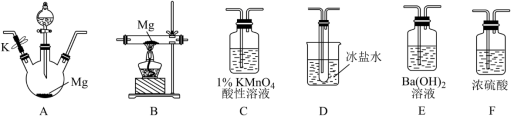
(1)为达到上述实验目的,所选用仪器的正确连接方式是:A→
(2)装置D的作用
(3)实验前需先打开开关K,向装置内通CO2气体,当
(4)实验过程中,发现在装置D中产生预期现象的同时,装置C中溶液颜色慢慢褪去,试写出装置C中反应的离子方程式:
(5)在装置A中反应开始时,某同学马上点燃装置B中的酒精灯,实验结束后通过测定发现装置B中的产品纯度不高,原因是
(6)验证装置B中有氮化镁生成的方法是
您最近一年使用:0次
名校
解题方法
8 . 焦亚硫酸钠(Na2S2O5)是一种重要的化工原料。工业上,以黄铁矿(主要成分FeS2)生产硫酸的尾气为原料制备焦亚硫酸钠的一种流程如下图所示:
(1)FeS2中铁元素的化合价为_______ 。
(2)“煅烧”时,主要反应的化学方程式为_______ 。
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是_______ 。
(4)因为Na2S2O5具有_______ 性,长期放置Na2S2O5样品会不可避免地存在Na2SO4,检验其中含有SO 的试剂是
的试剂是_______ 。
(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式_______
_______I2+ _______S2O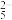 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+
在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为_______ g/L。

(1)FeS2中铁元素的化合价为
(2)“煅烧”时,主要反应的化学方程式为
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是
(4)因为Na2S2O5具有
 的试剂是
的试剂是(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式
_______I2+ _______S2O
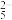 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为
您最近一年使用:0次
名校
9 . 回答下列问题。
I.我国提出争取在2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。“碳中和”是指CO2的排放总量和减少总量相当。工业上有一种方法是利用CO2生产甲醇(CH3OH):CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应过程中的能量变化如图所示:
CH3OH(g)+H2O(g),该反应过程中的能量变化如图所示:_______ (填“放热”或“吸热”)反应,若有1molCO2(g)参加反应,则变化的能量是_______ kJ。
(2)一定条件下,将2molCO2和6molH2在2L恒容密闭容器中发生上述反应,经过2min反应达到了平衡,此时CH3OH浓度为0.8mol/L。
①2min内用CO2表示该反应的速率为v(CO2)=_______ 。
②达到平衡时氢气的转化率为_______ ,平衡时体系内气体压强与开始时的压强之比为_______ 。
(3)一定能说明该反应达到平衡的标志是_______ 。
A.v正(CO2)=3v逆(H2)
B.单位时间内3molH-H键断裂,同时形成2molO-H键
C.CO2和CH3OH物质的量浓度的比值不变
D.混合气体的平均摩尔质量不再改变
E.混合气体的密度保持不变
(4)如表列出了在不同温度和压强下,反应达到平衡时CO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法正确的是_______ 。
A.CO2的转化率与温度成反比,故采用尽可能低的温度
B.该反应在450℃左右、0.1Mpa(常压)下进行较为合适
C.CO2的转化率与压强成正比,故采用尽可能高的压强
Ⅱ.有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。_______ (填“增大”或“减小”)
(6)a电极上的电极反应式是_______ ,当a电极极消耗1mol氮气,则b电极消耗氢气体积(标况下)为_______ 。
I.我国提出争取在2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。“碳中和”是指CO2的排放总量和减少总量相当。工业上有一种方法是利用CO2生产甲醇(CH3OH):CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),该反应过程中的能量变化如图所示:
CH3OH(g)+H2O(g),该反应过程中的能量变化如图所示:
(2)一定条件下,将2molCO2和6molH2在2L恒容密闭容器中发生上述反应,经过2min反应达到了平衡,此时CH3OH浓度为0.8mol/L。
①2min内用CO2表示该反应的速率为v(CO2)=
②达到平衡时氢气的转化率为
(3)一定能说明该反应达到平衡的标志是
A.v正(CO2)=3v逆(H2)
B.单位时间内3molH-H键断裂,同时形成2molO-H键
C.CO2和CH3OH物质的量浓度的比值不变
D.混合气体的平均摩尔质量不再改变
E.混合气体的密度保持不变
(4)如表列出了在不同温度和压强下,反应达到平衡时CO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法正确的是
| 温度/℃ | 平衡时的转化率 | ||||
| 0.1Mpa | 0.5Mpa | 1Mpa | 5Mpa | 10Mpa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
B.该反应在450℃左右、0.1Mpa(常压)下进行较为合适
C.CO2的转化率与压强成正比,故采用尽可能高的压强
Ⅱ.有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
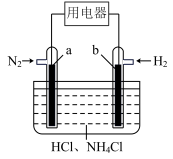
(6)a电极上的电极反应式是
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题。
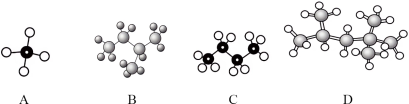
(1)A~D是四种烃分子的球棍模型(如图)_______ ,B的分子式 为_______ ,C的结构简式 为_______ ,D的一氯代物有_______ 种。
(2)从下列各组物质中进行分析,互为同分异构体的是_______ (填序号,下同), 互为同系物的是_______ ,为同种物质的是_______ 。
①CH2=CHCH2CH3 和CH3CH=CHCH3 ②CH3Cl和(CH3)2CHCH2Cl
2 +5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
【实验内容及记录】
(3)请完成此实验设计,其中:V1=_______ ,V2=_______ 。
(4)探究温度对化学反应速率的影响,应选择_______ (填实验编号)。
(5)利用实验①中的数据,计算用KMnO4表示的化学反应速率为_______ 。
(1)A~D是四种烃分子的球棍模型(如图)
(2)从下列各组物质中进行分析,互为同分异构体的是
①CH2=CHCH2CH3 和CH3CH=CHCH3 ②CH3Cl和(CH3)2CHCH2Cl
③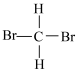 和
和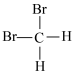 ④
④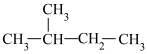 和
和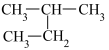
2
 +5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O【实验内容及记录】
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间(min) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L稀硫酸溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.7 |
(3)请完成此实验设计,其中:V1=
(4)探究温度对化学反应速率的影响,应选择
(5)利用实验①中的数据,计算用KMnO4表示的化学反应速率为
您最近一年使用:0次