名校
解题方法
1 . 碳元素的单质有多种形式,下图依次是 、石墨和金刚石的结构图:
、石墨和金刚石的结构图:
(1)金刚石、石墨、 、碳纳米管等都是碳元素的单质形式,它们互为
、碳纳米管等都是碳元素的单质形式,它们互为__________ 。
(2)石墨烯(指单层石墨)中碳原子的杂化形式_____________ 。
(3) 属于
属于__________ 晶体。
(4)石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有__________ 键。
(5)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________ 。
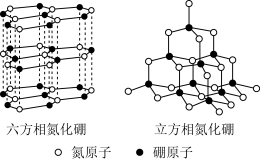
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。_____ (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
② (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有_____ mol配位键。
 、石墨和金刚石的结构图:
、石墨和金刚石的结构图:
(1)金刚石、石墨、
 、碳纳米管等都是碳元素的单质形式,它们互为
、碳纳米管等都是碳元素的单质形式,它们互为(2)石墨烯(指单层石墨)中碳原子的杂化形式
(3)
 属于
属于(4)石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有
(5)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
|
|
| |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
②
 (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有
您最近一年使用:0次
名校
2 . 二氯化二硫( )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)有关 的下列说法正确的是 。
的下列说法正确的是 。
(2)选用以下装置制取少量 (加热及夹持装置略):
(加热及夹持装置略):_____________________ 。
②装置连接顺序:A→__________ →D。
③B中玻璃纤维的作用是______________________ 。
④D中的最佳试剂是__________ (选填序号)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。_________ (填标号);
a. 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
 )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)有关
 的下列说法正确的是 。
的下列说法正确的是 。A. 中S-Cl键的键能大于S-S键的键能 中S-Cl键的键能大于S-S键的键能 | B.固态时 属于原子晶体 属于原子晶体 |
| C.第一电离能、电负性均为:Cl>S | D. 中既有极性键又有非极性键 中既有极性键又有非极性键 |
(2)选用以下装置制取少量
 (加热及夹持装置略):
(加热及夹持装置略):
②装置连接顺序:A→
③B中玻璃纤维的作用是
④D中的最佳试剂是
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
您最近一年使用:0次
名校
3 . 钴及其化合物广泛应用于航天、电池、磁性合金等高科技领域,我国钴资源贫乏,再生钴资源的回收利用是解决钴资源供给的重要途径.一种利用含钴废料(主要成分为 ,含少量
,含少量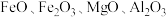 、有机物)制取
、有机物)制取 的工艺流程如下:
的工艺流程如下: ,回答下列问题:
,回答下列问题:
(1)“焙烧”的主要目的是____________ 。
(2)“浸取”过程中 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(3)“沉淀"时先加入 溶液,
溶液, 的作用主要是
的作用主要是_____________ 。再加入 溶液调节
溶液调节 为6.0,此时滤液中的
为6.0,此时滤液中的
________  ,滤渣的主要成分为:
,滤渣的主要成分为:________ 。
(4)“萃取”用到的玻璃仪器主要有________ 烧杯。为得到纯净的 ,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?
,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?____________ 。
(5)萃取原理可表述为: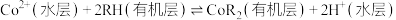 ,“反萃取”需加入A的水溶液,试剂A为
,“反萃取”需加入A的水溶液,试剂A为________ 。
 ,含少量
,含少量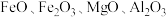 、有机物)制取
、有机物)制取 的工艺流程如下:
的工艺流程如下:
 ,回答下列问题:
,回答下列问题:金属离子 |
|
|
|
|
|
开始沉淀 | 7.5 | 1.8 | 3.4 | 9.1 | 6.5 |
沉淀完全 | 9.5 | 3.2 | 4.7 | 11.1 | 8.5 |
(1)“焙烧”的主要目的是
(2)“浸取”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)“沉淀"时先加入
 溶液,
溶液, 的作用主要是
的作用主要是 溶液调节
溶液调节 为6.0,此时滤液中的
为6.0,此时滤液中的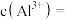
 ,滤渣的主要成分为:
,滤渣的主要成分为:(4)“萃取”用到的玻璃仪器主要有
 ,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?
,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?(5)萃取原理可表述为:
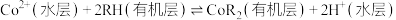 ,“反萃取”需加入A的水溶液,试剂A为
,“反萃取”需加入A的水溶液,试剂A为
您最近一年使用:0次
4 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第___________ 周期第___________ 族,Co位于元素周期表___________ 区。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是___________ 。
(4)已知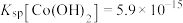 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为___________  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为___________ 。
(5)导致 比
比 易水解的因素有
易水解的因素有___________ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
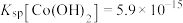 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
名校
解题方法
5 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ 。橄榄石中,各元素电负性大小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
③SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,________ 个Mg,该物质化学式为_________ ,B-B最近距离为___________ 。
(1)基态Fe原子的价电子排布式为
(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
③SiCl4的空间结构为
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
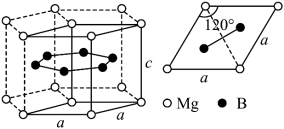
您最近一年使用:0次
名校
6 . 有机物M是一种制备液晶材料的重要中间体,其合成路线如图: (格林试剂)
(格林试剂)  、Br、I
、Br、I_______ 。
(2)在本流程中与三甲基氯硅烷( )起类似作用的有机物还有
)起类似作用的有机物还有_______ (填名称)。
(3)H的分子式是_______ ,F与H在浓盐酸作用下发生的反应类型为_______ 。
(4)L中的官能团有_______ (填名称),M的结构简式为_______ 。
(5)写出一种符合下列条件的E的同分异构体_______ (不考虑立体异构)。
①能与金属钠反应产生氢气 ②能发生银镜反应 ③含有1个手性碳原子
④核磁共振氢谱中显示六组峰且峰面积比为6∶2∶1∶1∶1∶1
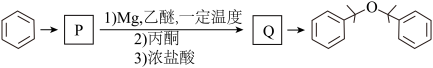
(6)以苯和丙酮为原料合成 的路线如下图,根据题中信息写出化合物P和Q的结构简式
的路线如下图,根据题中信息写出化合物P和Q的结构简式
P:_______ 、Q:_______ 。

 (格林试剂)
(格林试剂)  、Br、I
、Br、IⅡ.
Ⅲ.
(2)在本流程中与三甲基氯硅烷(
 )起类似作用的有机物还有
)起类似作用的有机物还有(3)H的分子式是
(4)L中的官能团有
(5)写出一种符合下列条件的E的同分异构体
①能与金属钠反应产生氢气 ②能发生银镜反应 ③含有1个手性碳原子
④核磁共振氢谱中显示六组峰且峰面积比为6∶2∶1∶1∶1∶1
(6)以苯和丙酮为原料合成
 的路线如下图,根据题中信息写出化合物P和Q的结构简式
的路线如下图,根据题中信息写出化合物P和Q的结构简式P:
您最近一年使用:0次
名校
解题方法
7 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)卤素位于周期表中的_______ 区。其中溴原子的价电子排布图为_______ 。
(2)-40℃时,F2与冰反应生成HF与极不稳定的HOF。常温常压下,HOF为无色气体,固态HOF的晶体类型为_______ 。为获知HOF分子的键长、键角数据,可以借助的现代仪器分析手段是_______ 。
(3)HOF又名氟氧酸,温度高于0℃时极易分解为O2与HF。从化合价的角度分析,该反应可归类为非氧化还原反应,试分析其原因_______ 。
(4)一氯乙烯(C2H3Cl)分子中,C的一个_______ 杂化轨道与Cl的3px轨道形成C-Cl_______ 键,并且Cl的3pz轨道与C的2px轨道形成3中心4电子的大π键 。
。
(5)一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是_______ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C-Cl键越强;(ⅱ)_______ 。
(6)Pt(NH3)2Cl2是一种常见的抗癌药。已知基态Pt原子的价电子排布式为5d96s1。经检测该物质具有反磁性(分子中不含成单电子),试分析其中的Pt是否为sp3杂化(分子构型未知):结论:_______ 。分析:_______ 。
(1)卤素位于周期表中的
(2)-40℃时,F2与冰反应生成HF与极不稳定的HOF。常温常压下,HOF为无色气体,固态HOF的晶体类型为
(3)HOF又名氟氧酸,温度高于0℃时极易分解为O2与HF。从化合价的角度分析,该反应可归类为非氧化还原反应,试分析其原因
(4)一氯乙烯(C2H3Cl)分子中,C的一个
 。
。(5)一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是
(6)Pt(NH3)2Cl2是一种常见的抗癌药。已知基态Pt原子的价电子排布式为5d96s1。经检测该物质具有反磁性(分子中不含成单电子),试分析其中的Pt是否为sp3杂化(分子构型未知):结论:
您最近一年使用:0次
名校
解题方法
8 . 硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下, 回答下列问题:_______ 。
(2)Na2B4O7易溶于水,也易发生水解: (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_______ 。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式_______ 。加入MgO的目的是_______ 。
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
“操作A”是除去MgSO4和CaSO4混合溶液中的CaSO4,根据上表数据,简要说明“操作A”步骤为_______ 。
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:_______ 。
②若选定A为坐标原点,则B的分数坐标为_______ 。
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为_______ g•cm-3(用含a、NA的式子表示)。

(2)Na2B4O7易溶于水,也易发生水解:
 (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:

②若选定A为坐标原点,则B的分数坐标为
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为
您最近一年使用:0次
名校
解题方法
9 . 工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下。
2CH3CH2OH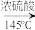 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
【乙醚制备】装置设计如下图(部分装置略)_______ (写名称);仪器b应更换为下列的_______ (填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)实验操作的正确排序为_______ (填序号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物 c.检查装置气密性
d.熄灭酒精灯 e.通冷却水并加热烧瓶 f.拆除装置 g.控制滴加乙醇速率与馏出液速率相等
(3)加热后发现a 中没有添加碎瓷片,处理方法是_______ ;反应温度不超过145℃,其目的是_______ (借助化学方程式说明)。若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是_______ 。
【乙醚提纯】_______ ;洗涤时选用NaOH溶液的目的包括:除去可能混有的酸性物质、_______ 。
(5)无水氯化镁的作用是_______ 。进行a操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为_______ 。
2CH3CH2OH
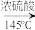 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O【乙醚制备】装置设计如下图(部分装置略)
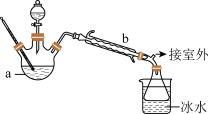

A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)实验操作的正确排序为
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物 c.检查装置气密性
d.熄灭酒精灯 e.通冷却水并加热烧瓶 f.拆除装置 g.控制滴加乙醇速率与馏出液速率相等
(3)加热后发现a 中没有添加碎瓷片,处理方法是
【乙醚提纯】
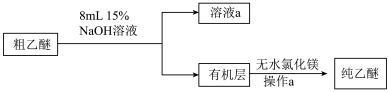
(5)无水氯化镁的作用是
您最近一年使用:0次
名校
解题方法
10 . 镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备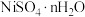 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。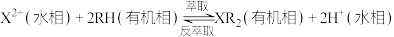 。
。
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有___________ (填元素符号)。
(2)已知NiO与MgO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO___________ MgO(填“>”“<”或“=”),理由是___________ 。
(3)滤渣1的主要成分为___________ (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是___________ 。
(5)反萃取剂A为___________ 。
(6)“反萃取”得到的 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为___________ 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(8)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:___________ ,该氧化物的化学式为___________ 。
②设 表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。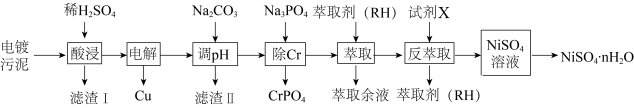
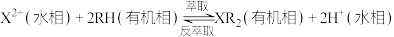 。
。回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有
(2)已知NiO与MgO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO(3)滤渣1的主要成分为
(4)电解之后加入碳酸钠调节pH的目的是
(5)反萃取剂A为
(6)“反萃取”得到的
 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、(8)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:

②设
 表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次


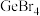
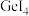



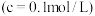 的
的 的
的

