1 . 2020年,智能材料已大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应 的产物分子中形成配位键提供孤电子对的配位原子名称是
的产物分子中形成配位键提供孤电子对的配位原子名称是______ 。
(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子价电子排布图为______ ,第一电离能介于硼和氮之间的第二周期元素有______ 种。
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于______ (周期,族,区),钛(Ti)的基态原子M能层中有______ 种空间运动状态的电子。
(4)镍能形成多种配合物,如正四面体形的 和正方形的
和正方形的 、正八面体形的
、正八面体形的 等。下列说法正确的有
等。下列说法正确的有______ (填标号)。
A.CO与 互为等电子体,其中CO分子内
互为等电子体,其中CO分子内 键和
键和 键个数之比为1∶2
键个数之比为1∶2
B. 在形成配合物时,其配位数只能为4
在形成配合物时,其配位数只能为4
C.沸点: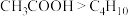 ,因为
,因为 分子间范德华力更强
分子间范德华力更强
D.键角: ,因为
,因为 的成键电子对间的排斥力更大
的成键电子对间的排斥力更大
E.极性:F―C>Cl―C,因此酸性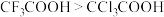
(5)一种四方结构( )的超导化合物汞钡铜氧晶体的晶胞如图所示。
)的超导化合物汞钡铜氧晶体的晶胞如图所示。______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应
 的产物分子中形成配位键提供孤电子对的配位原子名称是
的产物分子中形成配位键提供孤电子对的配位原子名称是(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子价电子排布图为
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于
(4)镍能形成多种配合物,如正四面体形的
 和正方形的
和正方形的 、正八面体形的
、正八面体形的 等。下列说法正确的有
等。下列说法正确的有A.CO与
 互为等电子体,其中CO分子内
互为等电子体,其中CO分子内 键和
键和 键个数之比为1∶2
键个数之比为1∶2B.
 在形成配合物时,其配位数只能为4
在形成配合物时,其配位数只能为4C.沸点:
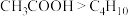 ,因为
,因为 分子间范德华力更强
分子间范德华力更强D.键角:
 ,因为
,因为 的成键电子对间的排斥力更大
的成键电子对间的排斥力更大E.极性:F―C>Cl―C,因此酸性
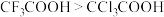
(5)一种四方结构(
 )的超导化合物汞钡铜氧晶体的晶胞如图所示。
)的超导化合物汞钡铜氧晶体的晶胞如图所示。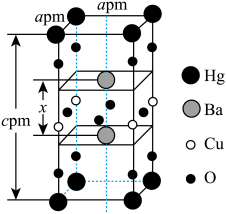
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
2 . 关于第ⅣA族的元素——碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb),它们可形成许多结构各异的物质。回答下列问题:
(1)基态Si原子的价电子轨道表示式为___________ ,有___________ 种不同运动状态的电子。
(2)CH3COOH中C原子的杂化类型是___________ 。
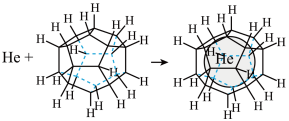
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为___________ 。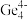 、
、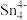 和
和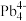 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,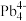 中的键角为
中的键角为___________ 。
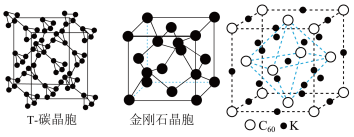
(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的___________ 倍。
①该材料的化学式是___________ 。
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=___________ g·cm-3(写出表达式)。
(1)基态Si原子的价电子轨道表示式为
(2)CH3COOH中C原子的杂化类型是
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为
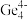 、
、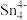 和
和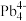 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,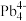 中的键角为
中的键角为(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的
①该材料的化学式是
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=
您最近一年使用:0次
名校
解题方法
3 . 草甘膦,是一种有机膦类除草剂,其结构式如图。其中X、Y、Z、W、E为原子序数依次增大的短周期主族元素。其中X只有s能级上有电子,E原子的电子总数为价层电子数三倍,w的电子排布式中有三对成对电子。下列说法正确的是
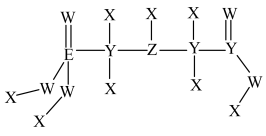
| A.X、Y、Z三种元素中原子半径最大的是Z |
| B.Z、W的第一电离能Z>W |
| C.X、Y、Z、W、E最外层均达到8电子稳定结构 |
| D.电负性Z>E,则其简单氢化物的还原性Z>E |
您最近一年使用:0次
4 . 用镍铂合金废料(主要成分为Ni、Pt,含少量Al、Co、CaO、 )回收镍和铂,其工艺流程如图:
)回收镍和铂,其工艺流程如图:____________________ 。
(2)用王水浸取“含Pt滤渣”可回收Pt,浸取时有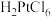 和NO生成,写出该反应的化学方程式
和NO生成,写出该反应的化学方程式______________________ 。
(3)在常温下,若酸浸后溶液中各离子浓度均为0.1mol/L且“滤渣1”为 ,则“除钴”步骤需要控制溶液的pH范围是
,则“除钴”步骤需要控制溶液的pH范围是___________ 。已知: ,
,
 ,
, ,
, ,
, 。
。
(4)加NaOH调pH的目的是除去溶液中的 ,但过程中pH不宜过高原因是
,但过程中pH不宜过高原因是____________________ 。
(5)“控温氧化”时控制其他条件一定, 的产率与温度和时间有关。20℃、40℃时反应后所得滤液主要为NaCl、NaOH和
的产率与温度和时间有关。20℃、40℃时反应后所得滤液主要为NaCl、NaOH和 ,60℃时反应后所得滤液主要为NaCl、
,60℃时反应后所得滤液主要为NaCl、 、NaOH和
、NaOH和 。反应相同时间,60℃时
。反应相同时间,60℃时 的产率低于40℃时,原因可能为
的产率低于40℃时,原因可能为__________________ 。
 )回收镍和铂,其工艺流程如图:
)回收镍和铂,其工艺流程如图:
(2)用王水浸取“含Pt滤渣”可回收Pt,浸取时有
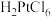 和NO生成,写出该反应的化学方程式
和NO生成,写出该反应的化学方程式(3)在常温下,若酸浸后溶液中各离子浓度均为0.1mol/L且“滤渣1”为
 ,则“除钴”步骤需要控制溶液的pH范围是
,则“除钴”步骤需要控制溶液的pH范围是 ,
,
 ,
, ,
, ,
, 。
。(4)加NaOH调pH的目的是除去溶液中的
 ,但过程中pH不宜过高原因是
,但过程中pH不宜过高原因是(5)“控温氧化”时控制其他条件一定,
 的产率与温度和时间有关。20℃、40℃时反应后所得滤液主要为NaCl、NaOH和
的产率与温度和时间有关。20℃、40℃时反应后所得滤液主要为NaCl、NaOH和 ,60℃时反应后所得滤液主要为NaCl、
,60℃时反应后所得滤液主要为NaCl、 、NaOH和
、NaOH和 。反应相同时间,60℃时
。反应相同时间,60℃时 的产率低于40℃时,原因可能为
的产率低于40℃时,原因可能为
您最近一年使用:0次
名校
解题方法
5 . 废旧三元锂离子电池正极材料主要成分为LiCoxMnyNizO2(含有铝箔、炭黑、有机物等杂质)。通过热处理、浸出、有价金属分离等过程回收钴、锰、镍、锂等金属的工艺流程如图所示:
②Ksp(CoC2O4)=l×10-18,Ksp(MnC2O4)=1×10-13,Ksp(NiC2O4)=4×10-10。
回答下列问题:
(1)”粉碎灼烧”的目的是___________ 。
(2)“碱浸”后滤液中的阴离子主要是___________ (填化学式)。
(3)“酸浸”时加入H2O2的目的是___________ (用离子方程式解释)。
(4)若酸浸"后溶液中Ni2+、Co2+、Mn2+的浓度均为0.1mol/L,欲使Co2+完全沉淀(离子浓度小于等于1×10-5mol/L),而不使Ni2+、Mni2+沉淀,需调节p( )的范围为
)的范围为___________ 。[p( )=-lgc(
)=-lgc( )]
)]
(5)“沉锰”时需控制溶液pH=5,发生反应的离子方程式为___________ 。
(6)对比“沉镍”、“沉锂”两个步骤,若“沉镍”时只加入较高浓度Na2CO3溶液即可得到NiCO3、2Ni(OH)2·4H2O,但最终选择加入NaOH和较低浓度Na2CO3的混合溶液的原因是___________ 。

②Ksp(CoC2O4)=l×10-18,Ksp(MnC2O4)=1×10-13,Ksp(NiC2O4)=4×10-10。
回答下列问题:
(1)”粉碎灼烧”的目的是
(2)“碱浸”后滤液中的阴离子主要是
(3)“酸浸”时加入H2O2的目的是
(4)若酸浸"后溶液中Ni2+、Co2+、Mn2+的浓度均为0.1mol/L,欲使Co2+完全沉淀(离子浓度小于等于1×10-5mol/L),而不使Ni2+、Mni2+沉淀,需调节p(
 )的范围为
)的范围为 )=-lgc(
)=-lgc( )]
)](5)“沉锰”时需控制溶液pH=5,发生反应的离子方程式为
(6)对比“沉镍”、“沉锂”两个步骤,若“沉镍”时只加入较高浓度Na2CO3溶液即可得到NiCO3、2Ni(OH)2·4H2O,但最终选择加入NaOH和较低浓度Na2CO3的混合溶液的原因是
您最近一年使用:0次
名校
6 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
已知:①“焙烧”中, 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐;②
转化为相应的硫酸盐;② 。回答下列问题:
。回答下列问题:
(1)为了加快“焙烧”速率,可采用的物理方法为______ (填一种即可)。
(2) “焙烧”时,转化为
“焙烧”时,转化为 ;在
;在 的
的 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为______ (填离子符号)。
(3)“水浸”后的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为______ (填离子符号)。
(4)水浸渣在160℃“酸溶”,最适合的加热方式为______ (填“水浴”或“油浴”)加热。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。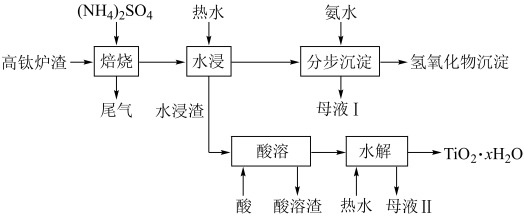
金属离子 |
|
|
|
|
开始沉淀( | 1.5 | 3.4 | 8.9 | 12.0 |
沉淀完全( | 2.8 | 4.7 | 10.9 | 13.8 |
 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐;②
转化为相应的硫酸盐;② 。回答下列问题:
。回答下列问题:(1)为了加快“焙烧”速率,可采用的物理方法为
(2)
 “焙烧”时,转化为
“焙烧”时,转化为 ;在
;在 的
的 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为(3)“水浸”后的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为
(4)水浸渣在160℃“酸溶”,最适合的加热方式为
(5)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为
您最近一年使用:0次
7 . 草酸是一种用途广泛的二元有机中强酸,某同学通过查阅资料设计了如图所示的装置(夹持仪器省略)制备一定量的草酸晶体( ),回答下列问题:
),回答下列问题: 的溶解度数据如上表
的溶解度数据如上表
(1)仪器A右侧玻璃导管的作用为_________ ,仪器A中使用饱和食盐水代替蒸馏水的目的是________________ 。
(2)装置乙的作用是除杂,写出 被除去的离子方程式
被除去的离子方程式_________________ 。
(3)在装置丙中已加入催化剂,请写出生成 的化学方程式
的化学方程式______________ ,研究表明当硝酸的质量分数超过50%或温度高于50℃,草酸的产率开始下降,其原因是________________________ 。
(4)装置丁的作用是_________________ 。
(5)待反应结束后,从装置丙中分离出 晶体的操作为
晶体的操作为_____________ 、__________ 、过滤、洗涤、低温干燥。
 ),回答下列问题:
),回答下列问题:
 的溶解度数据如上表
的溶解度数据如上表温度/℃ | 20 | 40 | 60 | 80 |
溶解度/g | 9.52 | 21.5 | 44.3 | 84.5 |
(1)仪器A右侧玻璃导管的作用为
(2)装置乙的作用是除杂,写出
 被除去的离子方程式
被除去的离子方程式(3)在装置丙中已加入催化剂,请写出生成
 的化学方程式
的化学方程式(4)装置丁的作用是
(5)待反应结束后,从装置丙中分离出
 晶体的操作为
晶体的操作为
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.在元素周期表中,s区、d区和ds区的元素都是金属 |
B.已知超分子有分子识别功能,杯酚和 之间以氢键结合 之间以氢键结合 |
C.某基态原子错误的核外电子排布图为 ,该排布图违背了泡利原理 ,该排布图违背了泡利原理 |
| D.P轨道电子云形状是在x、y、z轴上的纺锤形 |
您最近一年使用:0次
名校
解题方法
9 . 运用物质结构与性质的相关知识,回答下列问题:
(1) 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性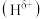 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是___________ 。基态 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有___________ 个伸展方向,原子轨道呈___________ 形。
(2) 的价层电子排布式为
的价层电子排布式为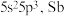 在周期表中的位置为
在周期表中的位置为___________ , 价电子轨道表示式为
价电子轨道表示式为___________ 。
(3)GaAs的晶胞结构如图所示。___________ 。
(1)
 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性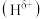 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有(2)
 的价层电子排布式为
的价层电子排布式为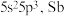 在周期表中的位置为
在周期表中的位置为 价电子轨道表示式为
价电子轨道表示式为(3)GaAs的晶胞结构如图所示。

您最近一年使用:0次
名校
解题方法
10 . 已知A、B、C、D、E、M是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。M是第四周期元素中未成对电子数最多的元素。
请用元素符号完成下列空白:
(1)B、C、D、E四种元素中,简单离子半径最小的离子符号是___________ 。
(2)BC 的中心原子的价层电子对数为
的中心原子的价层电子对数为___________ ,VSEPR模型名称为___________ 。
(3)下表是A~M元素中某种元素的部分电离能,由此可判断该元素是___________ 。根据对角线规则,在短周期元素中,该元素的一些化学性质与元素___________ 的相似。
(4)某含M、Ca(钙)、O(氧)的化合物的立方晶胞如图所示。___________ 区,其基态原子的价层电子排布式为___________ 。
②该化合物的化学式是___________ 。
③Ca和M的最近距离为acm,晶体密度为ρg·cm-3。则阿伏加德罗常数(NA)为___________ mol-1(用代数式表示)。
请用元素符号完成下列空白:
(1)B、C、D、E四种元素中,简单离子半径最小的离子符号是
(2)BC
 的中心原子的价层电子对数为
的中心原子的价层电子对数为(3)下表是A~M元素中某种元素的部分电离能,由此可判断该元素是
| 某种元素 | 电离能I(kJ·mol-1) | ||||
| I1 | I2 | I3 | I4 | I5 | |
| 578 | 1817 | 2745 | 11575 | 14830 | |
(4)某含M、Ca(钙)、O(氧)的化合物的立方晶胞如图所示。

②该化合物的化学式是
③Ca和M的最近距离为acm,晶体密度为ρg·cm-3。则阿伏加德罗常数(NA)为
您最近一年使用:0次




 )的pH
)的pH )的pH
)的pH

