名校
1 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的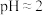 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的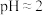 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1051次组卷
|
7卷引用:四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题
四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题热点1实验方案设计(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)
2 . 某学习小组将酚酞试液滴入Na2O2与水反应后的溶液中,发现溶液先变红后迅速褪色,为探究原因,查阅资料后做了分析和实验。
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,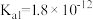 ,且具有强氧化性;
,且具有强氧化性;
③酚酞在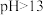 的溶液中变为无色。
的溶液中变为无色。
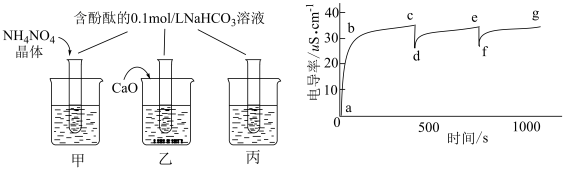
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:________
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因______ 。
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有______ 。现用 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:______ ,标定的H2O2溶液浓度为______  。
。
③若滴定时出现以下情况,将导致测定结果偏高的是______ 。
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,
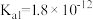 ,且具有强氧化性;
,且具有强氧化性;③酚酞在
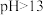 的溶液中变为无色。
的溶液中变为无色。
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再通入足量O2 | 溶液变红后不褪色 | 假设一: |
| ② | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再滴加1mL3%的H2O2溶液 | 假设二:成立 | |
| ③ | 在5mL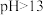 的NaOH溶液中滴加5滴酚酞试液 的NaOH溶液中滴加5滴酚酞试液 | 溶液先变红,后褪色 | 假设三:成立 |
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制
 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为: 。
。③若滴定时出现以下情况,将导致测定结果偏高的是
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
名校
解题方法
3 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
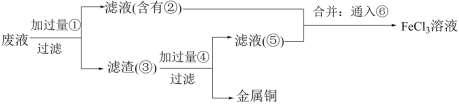
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
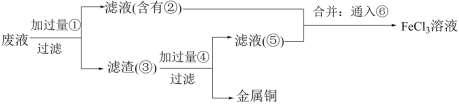
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
409次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
名校
解题方法
4 . 铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
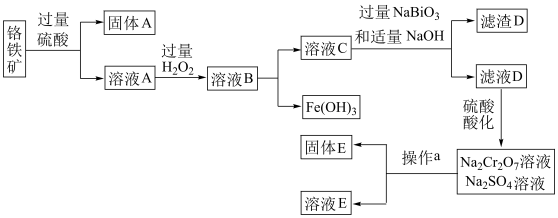
查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO72-。回答下列问题:
(1)滤渣D的化学式为________ ,溶液A中加入过量H2O2的离子方程式是_____________ 。
(2)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________ 。
(3)酸化滤液D时,不选用盐酸的原因是_____________ 。
(4)固体E的主要成分是Na2SO4,根据如图分析操作a为蒸发浓缩、__________ 、洗涤、干燥。
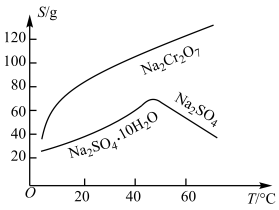
(5)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr2O72-,可用下列方法进行处理。(已知Cr2O72-的浓度为1.0×10-3 mol /L)
方法一:电解法——向废水(酸性)中通入直流电,在阴极上,+6价的铬变为低毒的+3价。
①写出该阴极的电极反应_____________________ 。
方法二:某研究性学习小组为了变废为宝,在废水中加入绿矾(FeSO4·7H2O)处理得到磁性材料 CrFe2O4(Cr的化合价为+3,Fe的化合价为+3、+2)。
②欲使1 m3该废水中的Cr2O72-完全转化为CrFe2O4 ,理论上需要加入________ g绿矾 。(已知FeSO4·7H2O摩尔质量为278g/mol)

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO72-。回答下列问题:
(1)滤渣D的化学式为
(2)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式
(3)酸化滤液D时,不选用盐酸的原因是
(4)固体E的主要成分是Na2SO4,根据如图分析操作a为蒸发浓缩、

(5)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr2O72-,可用下列方法进行处理。(已知Cr2O72-的浓度为1.0×10-3 mol /L)
方法一:电解法——向废水(酸性)中通入直流电,在阴极上,+6价的铬变为低毒的+3价。
①写出该阴极的电极反应
方法二:某研究性学习小组为了变废为宝,在废水中加入绿矾(FeSO4·7H2O)处理得到磁性材料 CrFe2O4(Cr的化合价为+3,Fe的化合价为+3、+2)。
②欲使1 m3该废水中的Cr2O72-完全转化为CrFe2O4 ,理论上需要加入
您最近一年使用:0次
名校
解题方法
5 . 管道工人曾经用浓氨水检验氯气管道是否泄漏。当浓氨水靠近氯气泄漏处时会产生大量白烟,这一现象体现了氨的哪些性质?
①易挥发 ②易溶于水 ③还原性 ④氧化性 ⑤碱性 ⑥酸性
①易挥发 ②易溶于水 ③还原性 ④氧化性 ⑤碱性 ⑥酸性
| A.①②③ | B.①③⑤ | C.②④⑥ | D.③④⑤ |
您最近一年使用:0次
2020-09-05更新
|
74次组卷
|
3卷引用:四川省广安市武胜烈面中学校2021-2022学年高二上学期入学考试化学试题
6 . 学习小组在实验室中利用如图所示装置制备 并进行相关性质的探究。
并进行相关性质的探究。
Ⅰ.制备实验: 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。

(1)装有 的装置名称
的装置名称_______
(2)③中分液漏斗盛放的试剂为_______ (填化学式)
(3)制备 的离子方程式为
的离子方程式为_______
Ⅱ.探究实验:探究 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:

[查阅资料]AgOH在溶液中不稳定易分解生成黑色的 ,
, 可溶于氨水。
可溶于氨水。
[提出假设]黑色固体可能是Ag、 中的一种或两种。
中的一种或两种。
[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
(5)实验表明,黑色固体主要是Ag,还有少量的 ,请解释产生
,请解释产生 的原因
的原因_______
(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的_______
 并进行相关性质的探究。
并进行相关性质的探究。Ⅰ.制备实验:
 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。
(1)装有
 的装置名称
的装置名称(2)③中分液漏斗盛放的试剂为
(3)制备
 的离子方程式为
的离子方程式为Ⅱ.探究实验:探究
 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:
[查阅资料]AgOH在溶液中不稳定易分解生成黑色的
 ,
, 可溶于氨水。
可溶于氨水。[提出假设]黑色固体可能是Ag、
 中的一种或两种。
中的一种或两种。[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,① | 黑色固体不溶解 | 黑色固体是Ag |
| 2 | 操作步骤同实验1 | 黑色固体完全溶解 | 黑色固体是 |
| 3 | i取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热;ii取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | i试管内壁有银镜生成ii② | 黑色固体是Ag和 |
 ,请解释产生
,请解释产生 的原因
的原因(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的
您最近一年使用:0次
2022-05-07更新
|
158次组卷
|
2卷引用:四川省内江市第六中学2021-2022学年高二下学期第一次月考化学试题
名校
7 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
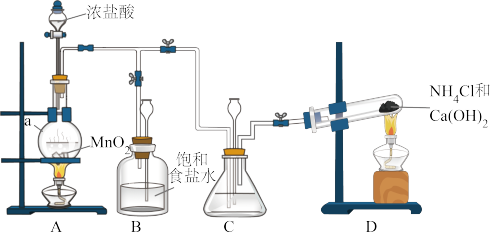
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。装置B的作用是___________ 。
(3)制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________ 。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________ 。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分:①___________ ;②___________ 。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
Ⅰ.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2022-03-29更新
|
833次组卷
|
6卷引用:四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题
四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)
解题方法
8 . I.高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是____ 价,Na2FeO4具有较强的____ (填“氧化性”或“还原性”)。
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:____ 。
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。
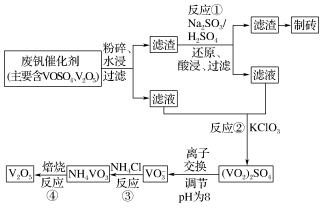
(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:____ 、____ (写出2条)。
(4)写出反应①的离子方程式____ 。
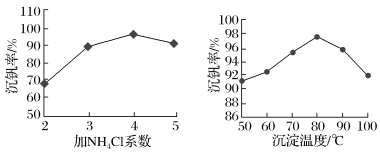
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为____ ,温度为____ 。
(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式____ 。
(1)Na2FeO4中铁元素的化合价是
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。

(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:
(4)写出反应①的离子方程式
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为

(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式
您最近一年使用:0次
名校
9 . 下表是元素周期表的一部分。
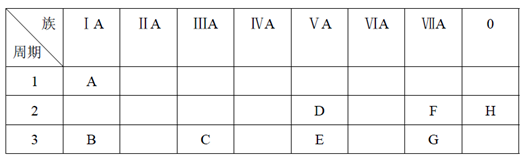
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______ ,还原性最强的单质是______ ,化学性质最不活泼的单质是______ 。(填相应的化学式)
(2)最稳定的氢化物是______ 。(填相应的化学式)
(3)一个E原子的核外电子总共有______ 种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______ 。(填相应的化学式)

根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是
(2)最稳定的氢化物是
(3)一个E原子的核外电子总共有
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是
您最近一年使用:0次
2018-05-28更新
|
555次组卷
|
2卷引用:【全国百强校】四川省南充高级中学2017-2018学年高二下学期期中化学试题
10 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:______________ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。______ ,装置B中的试剂X为______ 。
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________ 。
③装置D用于生成ClO2气体,该反应的化学方程式为___________ 。
(3)ClO2气体具有强氧化性,其还原产物 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式_______ 。 =2I-+
=2I-+ ),当看到
),当看到____________ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知D中ClO2溶液的浓度为_____ 。
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
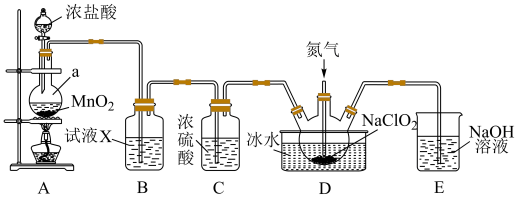
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
③装置D用于生成ClO2气体,该反应的化学方程式为
(3)ClO2气体具有强氧化性,其还原产物
 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式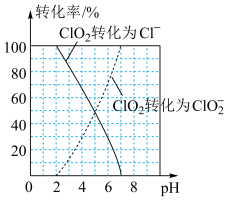
 =2I-+
=2I-+ ),当看到
),当看到
您最近一年使用:0次



