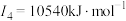(1)观察图形,确定在干冰中每个CO2分子周围有
(2)在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为
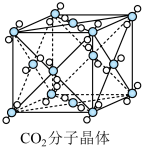
(4)在40GPa高压下,用激光器加热到1800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4molC—O键
(1)基态Fe原子价电子排布图为
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是
II.回答下列问题:
(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(4)AlH
 中,Al原子的轨道杂化方式为
中,Al原子的轨道杂化方式为 空间构型相同的一种离子和一种分子:
空间构型相同的一种离子和一种分子:(5)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.1s22s22p43s13p
 3p
3p 3p
3p b.1s22s22p33s23p
b.1s22s22p33s23p 3p
3p 3p
3p
c.1s22s22p63s13p
 d.1s22s22p63s2
d.1s22s22p63s2(3)Ti原子位于元素周期表中的
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+
(5)下列各组多电子原子的能级能量比较不正确的是_______。
①2p=3p②4s>2s③4p>4f④4d>3d
| A.①④ | B.①③ | C.③④ | D.②③ |
| A.价层电子对包括σ键电子对和中心原子上的孤电子对 |
B. 和 和 都是正四面体形微粒,且键角都为 都是正四面体形微粒,且键角都为 |
C. 分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
D. 、 、 、 、 、 、 分子中每个原子的最外层电子都满足了8电子稳定结构 分子中每个原子的最外层电子都满足了8电子稳定结构 |
5 . 现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
B元素是形成化合物种类最多的元素 |
C元素基态原子的核外p电子数比s电子数少1 |
D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别如下:
|
F元素的主族序数与周期数的差为4 |
G元素是前四周期中电负性最小的元素 |
H元素位于元素周期表中的第八纵列 |
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)E元素基态原子的电离能I3远远大于I2,其原因是
(4)B、C、D、E四种元素的第一电离能由大到小的顺序是
(5)用惰性电极电解EF2的水溶液的离子方程式为
(6)H位于元素周期表中
(1)下列溶液中,
 由大到小的顺序是___________。
由大到小的顺序是___________。A.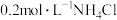 溶液 溶液 | B.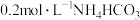 溶液 溶液 |
C.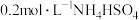 溶液 溶液 | D. 溶液 溶液 |
(2)室温时,向
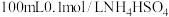 溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示: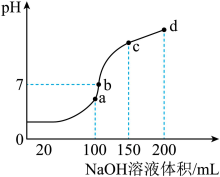
Ⅰ.试分析图中a、b、c、d四个点,水的电离程度最大的是
Ⅱ.在b点,溶液中各离子浓度由大到小的排列顺序是
Ⅲ.在cd段发生反应的离子方程式为
(3)在标准状况下充满HCl的烧瓶做完喷泉实验后,得到稀盐酸,用标准碳酸钠溶液进行滴定。
Ⅰ.用标准
 溶液滴定这种盐酸时,若用甲基橙作指示剂,达到滴定终点时,锥形瓶内溶液颜色变化为
溶液滴定这种盐酸时,若用甲基橙作指示剂,达到滴定终点时,锥形瓶内溶液颜色变化为Ⅱ.现配制三种浓度的标准
 溶液,你认为最合适的是下列第
溶液,你认为最合适的是下列第①
 ②
② ③
③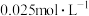
Ⅲ.若采用上述合适浓度的标准
 溶液滴定,滴定时实验数据列表如下:
溶液滴定,滴定时实验数据列表如下:| 试验编号 | 待测盐酸体积(mL) | 滴入碳酸钠溶液体积(mL) |
| 1 | 20.00 | 18.50 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |

 符号的算式表示)。
符号的算式表示)。Ⅳ.下列实验中,由于错误操作导致所测出的盐酸浓度一定偏低的是
A.滴定时,左手控制碱式滴定管的小球,右手握持锥形瓶,眼睛注视滴定管中的液面变化
B.酸式滴定管未用待测盐酸润洗
C.滴定时盛待测液的锥形瓶中有少量水
D.达到滴定终点时,俯视读数
7 .  的防治与利用对环境保护意义重大。
的防治与利用对环境保护意义重大。
(1)实验室用浓硫酸和亚硫酸钠制取
 的化学方程式为
的化学方程式为(2)实验室制取干燥的
 时,收集
时,收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为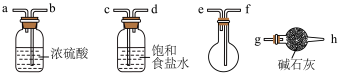
(3)用下图装置探究
 的还原性或氧化性。
的还原性或氧化性。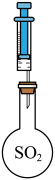
限选试剂:NaOH溶液、稀硫酸、酸性高锰酸钾溶液、淀粉-KI溶液、新制 溶液。
溶液。
步骤 | 现象 | 结论 |
用注射器将① | 产生乳白色浑浊 |
|
用注射器将② | ③ |
|
(4)某小组利用下列装置测定空气中
 的含量。
的含量。
已知该反应的化学方程式为:
若空气流速为 ,当观察到
,当观察到 。假定样品中的
。假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
A. 的某酸 的某酸 溶液中一定存在: 溶液中一定存在: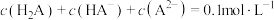 |
| B.中和等体积等浓度的氨水和NaOH溶液,氨水消耗的HCl的物质的量更少 |
| C.某强碱弱酸盐NaA溶液,随着温度升高,pH一定增大 |
D.pH相同的 溶液、 溶液、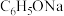 溶液、 溶液、 溶液、NaOH溶液,其浓度大小关系: 溶液、NaOH溶液,其浓度大小关系: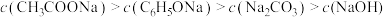 |
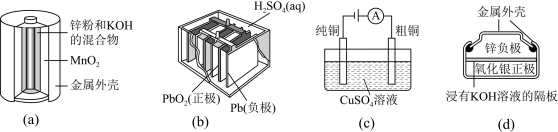
A.图(a)中, 的作用是催化剂 的作用是催化剂 |
| B.图(b)所示电池放电过程中,正极板和负极板的质量都会不断增加 |
C.图(c)所示装置工作过程中,电解质溶液中 浓度将减小 浓度将减小 |
D.图(d)所示电池放电过程中, 是氧化剂,电池工作过程中还原为Ag 是氧化剂,电池工作过程中还原为Ag |
10 . 硼原子受α粒子(He)轰击可得碳原子和氕: ,其中硼原子、碳原子核外L能层中运动的电子数目之比为
,其中硼原子、碳原子核外L能层中运动的电子数目之比为
| A.1:1 | B.2:5 | C.3:4 | D.5:6 |

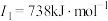 ,
,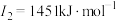 ,
,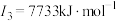 ,
,