1 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
解题方法
2 . 下列关于物质结构的命题表述中正确的是
| A.乙醛分子中碳原子的杂化类型为sp3 |
B.元素Br位于周期表第四周期ⅦA族,核外电子排布式为 ,属于p区 ,属于p区 |
| C.非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2分子 |
D.氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: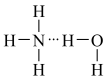 |
您最近一年使用:0次
解题方法
3 . 硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 种。CH3As(OH)2与(CH3)2AsOH两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为( ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。___________ 。
②m=_________ 。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A. 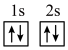 B.
B. 
C. 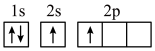 D.
D. 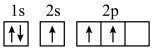
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为(
 ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。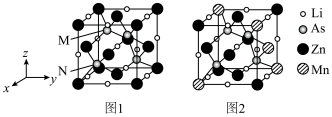
②m=
您最近一年使用:0次
解题方法
4 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误 的是
| 性质差异 | 结构因素 | |
| A | 溶解度: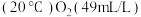 大于 大于 | 分子间作用力 |
| B | 键角: | 杂化类型 |
| C | 酸性: 远强于 远强于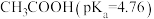 | 羟基极性 |
| D | 气态氢化物稳定性:HF强于HCl | 氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:______________ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。______ ,装置B中的试剂X为______ 。
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________ 。
③装置D用于生成ClO2气体,该反应的化学方程式为___________ 。
(3)ClO2气体具有强氧化性,其还原产物 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式_______ 。 =2I-+
=2I-+ ),当看到
),当看到____________ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知D中ClO2溶液的浓度为_____ 。
(1)某小组通过查阅资料发现可以使用SO2和NaClO3反应的方法制备ClO2。写出该过程的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
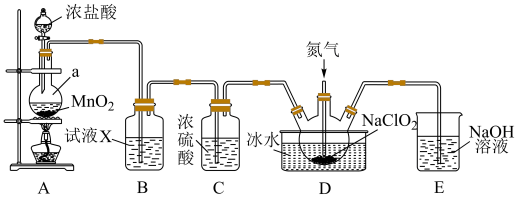
②D装置通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
③装置D用于生成ClO2气体,该反应的化学方程式为
(3)ClO2气体具有强氧化性,其还原产物
 、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式
、Cl-的转化率与pH关系如图所示。ClO2对污水中S2-、CN-等也有明显的去除效果,请写出pH≥7时,ClO2与S2-反应的离子方程式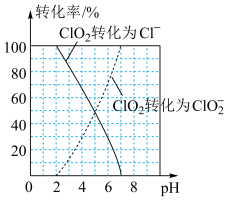
 =2I-+
=2I-+ ),当看到
),当看到
您最近一年使用:0次
解题方法
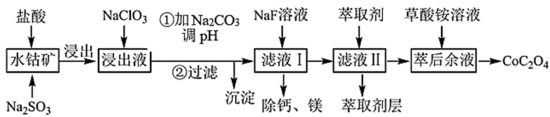
6 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为增大水钴矿的浸取效率,可采取的措施为______ 。(任写一条)
(2)向浸出液中加入NaClO3对应的离子反应方程式为______ ,制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为______ ;实验需要制取21.3克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为______ (标准状况)。
(3)向浸出液中加入碳酸钠后析出的沉淀是______ ,至少调节pH为______ 。
(4)滤液Ⅱ中加入萃取剂的目的是______ 。
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液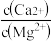 =
=______ 。
(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为_______ 。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)为增大水钴矿的浸取效率,可采取的措施为
(2)向浸出液中加入NaClO3对应的离子反应方程式为
(3)向浸出液中加入碳酸钠后析出的沉淀是
(4)滤液Ⅱ中加入萃取剂的目的是
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
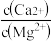 =
=(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为
您最近一年使用:0次
解题方法
7 . 甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =_______ 。
(2)若在绝热恒容 的容器内进行反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g),初始加入2mol CH3OH和3mol O2下列不能 表示该反应达到平衡状态的有__________ (填字母序号)。
A.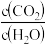 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化
C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变_______ ,初始压强为P,该反应的压强平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)_____ v(逆)(填“>”、“<”或“=”);
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为______ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)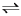 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =
(2)若在
A.
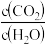 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)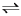 H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 电解质的水溶液中存在电离平衡。
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为_______ 。
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)________ 。
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。_______ 。
②滴定醋酸的曲线是_______ (填“I”或“Ⅱ”),则V1______ V2(填“>”、 “<”“或“=”)。
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为_____ mL。 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①该滴定过程应选择______ (填“甲基橙”或“酚酞”)为指示剂,根据上述数据,可计算出该醋酸的浓度约为_____  。
。
②在上述实验中,下列操作会造成测定结果偏大的有______ 。(填字母序号)。
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为
 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。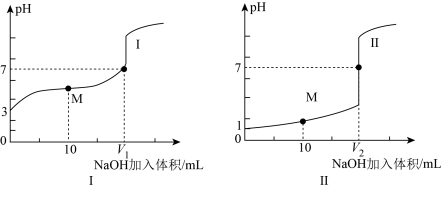
②滴定醋酸的曲线是
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为

 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测醋酸的体积(mL) |
| 1 | 0.1000 | 22.48 | 20.00 |
| 2 | 0.1000 | 25.72 | 20.00 |
| 3 | 0.1000 | 22.52 | 20.00 |
 。
。②在上述实验中,下列操作会造成测定结果偏大的有
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
9 . 室温下,向10mL 0.1mol/L的H2SO3溶液中滴加0.1mol/L的NaOH溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液pH的关系如图所示。下列说法不正确 的是

A.曲线Ⅱ表示HSO 的分布系数随pH的变化 的分布系数随pH的变化 |
| B.Ka2(H2SO3)的数量级为10−8 |
C.pH=7时,c(Na+)<3c(SO ) ) |
D.当加入的NaOH的体积为20mL时,c(H+)+ c(HSO )+ c(H2SO3)<c(OH-) )+ c(H2SO3)<c(OH-) |
您最近一年使用:0次
10 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
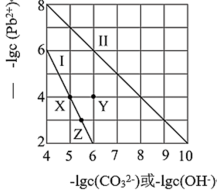
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近一年使用:0次



