1 . 化合物W为2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如
(1)化合物A存在顺反异构,写出A的结构简式______________ 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________ 。
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是___________ (填字母) 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸(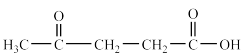 )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为_____________ 。
Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
①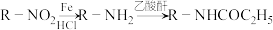
② 具有较强的还原性
具有较强的还原性
回答下列问题:
(5)B的结构简式为______________ ,F中含氧官能团的名称为______________ 。
(6)D→E转化需加入的试剂为___________ 。设计C→D步骤的目的是________________ 。
(7)M→N反应的化学方程式为______________ 。
(8)通过N、F合成P的反应属类型为_____________ ,合成过程中还需加入适量 可提高产率原因为
可提高产率原因为______________ 。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。
例如: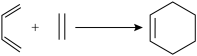
 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如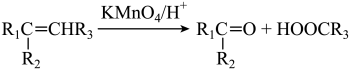 。
。
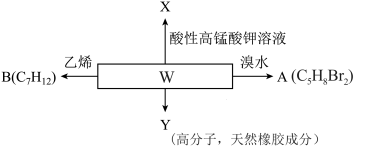
(1)化合物A存在顺反异构,写出A的结构简式
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是
a.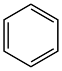 b.
b.  c.
c. d.
d.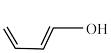
 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸( )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
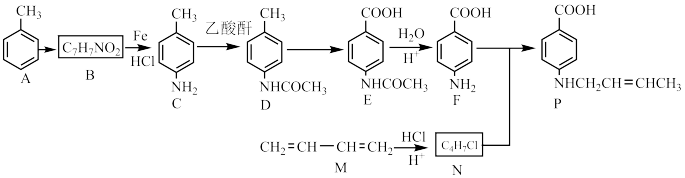
①
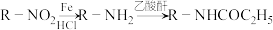
②
 具有较强的还原性
具有较强的还原性回答下列问题:
(5)B的结构简式为
(6)D→E转化需加入的试剂为
(7)M→N反应的化学方程式为
(8)通过N、F合成P的反应属类型为
 可提高产率原因为
可提高产率原因为
您最近一年使用:0次
2 . 2-溴戊二酸二甲酯(相对分子质量为239)是某抗癌药物的重要中间体,其制备的反应原理如图所示:
步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10ml液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
(1)使用装置A的优点是_____________ ,三颈烧瓶宜选择的规格是__________ (填标号)。
A.50mL B.150mL C.200mL D.500mL
(2)步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有_____________ 。
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
(3)步骤二中用饱和氯化钠溶液洗涤的目的是_______________ 。
(4)步骤三中使用减压蒸馏的目的是______________ 。
(5)中间产物Ⅰ比戊二酸的沸点低很多的原因是_______________ ,反应中生成中间产物1(戊二酰氯)的同时得到两种有刺激性气味的气体,该反应的化学方程式为________________ 。
(6)从环保角度分析,该实验装置存在明显不足之处,解决的办法是_____________ 。
(7)本实验的产率约是 。

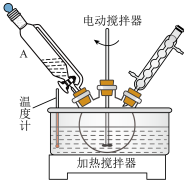
步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10ml液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
(1)使用装置A的优点是
A.50mL B.150mL C.200mL D.500mL
(2)步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
(3)步骤二中用饱和氯化钠溶液洗涤的目的是
(4)步骤三中使用减压蒸馏的目的是
(5)中间产物Ⅰ比戊二酸的沸点低很多的原因是
(6)从环保角度分析,该实验装置存在明显不足之处,解决的办法是
(7)本实验的产率约是 。
| A.30% | B.50% | C.60% | D.80% |
您最近一年使用:0次
名校
3 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第VⅢ族的元素,在化学上称为铁系元素,其合金和化合物在生产生活中应用广泛。
(1)基态Ni原子的价层电子排布图为_____________ 。
(2) 的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是
的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是_____________ ,氮有_____________ 种不同空间运动状态的电子。
(3) 在水溶液中以
在水溶液中以 的形式存在。向含
的形式存在。向含 的溶液中加入过量氨水可生成更稳定的
的溶液中加入过量氨水可生成更稳定的 ,试分析
,试分析 更稳定的原因是
更稳定的原因是________________ 。
(4)硫酸镍溶于氨水形成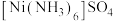 蓝色溶液。
蓝色溶液。
① 的空间构型为
的空间构型为_____________ 。
②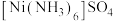 含有的化学键类型包括
含有的化学键类型包括_____________ (填字母)。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键
(5)一种Al-Fe合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。若此合金中Al、Fe原子核中心之间最近的距离为a pm,则此合金的密度
__________  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列出计算式即可)。
,列出计算式即可)。
(1)基态Ni原子的价层电子排布图为
(2)
 的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是
的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是(3)
 在水溶液中以
在水溶液中以 的形式存在。向含
的形式存在。向含 的溶液中加入过量氨水可生成更稳定的
的溶液中加入过量氨水可生成更稳定的 ,试分析
,试分析 更稳定的原因是
更稳定的原因是(4)硫酸镍溶于氨水形成
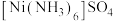 蓝色溶液。
蓝色溶液。①
 的空间构型为
的空间构型为②
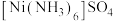 含有的化学键类型包括
含有的化学键类型包括A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键
(5)一种Al-Fe合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。若此合金中Al、Fe原子核中心之间最近的距离为a pm,则此合金的密度

 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列出计算式即可)。
,列出计算式即可)。
您最近一年使用:0次
名校
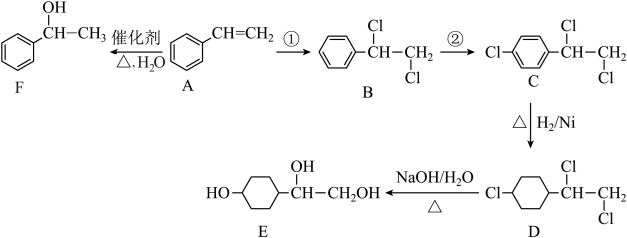
4 . 苯乙烯(A)是一种重要化工原料,以苯乙烯为原料可以制备一系列化工产品,如图所示。
(1)E中所含官能团的名称是______ ,F在一定条件下也可以得到A,则F→A的反应类型是_______ 。
(2)第②步反应所需的试剂是_______ (填化学式)。
(3)写出D→E的化学方程式:_______ 。
(4)G是F的同分异构体,其中属于酚类的G有_______ 种,其中符合核磁共振氢谱有四组峰且峰面积之比为6∶2∶1∶1的结构简式为_______ (任写一种)。
(5)X为2-甲基丙烯,以它为原料合成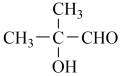 ,可利用题干信息设计如下一条合成路线。
,可利用题干信息设计如下一条合成路线。_______ 、_______ 。
(1)E中所含官能团的名称是
(2)第②步反应所需的试剂是
(3)写出D→E的化学方程式:
(4)G是F的同分异构体,其中属于酚类的G有
(5)X为2-甲基丙烯,以它为原料合成
 ,可利用题干信息设计如下一条合成路线。
,可利用题干信息设计如下一条合成路线。
您最近一年使用:0次
名校
5 . 锰钢异常坚硬,且具抗冲击性能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量元素。回答下列问题:
(1)锰元素在元素周期表中的位置是_______ ,基态锰原子的外围电子排布图为_______ 。
(2)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是_______(填标号)。
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有_______ ;锰试剂_______ (填“能”或“不能”)形成分子内氢键。_______ (填“sp”、“sp2”或“sp3”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为_______ (用元素符号表示)。
(5)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。_______ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为_______ 。
(1)锰元素在元素周期表中的位置是
(2)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是_______(填标号)。
| A.F–F键的键能小于Cl–Cl键的键能 |
| B.三氟乙酸的Ka大于三氯乙酸的Ka |
| C.氟化氢分子的极性强于氯化氢分子的极性 |
| D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子 |
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有

(5)研究发现纳米CeO2可催化O
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。 
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为
您最近一年使用:0次
名校
6 . 双酚A主要用于生产聚碳酸酯、环氧树脂、聚砜树脂、聚苯醚树脂、不饱和聚酯树脂等高分子材料,其合成原理如图:
①将10.0g苯酚、17mL甲苯依次加入三口烧瓶中,烧瓶外用冷水冷却,在不断搅拌下加入7mL丙酮(过量),控制温度在15℃左右。
②当苯酚全部溶解,温度达到15℃时,保持匀速搅拌,并缓慢加入12mL 80%的硫酸,温度控制在18~20℃。
③缓慢加热至30~40℃,反应1h,当液体变得相当黏稠时,将反应后的溶液转移至50mL水中,静置冷却,搅拌、结晶,减压抽滤(用图2装置),用水洗涤滤渣至洗涤液呈中性后,再用滤纸进一步压干滤渣,然后进行烘干,得到双酚A粗产品。
请回答下列问题:
(1)仪器甲的名称为_______ ,仪器乙的作用为_______ 。
(2)步骤③中,反应温度控制在30~40℃,适合的加热方式为______ ,选择在此温度范围内反应的原因为_______ 。
(3)在该实验中,甲苯的作用为_______ ,加入过量丙酮的目的是_______ 。
(4)相比常压过滤,减压抽滤的优点为______ ,减压抽滤后得到的滤液中含有甲苯,提纯甲苯可_____ 法。
(5)利用甲苯将粗产品重结晶后,过滤、洗涤、干燥,最终得到5.4g双酚A,则双酚A的产率_______ (保留两位有效数字)。

①将10.0g苯酚、17mL甲苯依次加入三口烧瓶中,烧瓶外用冷水冷却,在不断搅拌下加入7mL丙酮(过量),控制温度在15℃左右。
②当苯酚全部溶解,温度达到15℃时,保持匀速搅拌,并缓慢加入12mL 80%的硫酸,温度控制在18~20℃。
③缓慢加热至30~40℃,反应1h,当液体变得相当黏稠时,将反应后的溶液转移至50mL水中,静置冷却,搅拌、结晶,减压抽滤(用图2装置),用水洗涤滤渣至洗涤液呈中性后,再用滤纸进一步压干滤渣,然后进行烘干,得到双酚A粗产品。

| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯酚 | 94 | 43.0 | 181.7 | 溶于水、乙醇,易溶于乙醚、甲苯 |
| 丙酮 | 58 | -95.4 | 56.0 | 与水、乙醇、乙醚、甲苯互溶 |
| 双酚A | 228 | 155.6 | 250.0 | 微溶于水、溶于丙酮、甲苯 |
| 甲苯 | 92 | -95.0 | 110.6 | 不溶于水,与乙醇、乙醚互溶 |
(1)仪器甲的名称为
(2)步骤③中,反应温度控制在30~40℃,适合的加热方式为
(3)在该实验中,甲苯的作用为
(4)相比常压过滤,减压抽滤的优点为
(5)利用甲苯将粗产品重结晶后,过滤、洗涤、干燥,最终得到5.4g双酚A,则双酚A的产率
您最近一年使用:0次
名校
解题方法
7 . 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。
(1)实验室以苯为原料制取苯胺,反应流程图如下:___________ 。
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液澜斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。___________ ;
②下列说法中正确的是___________ (填序号);
A.配混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中不断搅拌、冷却
B.浓硫酸可以降低该反应活化能
C.温度控制在50~60℃原因之一是减少副反应的发生
D.制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤
(3)制取苯胺
b.先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
c.打开活塞K,通入 一段时间。
一段时间。
d.利用油浴加热。
e.反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
f.调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
①步骤b中温度计水银球的位置位于___________ (填字母,下同),步骤f中位于___________ 。
A.烧瓶内反应液中 B.贴近烧瓶内液面处 C.三颈烧瓶出气口(等高线)附近
②步骤d中利用油浴加热的目的是___________ ;步骤e中,加入生石灰的作用是___________ ;
③若实验中硝基苯用量为10mL,最后得到苯胺5.6g,苯胺的产率为___________ (写出计算过程,计算结果精确到0.1%)。
| 物质 | 相对分子质量 | 沸点℃ | 密度g/mL | 溶解性 |
| 硝基苯 | 123 | 210.9 | 1.23 | 不溶于水,易溶于乙醇、乙醚 |
| 苯胺 | 93 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚;还原性强、易被氧化 |
(1)实验室以苯为原料制取苯胺,反应流程图如下:

②1mol 生成1mol
生成1mol 过程中转移的电子数目为:
过程中转移的电子数目为:
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液澜斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。

②下列说法中正确的是
A.配混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中不断搅拌、冷却
B.浓硫酸可以降低该反应活化能
C.温度控制在50~60℃原因之一是减少副反应的发生
D.制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤
(3)制取苯胺

b.先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
c.打开活塞K,通入
 一段时间。
一段时间。d.利用油浴加热。
e.反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
f.调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
①步骤b中温度计水银球的位置位于
A.烧瓶内反应液中 B.贴近烧瓶内液面处 C.三颈烧瓶出气口(等高线)附近
②步骤d中利用油浴加热的目的是
③若实验中硝基苯用量为10mL,最后得到苯胺5.6g,苯胺的产率为
您最近一年使用:0次
名校
解题方法
8 . 中国科学家参与的国际阿伏加德罗组织以高纯单晶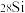 为样品高精度地测定了
为样品高精度地测定了 。
。
Ⅰ.高纯单晶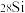 的制备流程如下
的制备流程如下

(1)写出基态 原子的电子排布式
原子的电子排布式___________ 。
(2) 分子的空间构型是
分子的空间构型是___________ 。
(3)③中发生分解反应,判断 的分解温度
的分解温度___________ (填“大于”或“小于”) 的分解温度,理由是
的分解温度,理由是___________ 。
Ⅱ. 的测定
的测定
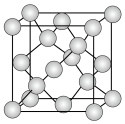
(4)单晶硅的晶胞结构如图所示,X射线衍射测定其边长为apm。 以及缺陷修正值
以及缺陷修正值 (晶胞内实际原子数=理论原子数
(晶胞内实际原子数=理论原子数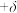 )。用上述物理量列出
)。用上述物理量列出 的计算表达式
的计算表达式___________ 。
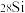 为样品高精度地测定了
为样品高精度地测定了 。
。Ⅰ.高纯单晶
 的制备流程如下
的制备流程如下
(1)写出基态
 原子的电子排布式
原子的电子排布式(2)
 分子的空间构型是
分子的空间构型是(3)③中发生分解反应,判断
 的分解温度
的分解温度 的分解温度,理由是
的分解温度,理由是Ⅱ.
 的测定
的测定(4)单晶硅的晶胞结构如图所示,X射线衍射测定其边长为apm。
 以及缺陷修正值
以及缺陷修正值 (晶胞内实际原子数=理论原子数
(晶胞内实际原子数=理论原子数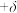 )。用上述物理量列出
)。用上述物理量列出 的计算表达式
的计算表达式
您最近一年使用:0次
9 . 磷化硼是一种超硬耐磨涂层材料,结构与金刚石相似,其晶胞结构如图所示。请回答下列问题:___________ ,基态磷原子中电子的运动状态有___________ 种,与硼同主族的第四周期元素的基态原子价层电子的轨道表示式为___________ 。
(2) 为一元弱酸,
为一元弱酸, 分子中
分子中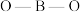 的键角
的键角___________ (填“ ”“
”“ ”或“
”或“ ”)
”) (中的
(中的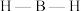 的键角,原因为
的键角,原因为___________ 。
(3)磷化硼晶体属于___________ 晶体,其中硼原子的配位数为___________ 。
(4)磷化硼的化学式为___________ ,该晶体的密度为___________  (用含a、
(用含a、 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 )。
)。

(2)
 为一元弱酸,
为一元弱酸, 分子中
分子中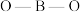 的键角
的键角 ”“
”“ ”或“
”或“ ”)
”) (中的
(中的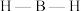 的键角,原因为
的键角,原因为(3)磷化硼晶体属于
(4)磷化硼的化学式为
 (用含a、
(用含a、 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
10 . 某化学兴趣小组设计实验探究1-溴丙烷的消去反应,实验装置如图所示。按要求回答下列问题:___________ 。
(2)甲同学认为装置②中酸性 溶液褪色即可说明1-溴丙烷发生了消去反应,乙同学认为装置②中酸性
溶液褪色即可说明1-溴丙烷发生了消去反应,乙同学认为装置②中酸性 溶液褪色并不能说明1-溴丙烷发生了消去反应,因为
溶液褪色并不能说明1-溴丙烷发生了消去反应,因为___________ 。
(3)丙同学认为把装置②中的酸性 溶液用溴的
溶液用溴的 溶液替换,若溴的
溶液替换,若溴的 溶液褪色,则可说明1-溴丙烷发生了消去反应,此时装置②中反应的化学方程式为
溶液褪色,则可说明1-溴丙烷发生了消去反应,此时装置②中反应的化学方程式为___________ 。
(4)实验结束后,丁同学取少量装置①试管中反应后的溶液于另一试管中,___________ (请填写实验过程和现象),证明装置①试管中反应后的溶液中含有 。丁同学认为根据该现象也可说明1-溴丙烷发生了消去反应。你
。丁同学认为根据该现象也可说明1-溴丙烷发生了消去反应。你___________ (填“认同”或“不认同”)丁同学的判断。
(5)该小组成员在观察试剂瓶上标签中对1-溴丙烷的描述时,发现其中含有极少量2-溴丙烷、写出2-溴丙烷发生消去反应的化学方程式:___________ 。
(6)根据该实验的启发,该小组成员设计了用1-溴丙烷经过三步反应制得1,2-丙二醇的合成路线,试写出第三步反应的化学方程式:___________ 。
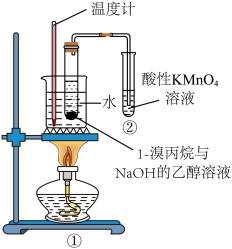
(2)甲同学认为装置②中酸性
 溶液褪色即可说明1-溴丙烷发生了消去反应,乙同学认为装置②中酸性
溶液褪色即可说明1-溴丙烷发生了消去反应,乙同学认为装置②中酸性 溶液褪色并不能说明1-溴丙烷发生了消去反应,因为
溶液褪色并不能说明1-溴丙烷发生了消去反应,因为(3)丙同学认为把装置②中的酸性
 溶液用溴的
溶液用溴的 溶液替换,若溴的
溶液替换,若溴的 溶液褪色,则可说明1-溴丙烷发生了消去反应,此时装置②中反应的化学方程式为
溶液褪色,则可说明1-溴丙烷发生了消去反应,此时装置②中反应的化学方程式为(4)实验结束后,丁同学取少量装置①试管中反应后的溶液于另一试管中,
 。丁同学认为根据该现象也可说明1-溴丙烷发生了消去反应。你
。丁同学认为根据该现象也可说明1-溴丙烷发生了消去反应。你(5)该小组成员在观察试剂瓶上标签中对1-溴丙烷的描述时,发现其中含有极少量2-溴丙烷、写出2-溴丙烷发生消去反应的化学方程式:
(6)根据该实验的启发,该小组成员设计了用1-溴丙烷经过三步反应制得1,2-丙二醇的合成路线,试写出第三步反应的化学方程式:
您最近一年使用:0次



