名校
解题方法
1 . 回答下列小题
(1)25℃时,amol·L-1CH3COOH溶液中c(H+)=10-bmol·L-1,用含a和b的代数式表示CH3COOH的电离常数K=___________ 。
(2)已知25℃时,K(CH3COOH)=1.8×10-5,K(HSCN)=0.13。在该温度下将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下,则反应前醋酸溶液中由水产生的氢离子浓度为:___________ ,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___________ 。

(3)下表是几种弱酸常温下的电离常数:
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为___________ 。
②多元弱酸的二级电离程度远小于一级电离的主要原因是___________ (从电离平衡角度考虑)。
③同浓度的CH3COO-、 、
、 、S2-结合H+的能力由强到弱的顺序为
、S2-结合H+的能力由强到弱的顺序为___________ 。
(1)25℃时,amol·L-1CH3COOH溶液中c(H+)=10-bmol·L-1,用含a和b的代数式表示CH3COOH的电离常数K=
(2)已知25℃时,K(CH3COOH)=1.8×10-5,K(HSCN)=0.13。在该温度下将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下,则反应前醋酸溶液中由水产生的氢离子浓度为:

(3)下表是几种弱酸常温下的电离常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为
②多元弱酸的二级电离程度远小于一级电离的主要原因是
③同浓度的CH3COO-、
 、
、 、S2-结合H+的能力由强到弱的顺序为
、S2-结合H+的能力由强到弱的顺序为
您最近一年使用:0次
2 . 830 K时,在1 L密闭容器中发生下列可逆反应:
 。回答下列问题:
。回答下列问题:
(1)若起始时, ,
, ,4 s后达到平衡,此时CO的转化率为60%
,4 s后达到平衡,此时CO的转化率为60%
①在相同温度下,该反应的平衡常数K=_______ 。
②从反应开始到达到平衡,用 表示的化学反应速率为
表示的化学反应速率为_______ 。
③达到平衡时,反应放出的热量为_______ kJ。
(2)在相同温度下,若起始时 ,
,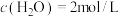 ,反应进行一段时间后,测得
,反应进行一段时间后,测得 的浓度为0.5 mol/L,则此时反应是否达到平衡状态:
的浓度为0.5 mol/L,则此时反应是否达到平衡状态:_______ (填“是”或“否”),此时v(正)_______ v(逆)(填“大于”“小于”或“等于”)。
(3)若升高温度,该反应的平衡常数_______ (填“增大”“减小”或“不变”)。

 。回答下列问题:
。回答下列问题:(1)若起始时,
 ,
, ,4 s后达到平衡,此时CO的转化率为60%
,4 s后达到平衡,此时CO的转化率为60%①在相同温度下,该反应的平衡常数K=
②从反应开始到达到平衡,用
 表示的化学反应速率为
表示的化学反应速率为③达到平衡时,反应放出的热量为
(2)在相同温度下,若起始时
 ,
, ,反应进行一段时间后,测得
,反应进行一段时间后,测得 的浓度为0.5 mol/L,则此时反应是否达到平衡状态:
的浓度为0.5 mol/L,则此时反应是否达到平衡状态:(3)若升高温度,该反应的平衡常数
您最近一年使用:0次
2022-11-17更新
|
192次组卷
|
3卷引用:宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题
名校
3 . 完成下列问题
(1)某温度(t℃)时,水的Kw=10-13,则该温度(填大于、等于或小于)_______ 25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=_______ ;
②若所得混合溶液pH=2, 则 a:b=_______ 。
(2)在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:
①同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小 的顺序是_______ ;(用a、b、c表示,下同)
②若三者c(H+)相同时,酸的物质的量浓度由大到小 的顺序为_______ ;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小 的顺序是_______ 。
(1)某温度(t℃)时,水的Kw=10-13,则该温度(填大于、等于或小于)
①若所得混合溶液为中性,则a:b=
②若所得混合溶液pH=2, 则 a:b=
(2)在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:
①同体积、同物质的量浓度的三种酸,中和NaOH的能力
②若三者c(H+)相同时,酸的物质的量浓度
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)
您最近一年使用:0次
2022-10-28更新
|
575次组卷
|
3卷引用:宁夏回族自治区吴忠中学2021-2022学年高二上学期期中考试化学试题
名校
4 . 请完成下列填空:
(1)同温同压下,同体积的CH4和SO2原子总数之比为___________ ,密度之比为___________ 。
(2)现有m g某气体A,其摩尔质量为M g/mol,则气体A在标准状况下的体积为___________ L;A溶于水后形成V mL溶液(A与水不反应),所得溶液的物质的量浓度为___________  。
。
(3)人造空气(氧气和氦气的混合气体)可用于减轻某些疾病或供深水潜水员使用,在标准状况下11.2L“人造空气”的质量是4.8g,其中氦气和氧气的分子数之比___________ ,氧气的质量是___________ g。
(4)三份相同体积的 的
的 溶液,可使相同体积的
溶液,可使相同体积的 溶液、
溶液、 溶液、
溶液、 溶液中的
溶液中的 完全沉淀,则上述三种硫酸盐溶液的物质的量浓度之比为
完全沉淀,则上述三种硫酸盐溶液的物质的量浓度之比为___________ 。
(1)同温同压下,同体积的CH4和SO2原子总数之比为
(2)现有m g某气体A,其摩尔质量为M g/mol,则气体A在标准状况下的体积为
 。
。(3)人造空气(氧气和氦气的混合气体)可用于减轻某些疾病或供深水潜水员使用,在标准状况下11.2L“人造空气”的质量是4.8g,其中氦气和氧气的分子数之比
(4)三份相同体积的
 的
的 溶液,可使相同体积的
溶液,可使相同体积的 溶液、
溶液、 溶液、
溶液、 溶液中的
溶液中的 完全沉淀,则上述三种硫酸盐溶液的物质的量浓度之比为
完全沉淀,则上述三种硫酸盐溶液的物质的量浓度之比为
您最近一年使用:0次
名校
解题方法
5 . 室温时,0.01mol·L-1的NaOH溶液的pH=___ ,该溶液中由水电离出的OH-浓度为____ ,该NaOH溶液与某浓度的盐酸等体积混合后pH为11,则盐酸的物质的量浓度为_____ 。
您最近一年使用:0次
6 . 化学平衡常数(K)、电离常数(Ka)、水解常数(Kh)、水的离子积常数(Kw)和溶度积常数(Ksp)都是判断物质性质或变化的重要常数。
(1)上述常数随着温度升高,一定增大的是_______ 。
(2)C(s)+CO2(g)⇌2CO(g),化学平衡常数表达式K =_______ 。
(3)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,则反应AgCl(s)+I-(aq) ⇌AgI(s)+Cl-(aq)的化学平衡常数是_______ 。
(4)弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为_______ 。
(5)25℃时,将a mol/L的醋酸溶液与0.01 mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)=c(CH3COO-),用含a的代数式表示醋酸的电离平衡常数Ka=_______ 。
(1)上述常数随着温度升高,一定增大的是
(2)C(s)+CO2(g)⇌2CO(g),化学平衡常数表达式K =
(3)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,则反应AgCl(s)+I-(aq) ⇌AgI(s)+Cl-(aq)的化学平衡常数是
(4)弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为
(5)25℃时,将a mol/L的醋酸溶液与0.01 mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)=c(CH3COO-),用含a的代数式表示醋酸的电离平衡常数Ka=
您最近一年使用:0次
7 . (1)0.5 mol气态高能燃料乙硼烷 在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为
在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为_________ 。已知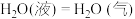
 ,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量
,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量____________
(2)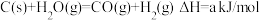 ,
,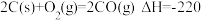
 ,又已知
,又已知 、
、 和
和 键的键能分别为
键的键能分别为 、
、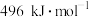 和
和 ,则a为
,则a为__________ 。
(3)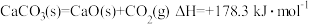 ,
, ,该反应能够自发进行,则温度所满足的条件是
,该反应能够自发进行,则温度所满足的条件是______________ 。
(4)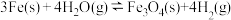 平衡常数的表达式为
平衡常数的表达式为____________ 。反应 的平衡常数为49,则该温度下反应
的平衡常数为49,则该温度下反应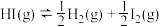 的平衡常数为
的平衡常数为____________ 。
 在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为
在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为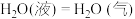
 ,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量
,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量(2)
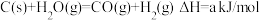 ,
,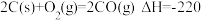
 ,又已知
,又已知 、
、 和
和 键的键能分别为
键的键能分别为 、
、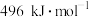 和
和 ,则a为
,则a为(3)
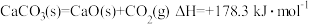 ,
, ,该反应能够自发进行,则温度所满足的条件是
,该反应能够自发进行,则温度所满足的条件是(4)
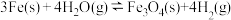 平衡常数的表达式为
平衡常数的表达式为 的平衡常数为49,则该温度下反应
的平衡常数为49,则该温度下反应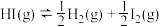 的平衡常数为
的平衡常数为
您最近一年使用:0次
2020-12-07更新
|
221次组卷
|
2卷引用:宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . 在容积为2L的密闭容器中,充入3mol N2和6mol H2,5分钟时NH3的物质的量浓度为0.4mol/L,则5分钟内v(H2)=_________________ ;v(N2)=_______________ ;此时,c(H2)=________________ ,H2的转化率为______________ 。
您最近一年使用:0次
名校
解题方法
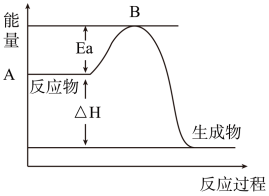
9 . Ⅰ.2SO2(g)+O2(g)⇌2SO3(g)△H=a kJ•mol﹣1,反应过程的能量变化如图所示.已知1molSO2(g)完全转化为1molSO3(g)放热99kJ.请回答:
(1)a=__ kJ•mol﹣1.
(2)Ea的大小对该反应的△H___ (填“有”或“无”)影响.该反应常用V2O5作催化剂,加入V2O5会使图中B点__ (填“升高”、“降低”或“不变”).
(3)已知单质硫的燃烧热为296kJ•mol﹣1,写出反应的热化学方程式:____ .
Ⅱ.(1)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是______________ .
(2)由盖斯定律结合下述反应方程式,回答问题:
(1)已知:①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
(1)a=
(2)Ea的大小对该反应的△H
(3)已知单质硫的燃烧热为296kJ•mol﹣1,写出反应的热化学方程式:

Ⅱ.(1)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是
(2)由盖斯定律结合下述反应方程式,回答问题:
(1)已知:①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
您最近一年使用:0次
名校
解题方法
10 . 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
(1)平衡常数的表达式K=__ ,该反应450℃的平衡常数__ 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是__ 。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为__ mol/(L•min),NH3的体积分数__ 。
 2NH3(g) △H<0
2NH3(g) △H<0(1)平衡常数的表达式K=
(2)下列描述中能说明上述反应已达平衡的是
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为
您最近一年使用:0次



