1 . 一定温度下,体积为2L的密闭容器中装有4molSO2和2molO2,发生反应2SO2+O2 2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
(1)2min末SO3的浓度是___________ ;
(2)2min内SO2的平均反应速率是___________ 。
(3)2min内O2的转化率是___________ 。
(4)该温度下的平衡常数为K=___________ L·mol-1。(计算结果)
 2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:(1)2min末SO3的浓度是
(2)2min内SO2的平均反应速率是
(3)2min内O2的转化率是
(4)该温度下的平衡常数为K=
您最近一年使用:0次
名校
2 . 有机物M可从酸牛奶中提取。已知纯净的M为无色黏液体,易溶于水。研究M的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取M4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)M的摩尔质量为: |
| (2)将此4.5gM在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | (2)M的分子式为: |
| (3)通过M的红外光谱图发现该分子中既有羟基,还有羧基 | (3)写出羟基电子式 |
M的核磁共振氢谱如下图: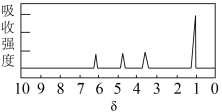 | (4)M中含有 (5)写出M中所含官能团的名称: (6)综上所述,M的结构简式为 |
您最近一年使用:0次
3 . )某化学小组为测定有机物G的组成和结构,设计如图实验装置:
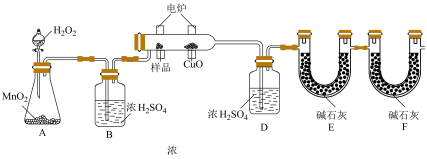
回答下列问题:
(1)实验开始时,先打开__________ (填装置名称),一段时间后再加热反应管C,目的是__________ 。写出A中发生的反应方程式:__________ 。
(2)装置B和装置D中浓硫酸的作用分别是__________ 和__________ 。
(3)装置E和装置F中碱石灰的作用分别是__________ 和__________ 。
(4)若准确称取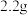 样品G(只含C、H、O三种元素),经充分燃烧后(
样品G(只含C、H、O三种元素),经充分燃烧后( 的作用是确保有机物充分氧化,最终生成
的作用是确保有机物充分氧化,最终生成 和
和 ),装置D质量增加
),装置D质量增加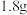 ,U形管E质量增加
,U形管E质量增加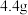 。又知有机物G的质谱图如图所示。
。又知有机物G的质谱图如图所示。
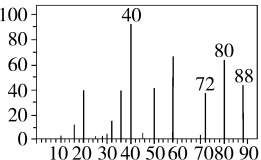
该有机物的分子式为__________ 。
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为 。综上所述,G的结构简式为
。综上所述,G的结构简式为__________ 。

回答下列问题:
(1)实验开始时,先打开
(2)装置B和装置D中浓硫酸的作用分别是
(3)装置E和装置F中碱石灰的作用分别是
(4)若准确称取
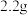 样品G(只含C、H、O三种元素),经充分燃烧后(
样品G(只含C、H、O三种元素),经充分燃烧后( 的作用是确保有机物充分氧化,最终生成
的作用是确保有机物充分氧化,最终生成 和
和 ),装置D质量增加
),装置D质量增加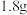 ,U形管E质量增加
,U形管E质量增加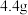 。又知有机物G的质谱图如图所示。
。又知有机物G的质谱图如图所示。
该有机物的分子式为
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为
 。综上所述,G的结构简式为
。综上所述,G的结构简式为
您最近一年使用:0次
名校
解题方法
4 . 求室温下,下列溶液的pH(已知:lg2≈0.3):
(1)某H2SO4溶液的浓度是0.005mol·L-1
①此溶液的pH为_____ 。
②用水稀释到原来体积的100倍,pH为_____ 。
③再继续稀释104倍,pH为_____ 。
(2)pH=3的盐酸与pH=5的硫酸等体积混合,pH为_____ 。
(3)pH=10和pH=12的两种NaOH溶液等体积混合,pH为_____ 。
(4)pH=12的NaOH溶液和pH=4的HCl溶液等体积混合,pH为_____ 。
(1)某H2SO4溶液的浓度是0.005mol·L-1
①此溶液的pH为
②用水稀释到原来体积的100倍,pH为
③再继续稀释104倍,pH为
(2)pH=3的盐酸与pH=5的硫酸等体积混合,pH为
(3)pH=10和pH=12的两种NaOH溶液等体积混合,pH为
(4)pH=12的NaOH溶液和pH=4的HCl溶液等体积混合,pH为
您最近一年使用:0次
5 . 某研究性学习小组为确定某有机物A(仅含C、H、O元素,分子中苯环上只有一个取代基)的结构,进行如下探究。请回答下列问题:
步骤一:将6.8 g有机物A放入如图1所示的装置中进行实验,假设生成的产物被完全吸收,实验结束后,无水氯化钙增重3.6 g,氢氧化钠固体增重17.6 g。


步骤二:升温使有机物A汽化,测得其密度是相同条件下 的68倍。
的68倍。
步骤三:利用红外光谱仪测得A的红外光谱信息如图2所示。
(1)A的相对分子质量是___________ ,实验式为___________ ,分子式为___________ 。
(2)若A能发生银镜反应,则其结构简式为___________ ,与NaOH溶液在加热条件下反应的化学方程式为___________ 。
(3)若A不能发生银镜反应,则其结构简式为___________ ,其核磁共振氢谱图上有___________ 组峰,且峰面积之比为___________ 。
步骤一:将6.8 g有机物A放入如图1所示的装置中进行实验,假设生成的产物被完全吸收,实验结束后,无水氯化钙增重3.6 g,氢氧化钠固体增重17.6 g。


步骤二:升温使有机物A汽化,测得其密度是相同条件下
 的68倍。
的68倍。步骤三:利用红外光谱仪测得A的红外光谱信息如图2所示。
(1)A的相对分子质量是
(2)若A能发生银镜反应,则其结构简式为
(3)若A不能发生银镜反应,则其结构简式为
您最近一年使用:0次
名校
解题方法
6 . 依据水溶液中的平衡相关原理,回答下列问题:
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是___________ mol∙L-1。
②计算此温度下HA的电离平衡常数Ka约为___________ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
以下说法正确的是___________。(填选项)
(3)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=2的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是___________ 。在纯碱溶液中下列关系成立的是___________
A.c(H+)+c(Na+)=c( )+c(
)+c( )+c(OH-)
)+c(OH-)
B.c( )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(OH-)-c(H+)= c( )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)=c( )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是
②计算此温度下HA的电离平衡常数Ka约为
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=4.0×10-8 |
以下说法正确的是___________。(填选项)
| A.向弱酸溶液中加入少量NaOH溶液,电离平衡常数变大 |
| B.25℃时NaClO的水解平衡常数约为2.5×10-7 |
| C.表中三种酸,酸性最强的是CH3COOH |
D.向NaClO溶液中通入少量CO2气体,可以发生反应:2ClO-+H2O+CO2==2HClO+ |
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是
A.c(H+)+c(Na+)=c(
 )+c(
)+c( )+c(OH-)
)+c(OH-) B.c(
 )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)C.c(OH-)-c(H+)= c(
 )+2c(H2CO3)
)+2c(H2CO3)D.c(Na+)=c(
 )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
您最近一年使用:0次
7 . 运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气,将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式
H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式______ 。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①400℃时,2NH3(g) N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=______ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正______ v(N2)逆(填“>”“<”“=”或“不能确定”)。
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡______ 移动(填“向左”、“向右”或“不”);反应的∆H______ (填“增大”、“减小”或“不变”)。
(3)水煤气转化反应CO(g)+H2O(g) CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
①平衡常数K(650℃)______ K(900℃)(填“大于”,“小于”或“等于”)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为______ 。
(1)生产氢气,将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式
H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式(2)已知在400℃时,N2(g)+3H2(g)
 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。①400℃时,2NH3(g)
 N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡
(3)水煤气转化反应CO(g)+H2O(g)
 CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:| 实验编号 | 温度/℃ | 起始量)/mol | 平衡量)/mol | 达到平衡所需时间)/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①平衡常数K(650℃)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为
您最近一年使用:0次
8 . 已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(1)假设饱和Mg(OH)2溶液的密度为1 g·mL-1,试求Mg(OH)2的溶解度为_______ g。
(2)在25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______ mol·L-1。
(3)25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成_______ 沉淀(填化学式);生成该沉淀的离子方程式为_______ ;当两种沉淀共存时,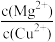 =
=_______ 。
(1)假设饱和Mg(OH)2溶液的密度为1 g·mL-1,试求Mg(OH)2的溶解度为
(2)在25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
(3)25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成
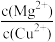 =
=
您最近一年使用:0次
2022-12-14更新
|
240次组卷
|
2卷引用:云南省广南县二中2021-2022年学年高二下学期开学考试化学试题
名校
解题方法
9 . 发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g) ΔH1=+68kJ·mol-1。
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=_______kJ·mol-1
③1molH2O(l)汽化时需吸收44kJ的热量。
④N2H4的结构简式为H2N—NH2,断裂1mol化学键需吸收的能量或形成1mol化学键需释放的能量(E)如下:
回答下列问题:
(1)计算ΔH2=_______ kJ·mol-1
(2)16gN2H4(g)与O2(g)完全反应生成H2O(l)时放出的热量为_______ kJ。
(3)写出N2H4(g)与NO2(g)反应生成H2O(g)时的热化学方程式:_______ 。
(4)1molN2H4(g)与NO2(g)完全反应生成H2O(g)时放出的热量为_______ kJ。
①N2(g)+2O2(g)=2NO2(g) ΔH1=+68kJ·mol-1。
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=_______kJ·mol-1
③1molH2O(l)汽化时需吸收44kJ的热量。
④N2H4的结构简式为H2N—NH2,断裂1mol化学键需吸收的能量或形成1mol化学键需释放的能量(E)如下:
化学键 | N-H | N-N | O=O | N≡N | H-O |
| E(kJ∙mol-1) | 391 | 154 | 498 | 946 | 463 |
回答下列问题:
(1)计算ΔH2=
(2)16gN2H4(g)与O2(g)完全反应生成H2O(l)时放出的热量为
(3)写出N2H4(g)与NO2(g)反应生成H2O(g)时的热化学方程式:
(4)1molN2H4(g)与NO2(g)完全反应生成H2O(g)时放出的热量为
您最近一年使用:0次
名校
10 . CO、 、
、 是工业上重要的化工原料。
是工业上重要的化工原料。
已知:①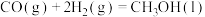
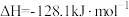
②
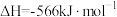
③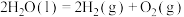
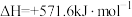
请回答下列问题:
(1)上述反应中属于放热反应的是_______ (填标号)。
(2)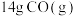 完全燃烧放出的热量为
完全燃烧放出的热量为_______ 。
(3)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
(4)1.5mol由CO和 组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、
组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、 的物质的量分别为
的物质的量分别为_______ mol、_______ mol。
(5)等质量的 、
、 、
、 完全燃烧,放热最多的是
完全燃烧,放热最多的是_______ (填化学式)。
(6)某些常见化学键的键能数据如下表:
则

_______  。
。
 、
、 是工业上重要的化工原料。
是工业上重要的化工原料。已知:①
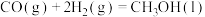
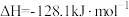
②

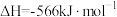
③
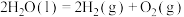
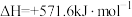
请回答下列问题:
(1)上述反应中属于放热反应的是
(2)
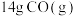 完全燃烧放出的热量为
完全燃烧放出的热量为(3)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(4)1.5mol由CO和
 组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、
组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、 的物质的量分别为
的物质的量分别为(5)等质量的
 、
、 、
、 完全燃烧,放热最多的是
完全燃烧,放热最多的是(6)某些常见化学键的键能数据如下表:
| 化学键 | C=O | H—O | H—H |  |
键能 | 803 | 463 | 436 | 1076 |


 。
。
您最近一年使用:0次
2022-11-07更新
|
346次组卷
|
6卷引用:云南省名校联盟2022-2023学年高二上学期9月大联考化学试题



