1 . 实验室一瓶硫酸亚铁和硫酸铁混合物,取一定量样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·Lˉ1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸铁物质的量是
(2)若在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,最后残渣的质量是
您最近一年使用:0次
解题方法
2 . “孤蓬自振”学习小组向一定质量的Fe、FeO、Fe2O3的混合物中,加入100mL1.0mol/L的盐酸,恰好使混合物完全溶解并放出约224mL(标准状况)气体,溶液体积仍为100mL,所得溶液中滴加几滴KSCN溶液,溶液未显红色。请回答:
(1)加盐酸后所得溶液的溶质是______ (填化学式),物质的量浓度是______ mol/L。
(2)若用足量的CO在高温下还原相同质量的该混合物,最多能得到单质铁的质量是______ g。
(3)该混合物中铁、氧两种元素的粒子个数比N(Fe):N(O)=______ 。
(1)加盐酸后所得溶液的溶质是
(2)若用足量的CO在高温下还原相同质量的该混合物,最多能得到单质铁的质量是
(3)该混合物中铁、氧两种元素的粒子个数比N(Fe):N(O)=
您最近一年使用:0次
解题方法
3 . 常温下,将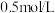 盐酸溶液和未知浓度的
盐酸溶液和未知浓度的 溶液以
溶液以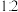 的体积比混合(忽略溶液体积变化),所得溶液的
的体积比混合(忽略溶液体积变化),所得溶液的 。用上述
。用上述 溶液与
溶液与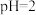 的某一元弱酸溶液
的某一元弱酸溶液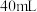 恰好完全反应,消耗了
恰好完全反应,消耗了 溶液
溶液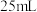 ,试求:
,试求:
(1) 溶液的物质的量浓度为
溶液的物质的量浓度为______  。
。
(2)该一元弱酸的物质的量浓度为______  。
。
(3)此条件下该一元弱酸的电离度为______ 。
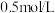 盐酸溶液和未知浓度的
盐酸溶液和未知浓度的 溶液以
溶液以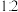 的体积比混合(忽略溶液体积变化),所得溶液的
的体积比混合(忽略溶液体积变化),所得溶液的 。用上述
。用上述 溶液与
溶液与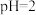 的某一元弱酸溶液
的某一元弱酸溶液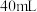 恰好完全反应,消耗了
恰好完全反应,消耗了 溶液
溶液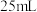 ,试求:
,试求:(1)
 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(2)该一元弱酸的物质的量浓度为
 。
。(3)此条件下该一元弱酸的电离度为
您最近一年使用:0次
名校
4 . 某有机物X(分子组成可表示为CxHyOz)是生物体的一种代谢产物,在不同的生命体中发挥不同的功能。现对X进行相关实验:
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为___________ ;X分解产物的化学式为___________ 。
(2)通过计算推导出X的分子式(写出计算过程)___________ 。
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为___________ 。
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为
(2)通过计算推导出X的分子式(写出计算过程)
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO
 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
您最近一年使用:0次
2024-02-24更新
|
149次组卷
|
2卷引用:浙江省宁波市北仑中学2023-2024学年高二下学期期中考试化学试题
解题方法
5 . 将一定量的CO2通入20mL未知浓度的NaOH溶液中,在所得的溶液中逐滴加入0.lmol/L稀盐酸至过量,并将溶液加热,产生的气体的体积与加入稀盐酸的体积关系如图所示(忽略气体的溶解和盐酸的挥发)。
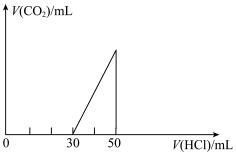
(1)原NaOH溶液的物质的量浓度___________ mol/L。
(2)当30mL<V<50ml时,溶液中发生反应的离子方程式___________ 。
(3)标准状况下,通入CO2的体积为___________ 。

(1)原NaOH溶液的物质的量浓度
(2)当30mL<V<50ml时,溶液中发生反应的离子方程式
(3)标准状况下,通入CO2的体积为
您最近一年使用:0次
6 . 完成下列问题
(1)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.10mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。(已知Kb(NH3·H2O)=1.8×10-5;lg3=0.5,lg5=0.7)

①图中a~e五个点,水的电离程度由大到小的顺序是___________ 。
②计算b点的pH值约为___________ 。
③d点,溶液中c(Na+)、c( )、c(
)、c( )、c(NH3·H2O)由大到小的排列顺序是
)、c(NH3·H2O)由大到小的排列顺序是___________ 。
④当滴加NaOH溶液至pH=8时,c(Na+)+c( )-2c(
)-2c( )=
)=___________ mol·L-1(列出数值,不必计算)。
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.02mol·L-1的盐酸,生成沉淀,已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,则溶液中c(Ag+)=___________ mol·L-1。如果向完全沉淀后的溶液中继续加入100mL0.01 mol·L-1的盐酸,是否有白色沉淀生成?(请写出计算过程)___________ 。
(1)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.10mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。(已知Kb(NH3·H2O)=1.8×10-5;lg3=0.5,lg5=0.7)

①图中a~e五个点,水的电离程度由大到小的顺序是
②计算b点的pH值约为
③d点,溶液中c(Na+)、c(
 )、c(
)、c( )、c(NH3·H2O)由大到小的排列顺序是
)、c(NH3·H2O)由大到小的排列顺序是④当滴加NaOH溶液至pH=8时,c(Na+)+c(
 )-2c(
)-2c( )=
)=(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.02mol·L-1的盐酸,生成沉淀,已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,则溶液中c(Ag+)=
您最近一年使用:0次
名校
解题方法
7 . 由化学能产生热能是目前人类使用能源的主要途径。回答下列问题:
(1)如图表示反应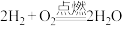 的能量变化。
的能量变化。

已知断开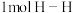 键、
键、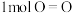 键和
键和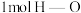 键分别需要消耗
键分别需要消耗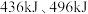 和
和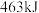 的能量。则反应过程(Ⅱ)中生成
的能量。则反应过程(Ⅱ)中生成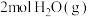 时放出能量
时放出能量______ kJ能量。
(2)已知某温度下 的溶解热为
的溶解热为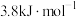 (吸热)
(吸热)

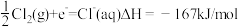
写出该温度下钠在氯气中燃烧的热化学方程式___________ 。
(3) 溶液与
溶液与 锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。(已知:反应前后,溶液的比热容均近似为
锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。(已知:反应前后,溶液的比热容均近似为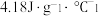 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。)请计算:
,忽略溶液体积、质量变化和金属吸收的热量。)请计算:
①该反应放出的热量
____ J。
②反应 的
的
_____  。
。
(1)如图表示反应
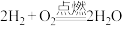 的能量变化。
的能量变化。
已知断开
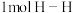 键、
键、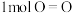 键和
键和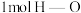 键分别需要消耗
键分别需要消耗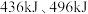 和
和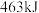 的能量。则反应过程(Ⅱ)中生成
的能量。则反应过程(Ⅱ)中生成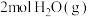 时放出能量
时放出能量(2)已知某温度下
 的溶解热为
的溶解热为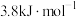 (吸热)
(吸热)
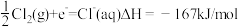
写出该温度下钠在氯气中燃烧的热化学方程式
(3)
 溶液与
溶液与 锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。(已知:反应前后,溶液的比热容均近似为
锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。(已知:反应前后,溶液的比热容均近似为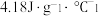 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。)请计算:
,忽略溶液体积、质量变化和金属吸收的热量。)请计算:①该反应放出的热量

②反应
 的
的
 。
。
您最近一年使用:0次
解题方法
8 . 回答下列问题
(1)在25℃、101kPa下,1g甲醇( )液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:
)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:___________ 。
(2)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
 。
。
已知:碳的燃烧热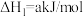 ,
,
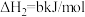 ,
, 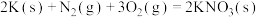
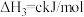 ,则x为
,则x为___________ kJ/mol。
(3)一定条件下,在水溶液中所含离子 、
、 、
、 、
、 、
、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应
各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应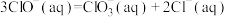 的
的
___________ kJ/mol。

(1)在25℃、101kPa下,1g甲醇(
 )液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:
)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:(2)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为

 。
。已知:碳的燃烧热
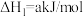 ,
,
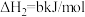 ,
, 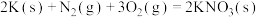
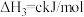 ,则x为
,则x为(3)一定条件下,在水溶液中所含离子
 、
、 、
、 、
、 、
、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应
各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应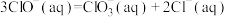 的
的

您最近一年使用:0次
名校
解题方法
9 . 完成下列计算:
(1)已知工业上制取硫酸需要发生以下反应
Ⅰ. ;Ⅱ.
;Ⅱ. ;Ⅲ.
;Ⅲ.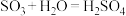
①假设在生产中所有反应完全进行,则每生产1.00吨98%的浓硫酸需要
______ 吨。(保留2位小数)
②实际生产中可能会有损耗(即存在反应物没有发生反应),假设反应Ⅰ中 损耗率为20%,反应Ⅱ中
损耗率为20%,反应Ⅱ中 损耗率为10%,则实际生产1吨98%浓硫酸需要
损耗率为10%,则实际生产1吨98%浓硫酸需要
______ 吨。(保留2位小数)
(2)取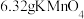 固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为
固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为 。
。
① 分解生成氧气的物质的量
分解生成氧气的物质的量
______ mol
② 分解的百分率为
分解的百分率为______ %;
③第二步反应中生成氯气的物质的量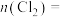
______ mol
(1)已知工业上制取硫酸需要发生以下反应
Ⅰ.
 ;Ⅱ.
;Ⅱ.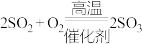 ;Ⅲ.
;Ⅲ.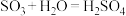
①假设在生产中所有反应完全进行,则每生产1.00吨98%的浓硫酸需要

②实际生产中可能会有损耗(即存在反应物没有发生反应),假设反应Ⅰ中
 损耗率为20%,反应Ⅱ中
损耗率为20%,反应Ⅱ中 损耗率为10%,则实际生产1吨98%浓硫酸需要
损耗率为10%,则实际生产1吨98%浓硫酸需要
(2)取
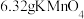 固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为
固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为 。
。①
 分解生成氧气的物质的量
分解生成氧气的物质的量
②
 分解的百分率为
分解的百分率为③第二步反应中生成氯气的物质的量
您最近一年使用:0次
2023-11-06更新
|
180次组卷
|
2卷引用:11-2023新东方高二上期中考化学11
10 . 现有含HCl和 的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
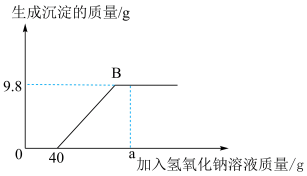
(1)当加入 溶液质量为ag时,溶液中的溶质有
溶液质量为ag时,溶液中的溶质有___________ (写出化学式);
(2)NaOH中Na元素的质量分数___________ (写出计算式);
(3)求混合溶液中 的质量分数
的质量分数___________ (写出计算过程);
(4)求恰好完全反应时,消耗NaOH溶液的总质量___________ (写出计算过程)。
 的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
(1)当加入
 溶液质量为ag时,溶液中的溶质有
溶液质量为ag时,溶液中的溶质有(2)NaOH中Na元素的质量分数
(3)求混合溶液中
 的质量分数
的质量分数(4)求恰好完全反应时,消耗NaOH溶液的总质量
您最近一年使用:0次
2023-10-11更新
|
161次组卷
|
3卷引用:12-2023新东方高二上期中考化学12
12-2023新东方高二上期中考化学12北京市首都师范大学附属中学2023-2024学年高一上学期10月月考化学试题(已下线)【精品卷】3.2.2 物质的量在化学方程式计算中的应用课堂例题-人教版2023-2024学年必修第一册



