用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)生产ZnSO4∙7H2O的流程如下(已知PbO不溶于稀硫酸酸):
(1)“酸浸”时用的稀酸是_______ (写名称)。
(2)加入NaClO的目的是_______ ,加入ZnO除杂时pH控制范围是_______ ~5.0。
(3)写出ZnO除杂得到滤渣2的离子反应方程式_______ 。
(4)滤渣3是_______ (写化学式) 。
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、_______ 、 过滤、洗涤、干燥。
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=_______ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
| 沉淀完全的pH | 3.0 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是
(2)加入NaClO的目的是
(3)写出ZnO除杂得到滤渣2的离子反应方程式
(4)滤渣3是
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=
更新时间:2024-05-09 12:43:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】废气中的H2S可用电解、Fe2(SO4)3吸收和活性炭吸附氧化等多种方法脱除。
(1)电解法脱除:将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-=S (n-1)S+S2-=S
___________ 。
②电解后阳极区溶液用稀硫酸酸化得到硫单质,其离子方程式为___________ 。
(2)Fe2(SO4)3吸收脱除:用Fe2(SO4)3溶液吸收H2S,其反应后的溶液可在硫杆菌作用下实现吸收液的再生。
①用Fe2(SO4)3吸收液脱除H2S的原理经历以下三步:
第一步:H2S(g) H2S(aq)
H2S(aq)
第二步:H2S H++HS-
H++HS-
第三步:HS-+2Fe3+=S↓+2Fe2++H+
一定条件下,不同Fe3+浓度溶液及该溶液起始pH与脱硫率的关系如图所示。当Fe3+浓度大于10 g·L-1时,随着Fe3+浓度增大,脱硫率逐渐降低。其原因是___________ 。 2Fe2(SO4)3+2H2O。反应相同时间后,溶液中Fe2+的氧化速率与温度的关系如图所示。温度超过30℃后,随着温度升高,Fe2+的氧化速率下降的原因是
2Fe2(SO4)3+2H2O。反应相同时间后,溶液中Fe2+的氧化速率与温度的关系如图所示。温度超过30℃后,随着温度升高,Fe2+的氧化速率下降的原因是___________ 。
①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是___________ 。
②若水膜过厚,H2S的氧化去除率减小的原因是___________ 。
(1)电解法脱除:将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-=S (n-1)S+S2-=S


②电解后阳极区溶液用稀硫酸酸化得到硫单质,其离子方程式为
(2)Fe2(SO4)3吸收脱除:用Fe2(SO4)3溶液吸收H2S,其反应后的溶液可在硫杆菌作用下实现吸收液的再生。
①用Fe2(SO4)3吸收液脱除H2S的原理经历以下三步:
第一步:H2S(g)
 H2S(aq)
H2S(aq)第二步:H2S
 H++HS-
H++HS-第三步:HS-+2Fe3+=S↓+2Fe2++H+
一定条件下,不同Fe3+浓度溶液及该溶液起始pH与脱硫率的关系如图所示。当Fe3+浓度大于10 g·L-1时,随着Fe3+浓度增大,脱硫率逐渐降低。其原因是

 2Fe2(SO4)3+2H2O。反应相同时间后,溶液中Fe2+的氧化速率与温度的关系如图所示。温度超过30℃后,随着温度升高,Fe2+的氧化速率下降的原因是
2Fe2(SO4)3+2H2O。反应相同时间后,溶液中Fe2+的氧化速率与温度的关系如图所示。温度超过30℃后,随着温度升高,Fe2+的氧化速率下降的原因是
①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
②若水膜过厚,H2S的氧化去除率减小的原因是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】 是重要的化工原料,具有多种用途。回答下列问题:
是重要的化工原料,具有多种用途。回答下列问题:
(1) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(2)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
①已知 能发生如下反应:
能发生如下反应: 。上述反应中氧化剂是
。上述反应中氧化剂是___________ ,氧化产物是___________ ; 在反应中体现了
在反应中体现了___________ (填性质)。
②根据上述反应鉴别 和
和 。可选用的物质有
。可选用的物质有___________ (填字母)。
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的 ,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为___________ 。
 是重要的化工原料,具有多种用途。回答下列问题:
是重要的化工原料,具有多种用途。回答下列问题:(1)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式(2)将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(3)查阅资料知:
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。①已知
 能发生如下反应:
能发生如下反应: 。上述反应中氧化剂是
。上述反应中氧化剂是 在反应中体现了
在反应中体现了②根据上述反应鉴别
 和
和 。可选用的物质有
。可选用的物质有A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的
 ,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将10g样品加热至质量不再发生变化,其质量变为6.9g,则该纯碱样品的纯度(即质量分数)为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】叠氮化钠(NaN3)是一种防腐剂和分析试剂,在有机合成和汽车行业也有重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
I.氨基钠(NaNH2)熔点为208℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸
Ⅱ.2HNO3+8HCl+4SnCl2=4SnCl4+5H2O+N2O↑,2NaNH2+N2O NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
回答下列问题:
(1)制备NaN3
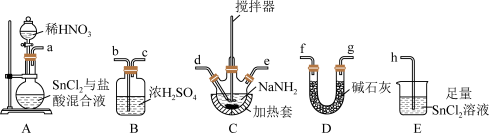
①按气流方向,上述装置合理的连接顺序为___________ (填仪器接口字母)。
②B的作用为___________ 。
③实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为___________ 。
④C处充分反应后,需继续进行的操作为___________
A. 先关闭分液漏斗活塞,后停止加热 B. 先停止加热,后关闭分液漏斗活塞
(2)用如图所示装置测定产品纯度(测定原理为:ClO-+2 +H2O=Cl-+3N2↑+2OH-),取m g反应后C中所得固体加入到蒸馏烧瓶中发生上述反应;
+H2O=Cl-+3N2↑+2OH-),取m g反应后C中所得固体加入到蒸馏烧瓶中发生上述反应;
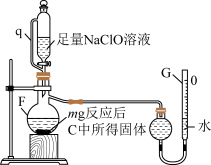
①管q的作用为___________ 。
②若G的初始读数为V1 mL、末读数为V2 mL,本实验条件下气体摩尔体积为Vm L·mol-1,则产品中NaN3的质量分数为___________
③反应结束读数时,若G中液面高于球形干燥管液面,则测定结果___________ (填“偏高”、“偏低”或不影响)
查阅资料:
I.氨基钠(NaNH2)熔点为208℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸
Ⅱ.2HNO3+8HCl+4SnCl2=4SnCl4+5H2O+N2O↑,2NaNH2+N2O
 NaN3+NaOH+NH3。
NaN3+NaOH+NH3。回答下列问题:
(1)制备NaN3

①按气流方向,上述装置合理的连接顺序为
②B的作用为
③实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为
④C处充分反应后,需继续进行的操作为
A. 先关闭分液漏斗活塞,后停止加热 B. 先停止加热,后关闭分液漏斗活塞
(2)用如图所示装置测定产品纯度(测定原理为:ClO-+2
 +H2O=Cl-+3N2↑+2OH-),取m g反应后C中所得固体加入到蒸馏烧瓶中发生上述反应;
+H2O=Cl-+3N2↑+2OH-),取m g反应后C中所得固体加入到蒸馏烧瓶中发生上述反应;
①管q的作用为
②若G的初始读数为V1 mL、末读数为V2 mL,本实验条件下气体摩尔体积为Vm L·mol-1,则产品中NaN3的质量分数为
③反应结束读数时,若G中液面高于球形干燥管液面,则测定结果
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】孔雀石的主要成分为CuCO3·Cu(OH)2。设计从孔雀石中冶炼铜的方案如下:
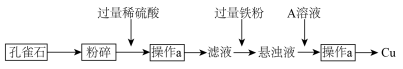
(1)将孔雀石粉碎的目的是_______ ,加入过量稀硫酸,可观察到的现象是_______ 。
(2)操作a的名称是_______ ,在滤液中加入过量铁粉发生的反应有___________ (用离子方程式表示)。
(3)在悬浊液中加入A的目的是______________ 。

(1)将孔雀石粉碎的目的是
(2)操作a的名称是
(3)在悬浊液中加入A的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某油脂厂废弃的催化剂主要含有金属Pb、Al、Fe及其氧化物,采用如图工艺流程回收其中的铝并制备绿矾晶体( )。
)。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)废催化剂“酸浸”前,先用热的 溶液除去表面的油污,然后粉碎,用离子方程式表示
溶液除去表面的油污,然后粉碎,用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:_______ 。粉碎的主要目的为_______ 。
(2)滤渣1的主要成分为_______ (填化学式),加入M发生反应的离子方程式为_______ 。
(3)“沉铝”时pH应该控制的范围为_______ ,若“沉铝”时用 溶液代替NaOH溶液,则滤渣2为碱式碳酸铝
溶液代替NaOH溶液,则滤渣2为碱式碳酸铝 ,同时有
,同时有 逸出,写出该反应的离子方程式:
逸出,写出该反应的离子方程式:_______ 。
(4)铝电池有广泛应用前景,一种可充放电的铝离子电池工作原理如图所示,电解质为 离子液体,CuS在电池反应后转化为
离子液体,CuS在电池反应后转化为 和
和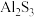 。
。

放电时,负极每消耗1mol ,有
,有_______ gAl溶解。该电池充电时,阳极反应式为_______ 。
 )。
)。
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 3.7 | 2.2 | 7.5 |
沉淀完全时(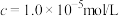 )的pH )的pH | 4.7 | 3.2 | 9.0 |
回答下列问题:
(1)废催化剂“酸浸”前,先用热的
 溶液除去表面的油污,然后粉碎,用离子方程式表示
溶液除去表面的油污,然后粉碎,用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:(2)滤渣1的主要成分为
(3)“沉铝”时pH应该控制的范围为
 溶液代替NaOH溶液,则滤渣2为碱式碳酸铝
溶液代替NaOH溶液,则滤渣2为碱式碳酸铝 ,同时有
,同时有 逸出,写出该反应的离子方程式:
逸出,写出该反应的离子方程式:(4)铝电池有广泛应用前景,一种可充放电的铝离子电池工作原理如图所示,电解质为
 离子液体,CuS在电池反应后转化为
离子液体,CuS在电池反应后转化为 和
和 。
。
放电时,负极每消耗1mol
 ,有
,有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】I.某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

(1)请写出上述实验中加入或生成的有关物质的化学式。
①_______ ;
④_______ 。
(2)写出向②⑤的混合液中通入⑥的离子方程式:_______
II.某同学在实验室利用Fe-Mg合金废料制备金属镁,其工艺流程如图。回答下列问题:

(3)工业上常将Fe-Mg合金废料粉碎后再“酸溶”,其目的是_______ 。
(4)“酸溶”时,Fe发生反应的离子方程式为____ ;写出“氧化”时反应的离子方程式____ 。
(5)制备无水MgCl2过程中,需要将SOCl2与MgCl2·6H2O混合并加热,试解释原因_______ 。

(1)请写出上述实验中加入或生成的有关物质的化学式。
①
④
(2)写出向②⑤的混合液中通入⑥的离子方程式:
II.某同学在实验室利用Fe-Mg合金废料制备金属镁,其工艺流程如图。回答下列问题:

(3)工业上常将Fe-Mg合金废料粉碎后再“酸溶”,其目的是
(4)“酸溶”时,Fe发生反应的离子方程式为
(5)制备无水MgCl2过程中,需要将SOCl2与MgCl2·6H2O混合并加热,试解释原因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】以含镍废硫酸盐(含 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等)为原料制取
等)为原料制取 的工艺流程如图:
的工艺流程如图:

相关金属离子形成氢氧化物沉淀的 范围如表:
范围如表:
请回答下列问题:
(1)已知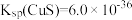 ,
, ,则反应
,则反应 的平衡常数K=
的平衡常数K=_______ 。
(2)“除铁、钴”时,加入 的目的是
的目的是_______ ,得到的滤渣X为_______ 。
(3)“除铝、铬”时,调 范围为
范围为_______ 。
(4)“酸溶”得到溶液制备 晶体,还需进行的操作流程是蒸发浓缩、
晶体,还需进行的操作流程是蒸发浓缩、_______ 、过滤、洗涤、干燥。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等)为原料制取
等)为原料制取 的工艺流程如图:
的工艺流程如图:
相关金属离子形成氢氧化物沉淀的
 范围如表:
范围如表:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的 | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
(1)已知
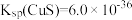 ,
, ,则反应
,则反应 的平衡常数K=
的平衡常数K=(2)“除铁、钴”时,加入
 的目的是
的目的是(3)“除铝、铬”时,调
 范围为
范围为(4)“酸溶”得到溶液制备
 晶体,还需进行的操作流程是蒸发浓缩、
晶体,还需进行的操作流程是蒸发浓缩、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上利用黑钨矿(其主要成分是 、
、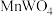 ,同时还含有少量
,同时还含有少量 )制备钮的工艺流程如下图所示:
)制备钮的工艺流程如下图所示:

已知:①
②
回答下列问题:
(1)黑钨矿“焙烧”前需充分研磨,目的是___________ 。“焙烧”过程中发生的其他反应的化学方程式为___________ 。
(2)“滤渣1”的成分是___________ (填化学式,下同),“滤渣2”的成分是___________ 。
(3)将 还原成
还原成 单质,使用的还原剂可以用
单质,使用的还原剂可以用 、
、 或
或___________ (填一种常见金属名称)。
(4)钨酸钙( )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下 和
和 的饱和溶液中,
的饱和溶液中, 与
与 (阴离子)的关系如图所示,已知:
(阴离子)的关系如图所示,已知: (离子)
(离子) (离子)。该温度下将
(离子)。该温度下将 溶液加入石灰乳中得到大量钨酸钙,发生反应的离子方程式为
溶液加入石灰乳中得到大量钨酸钙,发生反应的离子方程式为___________ ,该反应的平衡常数
___________ 。

(5)合金具有比金属单质更优越的性能,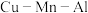 合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。
合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。

①若A原子的坐标参数为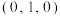 ,则B原子的坐标参数为
,则B原子的坐标参数为___________ 。
②已知该合金晶体的密度为 ,则最近的两个
,则最近的两个 原子间的距离为
原子间的距离为___________  (列出计算式,阿伏加德罗常数的值用
(列出计算式,阿伏加德罗常数的值用 表示)。
表示)。
 、
、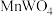 ,同时还含有少量
,同时还含有少量 )制备钮的工艺流程如下图所示:
)制备钮的工艺流程如下图所示:
已知:①

②

回答下列问题:
(1)黑钨矿“焙烧”前需充分研磨,目的是
(2)“滤渣1”的成分是
(3)将
 还原成
还原成 单质,使用的还原剂可以用
单质,使用的还原剂可以用 、
、 或
或(4)钨酸钙(
 )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下 和
和 的饱和溶液中,
的饱和溶液中, 与
与 (阴离子)的关系如图所示,已知:
(阴离子)的关系如图所示,已知: (离子)
(离子) (离子)。该温度下将
(离子)。该温度下将 溶液加入石灰乳中得到大量钨酸钙,发生反应的离子方程式为
溶液加入石灰乳中得到大量钨酸钙,发生反应的离子方程式为

(5)合金具有比金属单质更优越的性能,
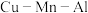 合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。
合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。
①若A原子的坐标参数为
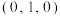 ,则B原子的坐标参数为
,则B原子的坐标参数为②已知该合金晶体的密度为
 ,则最近的两个
,则最近的两个 原子间的距离为
原子间的距离为 (列出计算式,阿伏加德罗常数的值用
(列出计算式,阿伏加德罗常数的值用 表示)。
表示)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某软锰矿的主要成分是 ,还含有CaO、
,还含有CaO、 、FeS等杂质,以该软锰矿为原料制备碳酸锰(
、FeS等杂质,以该软锰矿为原料制备碳酸锰( )的工业流程图如下:
)的工业流程图如下:

已知:①部分阳离子沉淀时溶液的pH如下表。
② 为难溶物
为难溶物
回答下列问题:
(1)用稀硫酸“浸出”软锰矿时,要在适当的高温下进行,并不断搅拌的目的是_______ ;若在“浸出”液中加入KSCN溶液,溶液呈血红色,写出在酸溶过程中FeS发生反应的离子方程式:_______ 。
(2)“操作Ⅰ”需要加入试剂X调节溶液的pH,试剂X最好选用_______ (填字母);
A. 溶液 B.NaOH溶液 C.氨水 D.
溶液 B.NaOH溶液 C.氨水 D. 固体
固体
已知室温下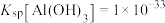 ,
, ,则室温下“操作Ⅰ”中除去杂质离子(要求杂质离子浓度均小于
,则室温下“操作Ⅰ”中除去杂质离子(要求杂质离子浓度均小于 )所需调节溶液的pH在
)所需调节溶液的pH在_______ 范围内。
(3)写出“沉锰”时加入足量 的离子方程式为
的离子方程式为_______ ;“沉锰”后需要过滤、洗涤碳酸锰沉淀,检验碳酸锰洗涤干净的方法是_______ 。
 ,还含有CaO、
,还含有CaO、 、FeS等杂质,以该软锰矿为原料制备碳酸锰(
、FeS等杂质,以该软锰矿为原料制备碳酸锰( )的工业流程图如下:
)的工业流程图如下:
已知:①部分阳离子沉淀时溶液的pH如下表。
| 阳离子 |  |  |
| 开始沉淀的pH | 8.8 | 10.6 |
| 沉淀完全的pH | 10.1 | 13.1 |
 为难溶物
为难溶物回答下列问题:
(1)用稀硫酸“浸出”软锰矿时,要在适当的高温下进行,并不断搅拌的目的是
(2)“操作Ⅰ”需要加入试剂X调节溶液的pH,试剂X最好选用
A.
 溶液 B.NaOH溶液 C.氨水 D.
溶液 B.NaOH溶液 C.氨水 D. 固体
固体已知室温下
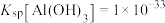 ,
, ,则室温下“操作Ⅰ”中除去杂质离子(要求杂质离子浓度均小于
,则室温下“操作Ⅰ”中除去杂质离子(要求杂质离子浓度均小于 )所需调节溶液的pH在
)所需调节溶液的pH在(3)写出“沉锰”时加入足量
 的离子方程式为
的离子方程式为
您最近一年使用:0次



