名校
解题方法
1 . 现有下列8种物质:① ②小苏打 ③
②小苏打 ③ 溶液 ④
溶液 ④ ⑤酒精 ⑥
⑤酒精 ⑥ ⑦氢氧化铁胶体 ⑧空气
⑦氢氧化铁胶体 ⑧空气
(1) 属于分散系的是___________ (填物质序号),小苏打在水中的电离方程式为___________ 。工业制漂白粉的方程式是___________ 。
(2)若氢氧化铁胶体中混有少量的 溶液,提纯的方法是___________。
溶液,提纯的方法是___________。
(3) ⑤酒精分子中含氢原子的物质的量为
⑤酒精分子中含氢原子的物质的量为___________ ,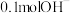 所含电子为
所含电子为___________ 个。
(4)同质量的 和
和 气体在相同条件下的体积比为
气体在相同条件下的体积比为___________ ,其中含有的氢原子数目比为___________ ,由 和
和 组成的混合气体20克,标准状态下体积
组成的混合气体20克,标准状态下体积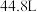 ,则氨气与氢气的物质的量为
,则氨气与氢气的物质的量为___________ 。
 ②小苏打 ③
②小苏打 ③ 溶液 ④
溶液 ④ ⑤酒精 ⑥
⑤酒精 ⑥ ⑦氢氧化铁胶体 ⑧空气
⑦氢氧化铁胶体 ⑧空气(1) 属于分散系的是
(2)若氢氧化铁胶体中混有少量的
 溶液,提纯的方法是___________。
溶液,提纯的方法是___________。| A.蒸馏(分馏) | B.过滤 | C.渗析 | D.蒸发 |
 ⑤酒精分子中含氢原子的物质的量为
⑤酒精分子中含氢原子的物质的量为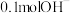 所含电子为
所含电子为(4)同质量的
 和
和 气体在相同条件下的体积比为
气体在相同条件下的体积比为 和
和 组成的混合气体20克,标准状态下体积
组成的混合气体20克,标准状态下体积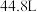 ,则氨气与氢气的物质的量为
,则氨气与氢气的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 填写下列空白:
(1)工业上湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、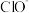 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式___________ ;若反应过程中转移了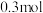 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________  。
。
(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是___________ g。
(4)将 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)等质量的铝分别与 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:___________ ;铝的质量为___________ g。
(6)将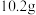 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入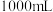 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为___________  。
。
(1)工业上湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、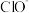 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式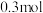 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的
 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是(4)将
 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为(5)等质量的铝分别与
 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:(6)将
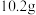 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入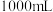 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为 。
。
您最近一年使用:0次
名校
解题方法
3 . 完成下列两小题的计算:
(1)现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L。
①该混合气体的平均摩尔质量为______ ,混合气体中碳原子的个数为______ (用NA表示阿伏加德罗常数)。
②将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
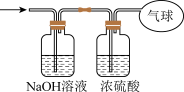
气球中收集到的气体的摩尔质量为______ ,气球的体积为______  。
。
(2) 固体中含有部分
固体中含有部分 。取该固体
。取该固体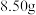 充分加热,产生的气体依次通过浓硫酸(增重
充分加热,产生的气体依次通过浓硫酸(增重 )和碱石灰(增重
)和碱石灰(增重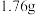 )。请计算:
)。请计算:
①加热分解产生的气体中 在标准状况下的体积为
在标准状况下的体积为______ L。
②固体中 的质量为
的质量为______ g。
③固体中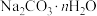 的
的 值为
值为______ 。
(1)现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L。
①该混合气体的平均摩尔质量为
②将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。

气球中收集到的气体的摩尔质量为
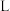 。
。(2)
 固体中含有部分
固体中含有部分 。取该固体
。取该固体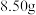 充分加热,产生的气体依次通过浓硫酸(增重
充分加热,产生的气体依次通过浓硫酸(增重 )和碱石灰(增重
)和碱石灰(增重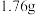 )。请计算:
)。请计算:①加热分解产生的气体中
 在标准状况下的体积为
在标准状况下的体积为②固体中
 的质量为
的质量为③固体中
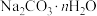 的
的 值为
值为
您最近一年使用:0次
2024-01-10更新
|
148次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
4 . 根据所学知识填空(NA表示阿伏加德罗常数的值):
(1)98gH2SO4的物质的量是___________ mol,含有___________ g H原子。
(2)约1.204×1024个CO的物质的量是___________ mol;与___________ molNa2O2含有的氧原子数相等。
(3)标准状况下,67.2LCO2是_______ mol,质量为_______ g,含有______ 个CO2分子,含有___________ mol氧原子。
(1)98gH2SO4的物质的量是
(2)约1.204×1024个CO的物质的量是
(3)标准状况下,67.2LCO2是
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以用化学方法处理
的浓度,可以用化学方法处理 ,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
①上述反应中,氧化产物为_______ (用化学式表示)。
②在上述反应中,每生成1molN2,被氧化的物质_______ g。
③请配平下列离子方程式:_______ 。
_______ _______
_______ _______
_______ _______
_______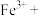 _______
_______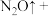 _______
_______
(2)向200mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。

①原NaOH溶液的浓度为_______
②所得溶液的溶质成分为_______ ,其物质的量之比为_______
(3)已知: ,该反应中被1molNa2O2氧化的FeSO4为
,该反应中被1molNa2O2氧化的FeSO4为_______ mol。
(1)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以用化学方法处理
的浓度,可以用化学方法处理 ,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。①上述反应中,氧化产物为
②在上述反应中,每生成1molN2,被氧化的物质
③请配平下列离子方程式:
_______
 _______
_______ _______
_______ _______
_______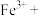 _______
_______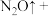 _______
_______
(2)向200mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。

①原NaOH溶液的浓度为
②所得溶液的溶质成分为
(3)已知:
 ,该反应中被1molNa2O2氧化的FeSO4为
,该反应中被1molNa2O2氧化的FeSO4为
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S=K2S+2NO2↑+CO2↑,其中被还原的元素是___________ ,还原剂是___________ 。
(2)已知铜在常温下能被稀HNO3溶解,反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
①请将上述反应改写成离子方程式:___________ 。
②氧化剂是___________ 。
③用单线桥法标出该反应的电子转移情况:___________ 。
④在参加反应的硝酸中,起氧化作用的HNO3与起酸性作用的HNO3的分子个数之比为___________ 。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S=K2S+2NO2↑+CO2↑,其中被还原的元素是
(2)已知铜在常温下能被稀HNO3溶解,反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
①请将上述反应改写成离子方程式:
②氧化剂是
③用单线桥法标出该反应的电子转移情况:
④在参加反应的硝酸中,起氧化作用的HNO3与起酸性作用的HNO3的分子个数之比为
您最近一年使用:0次
2023-11-01更新
|
146次组卷
|
2卷引用:江西省吉安市井冈山市宁冈中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
7 . 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入 、
、 的混合气体和1 mol空气,此时活塞的位置如图所AB示。
的混合气体和1 mol空气,此时活塞的位置如图所AB示。
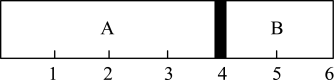
(1)A室混合气体的物质的量为_______ ,所含分子总数为_______ 。
(2)若将 、
、 的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来
的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来 、
、 的体积之比可能为
的体积之比可能为_______ 。
(3)若实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的_______ 倍。将A室 、
、 的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在
的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在_______ 刻度,容器内气体压强与反应前气体压强之比为_______ 。
 、
、 的混合气体和1 mol空气,此时活塞的位置如图所AB示。
的混合气体和1 mol空气,此时活塞的位置如图所AB示。
(1)A室混合气体的物质的量为
(2)若将
 、
、 的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来
的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来 、
、 的体积之比可能为
的体积之比可能为(3)若实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的
 、
、 的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在
的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在
您最近一年使用:0次
2023-10-15更新
|
587次组卷
|
3卷引用:江西省宜春市高安市灰埠中学2023-2024学年高一上学期11月期中化学试题
名校
解题方法
8 . 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:_______ 。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a的数值:
2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a的数值:_______ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:_______ 。
(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2(g)+3H2(g)
 2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a的数值:
2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a的数值:| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:
您最近一年使用:0次
名校
9 . 某干燥白色固体可能含有 ,
, 、
、 中的几种,取一定质量的该固体加蒸馏水配制
中的几种,取一定质量的该固体加蒸馏水配制 溶液,并向该溶液中滴加
溶液,并向该溶液中滴加 的盐酸,得到
的盐酸,得到 体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
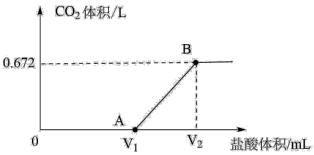
(1)产生的 的物质的量为
的物质的量为_______  ,AB段发生反应的化学方程式为
,AB段发生反应的化学方程式为_______ 。
(2)若白色固体由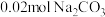 和
和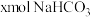 组成,则x=
组成,则x=_______ ,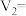
_______ 。
(3)若白色固体由 和
和 组成,
组成,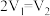 ,则
,则 与
与 溶于水后发生反应的离子方程式为
溶于水后发生反应的离子方程式为_______ ,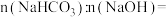
_______ 。
(4)若白色固体只由 和
和 组成,且
组成,且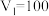 ,
,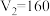 ,则
,则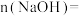
_______  。
。
 ,
, 、
、 中的几种,取一定质量的该固体加蒸馏水配制
中的几种,取一定质量的该固体加蒸馏水配制 溶液,并向该溶液中滴加
溶液,并向该溶液中滴加 的盐酸,得到
的盐酸,得到 体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
(1)产生的
 的物质的量为
的物质的量为 ,AB段发生反应的化学方程式为
,AB段发生反应的化学方程式为(2)若白色固体由
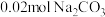 和
和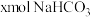 组成,则x=
组成,则x=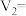
(3)若白色固体由
 和
和 组成,
组成,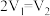 ,则
,则 与
与 溶于水后发生反应的离子方程式为
溶于水后发生反应的离子方程式为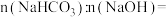
(4)若白色固体只由
 和
和 组成,且
组成,且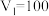 ,
,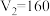 ,则
,则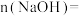
 。
。
您最近一年使用:0次
2023-02-18更新
|
442次组卷
|
3卷引用:江西省宜丰中学2023-2024学年高一上学期11月期中化学试题
10 . 根据要求回答下列问题。
(1)在标准状况下,①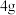
 ②
②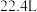
 ③
③
 中,含原子数最多的是
中,含原子数最多的是_______ (填序号),体积最小的是_______ (填序号)。
(2)现有由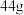
 和
和
 组成的混合气体,该混合气体中的
组成的混合气体,该混合气体中的 和
和 物质的量之比为
物质的量之比为_______ ,该混合气体的平均摩尔质量为_______ (保留一位小数)。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打受热分解的化学方程式:_______ 。
(4)84消毒液(主要成分是 )和洁厕灵(主要成分是
)和洁厕灵(主要成分是 )同时使用时生成有毒气体,用离子方程式表示该反应
)同时使用时生成有毒气体,用离子方程式表示该反应_______ 。
(5)某溶液中有 、
、 、
、 、
、 等离子,向其中加入足量的
等离子,向其中加入足量的 后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______。
后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______。
(1)在标准状况下,①
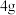
 ②
②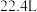
 ③
③
 中,含原子数最多的是
中,含原子数最多的是(2)现有由
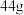
 和
和
 组成的混合气体,该混合气体中的
组成的混合气体,该混合气体中的 和
和 物质的量之比为
物质的量之比为(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打受热分解的化学方程式:
(4)84消毒液(主要成分是
 )和洁厕灵(主要成分是
)和洁厕灵(主要成分是 )同时使用时生成有毒气体,用离子方程式表示该反应
)同时使用时生成有毒气体,用离子方程式表示该反应(5)某溶液中有
 、
、 、
、 、
、 等离子,向其中加入足量的
等离子,向其中加入足量的 后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______。
后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______。A. | B. | C. 和 和 | D. |
您最近一年使用:0次



