名校
解题方法
1 . 用 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:
①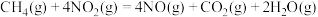

②

下列说法错误的是
 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:①
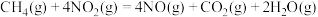

②


下列说法错误的是
| A.反应①②中,相同物质的量的甲烷发生反应,转移的电子数相同。 |
B.若用标准状况下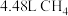 还原 还原 生成 生成 、 、 和 和 ,则放出的热量为 ,则放出的热量为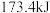 。 。 |
C.由反应①可知:  。 。 |
D.已知 的燃烧热为 的燃烧热为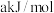 ,由 ,由 组成的混合物 组成的混合物 ,完全燃烧并恢复到常温时放出的热量为 ,完全燃烧并恢复到常温时放出的热量为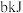 ,则 ,则 的燃烧热为 的燃烧热为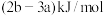 。 。 |
您最近一年使用:0次
7日内更新
|
103次组卷
|
4卷引用:江西省丰城中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
2 . 科学家利用氧化锆锌作催化剂,在一定温度下将 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇 ,其原理为:
,其原理为:
 (即正反应为放热反应)。在容积为
(即正反应为放热反应)。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题:
_____ 。
(2)0- 内,
内, 的反应速率为
的反应速率为_______ 。
(3)下列叙述正确的是_______ (填序号)。
a. 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率
b.由 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态
c.当 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态
d.当 的体积分数不再变化,可判断该反应达到平衡状态
的体积分数不再变化,可判断该反应达到平衡状态
(4)该温度下达到平衡时,混合气体中 的体积分数为
的体积分数为________ ,此时体系压强与开始时的压强之比为_____ 。
(5)其他条件不变时,下列措施不能使生成 的反应速率增大的是
的反应速率增大的是_______ (填序号)。
a.增大 的浓度 b.将容器的容积变为
的浓度 b.将容器的容积变为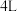
c.恒容条件下充入一定量 d.将恒温恒容容器改为绝热恒容容器
d.将恒温恒容容器改为绝热恒容容器
(6)已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量____ (填“增大”“减小”或“不变”)。
(7) 燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。
燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。____ 。
 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇 ,其原理为:
,其原理为:
 (即正反应为放热反应)。在容积为
(即正反应为放热反应)。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题: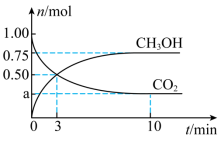

(2)0-
 内,
内, 的反应速率为
的反应速率为(3)下列叙述正确的是
a.
 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率b.由
 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态c.当
 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态d.当
 的体积分数不再变化,可判断该反应达到平衡状态
的体积分数不再变化,可判断该反应达到平衡状态(4)该温度下达到平衡时,混合气体中
 的体积分数为
的体积分数为(5)其他条件不变时,下列措施不能使生成
 的反应速率增大的是
的反应速率增大的是a.增大
 的浓度 b.将容器的容积变为
的浓度 b.将容器的容积变为
c.恒容条件下充入一定量
 d.将恒温恒容容器改为绝热恒容容器
d.将恒温恒容容器改为绝热恒容容器(6)已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量
(7)
 燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。
燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。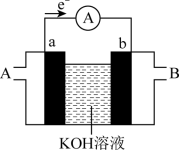
您最近一年使用:0次
3 . 根据所学知识填空
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:___________ 。
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
(3)向1mol KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀的物质的量最大时的离子方程式___________
(4)现有以下四种物质:
请根据题意选择恰当的选项用字母代号填空。
①可与KSCN溶液反应,溶液变红的是___________ ;
②常用于焙制糕点,也可用作抗酸药的是___________ ;
③可用于制备硅胶和木材防火剂的是___________ ;
④可用于制造计算机芯片的是___________ 。
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
| A.黄绿色 | B.洋红色 | C.紫红色 | D.绿色 |
(4)现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
①可与KSCN溶液反应,溶液变红的是
②常用于焙制糕点,也可用作抗酸药的是
③可用于制备硅胶和木材防火剂的是
④可用于制造计算机芯片的是
您最近一年使用:0次
解题方法
4 . “液态阳光”,即“清洁甲醇”,指生产过程中碳排放量极低或为零时制得的甲醇。CO2加氢的实际化学过程包括下面三个主要的平衡反应:
反应1:
反应2:
反应3:
(1)已知反应3的反应体系能量变化如图所示,下列说法正确的是______(填标号)。
(2)恒容绝热密闭容器中进行反应2,下列说法表明反应达到了平衡的是____(填标号)。
(3)相关化学键的键能(常温常压下,断裂或形成1mol化学键需要吸收或放出的能量)数据如表所示:
反应1中,每生成1mol CH3OH(g),会_____ (填“吸收”或“放出”)___ kJ能量。
(4)一定条件下,向2L恒温密闭容器中加入1mol CO2 和3mol H2发生反应1,测得 和
和 的物质的量随时间的变化情况如下表:
的物质的量随时间的变化情况如下表:
①a=_____ , 内,
内,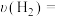
_____ 。
②12 min末时,混合气体中CH3OH的物质的量分数为_______ 。已知:B的物质的量分数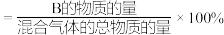 。
。
③第3 min时
____ 第9 min时 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
反应1:

反应2:

反应3:

(1)已知反应3的反应体系能量变化如图所示,下列说法正确的是______(填标号)。
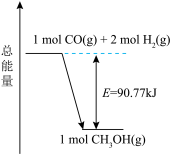
| A.该反应涉及极性键和非极性键的断裂和形成 |
B.若反应生成的 为液态,则放出的能量大于90.77kJ 为液态,则放出的能量大于90.77kJ |
C.1mol CO(g)和2mol  (g)的总键能低于1mol (g)的总键能低于1mol  (g)的总键能 (g)的总键能 |
D.1mol CO(g)和2mol  (g)在容器中充分反应,放出的能量为90.77kJ (g)在容器中充分反应,放出的能量为90.77kJ |
(2)恒容绝热密闭容器中进行反应2,下列说法表明反应达到了平衡的是____(填标号)。
| A.体系压强不再发生变化 | B. 的转化率不再变化 的转化率不再变化 |
| C.混合气体的密度不再发生变化 | D.每断裂n mol的H—H键时,形成2n mol H—O键 |
(3)相关化学键的键能(常温常压下,断裂或形成1mol化学键需要吸收或放出的能量)数据如表所示:
| 化学键 | C=O( ) ) | H—H | C—H | C—O | H—O |
键能E/( ) ) | 803 | 436 | 414 | 326 | 464 |
(4)一定条件下,向2L恒温密闭容器中加入1mol CO2 和3mol H2发生反应1,测得
 和
和 的物质的量随时间的变化情况如下表:
的物质的量随时间的变化情况如下表:| 时间 |  |  |  | 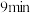 | 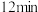 |
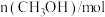 | 0 | 0.50 | a | 0.75 | 0.75 |
 | 1 | 0.50 | 0.35 | 0.25 | 0.25 |
 内,
内,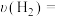
②12 min末时,混合气体中CH3OH的物质的量分数为
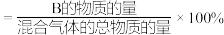 。
。③第3 min时

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
解题方法
5 . 碱式氧化镍是镍电池的正极活性材料。利用镍渣(主要含NiO,及少量 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下:
(2)浸渣的主要成分除CaSO4外还有______ 。
(3)“沉铜”过程中生成单质S的离子方程式为______ 。
(4)“氧化”中的目的是将 氧化为
氧化为 ,若试剂R选用
,若试剂R选用 ,写出“氧化”时反应的离子方程式:
,写出“氧化”时反应的离子方程式:_______ 。
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为
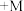 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为_______ 。
 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下: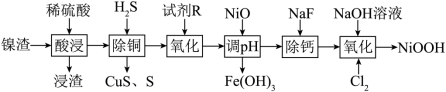
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(3)“沉铜”过程中生成单质S的离子方程式为
(4)“氧化”中的目的是将
 氧化为
氧化为 ,若试剂R选用
,若试剂R选用 ,写出“氧化”时反应的离子方程式:
,写出“氧化”时反应的离子方程式:(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为

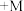 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为
您最近一年使用:0次
名校
解题方法
6 . 硫酸是在工业生产中极为重要的一种化工产品,而硫酸的浓度不同,性质也会不同。现有甲、乙两研究小组分别进行了如下实验探究:
I.甲研究小组按下图装置进行实验,验证锌与浓硫酸反应生成物中的气体成分,取足量的Zn置于b中,向a中加入适量浓硫酸,经过一段时间的反应,Zn仍有剩余。_______ 。
(2)在反应初始阶段 ,装置A中发生的化学方程式为_______ 。
(3)装置C中若为酸性高锰酸钾溶液,则对应的离子方程式 为_____ 。
(4)装置G的名称为U形管,其作用为______ 。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为______ 。
Ⅱ.乙研究小组为了利用稀硫酸制备CuSO4,进行了如下图所示的实验设计。
①2Fe3+ + Cu = 2Fe2+ + Cu2+
②∙∙∙∙∙∙
(6)反应②的离子方程式 为______ 。
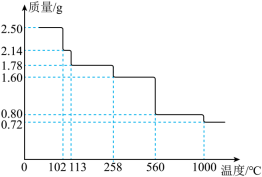
(7)取CuSO4·5H2O晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示,当达到120℃时,固体的成分为_______ 。
I.甲研究小组按下图装置进行实验,验证锌与浓硫酸反应生成物中的气体成分,取足量的Zn置于b中,向a中加入适量浓硫酸,经过一段时间的反应,Zn仍有剩余。
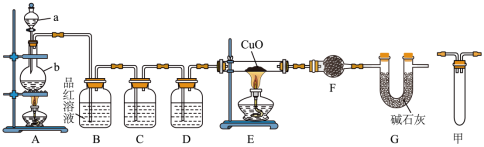
(2)在
(3)装置C中若为酸性高锰酸钾溶液,则对应的
(4)装置G的名称为U形管,其作用为
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为
Ⅱ.乙研究小组为了利用稀硫酸制备CuSO4,进行了如下图所示的实验设计。

①2Fe3+ + Cu = 2Fe2+ + Cu2+
②∙∙∙∙∙∙
(6)反应②的
(7)取CuSO4·5H2O晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示,当达到120℃时,固体的成分为
您最近一年使用:0次
名校
7 . 已知有烃分子:① ;②
;②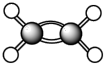 ;③
;③ ;④
;④ ;⑤
;⑤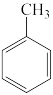 ;⑥
;⑥ 。
。
(2)写出②在一定条件下与水反应的化学方程式为:
(3)与④互为同系物的是
(4)③的二氯代物有
(5)写出⑤的分子式:
(6)乙烯能发生聚合反应,该反应产物的用途之一是
您最近一年使用:0次
解题方法
8 . I.小明在了解了电池的发现历史和自己所学的电化学知识后,萌生了自己动手做一个电池的想法,于是他邀请你和他一起进行了下面的探索。
(1)正确的科学知识是能顺利进行实验的前提,为了确保你们实验的顺利进行,先来看看你对原电池的知识是否了解清楚了。下列化学反应可以设计成原电池的是_______。
(2)了解了原电池的原理之后,需要来挑选自己制作原电池的材料,下面是你们收集到的一些用品,请挑选出可以用来制作原电池的用品填到相应的位置(导线、烧杯、电流表等仪器已有)。
铜片、锌片、塑料片、纸片、酒精、食醋、水、柠檬。
负极材料:________ ;电解质溶液:_______ 。
(3)正确选取了实验材料后,你们开始动手组装原电池,组装成的电池如下图所示,为了向其他同学介绍这款电池,需要对这款电池的原理做一个分析,下列说法正确的是______。
Ⅱ.为减少汽车尾气的污染,在新技术的支撑下新能源汽车发展迅速。肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示。_____ 。
②电池工作时,b极区域碱性_____ (填“增强”或“减弱”或“不变”)。
③当电池放电转移2mol电子时,至少消耗燃料肼_____ g。
(1)正确的科学知识是能顺利进行实验的前提,为了确保你们实验的顺利进行,先来看看你对原电池的知识是否了解清楚了。下列化学反应可以设计成原电池的是_______。
| A.CaO+H2O=Ca(OH)2 | B.NaOH+HCl=NaCl+H2O |
C.CaCO3 CaO +CO2 CaO +CO2 | D.Fe+CuCl2=FeCl2+Cu |
铜片、锌片、塑料片、纸片、酒精、食醋、水、柠檬。
负极材料:
(3)正确选取了实验材料后,你们开始动手组装原电池,组装成的电池如下图所示,为了向其他同学介绍这款电池,需要对这款电池的原理做一个分析,下列说法正确的是______。
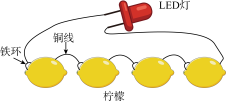
| A.铁环作负极,发生还原反应 | B.电池工作时,电子从铁环经 LED 灯流向铜线 |
| C.电池工作时,铁环变细铜线变粗 | D.电池工作结束后柠檬的酸性变强 |
Ⅱ.为减少汽车尾气的污染,在新技术的支撑下新能源汽车发展迅速。肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示。

②电池工作时,b极区域碱性
③当电池放电转移2mol电子时,至少消耗燃料肼
您最近一年使用:0次
解题方法
9 . 研究硫及其化合物的应用价值对于社会发展意义重大。请回答以下问题。
(1)下图为硫酸铜的制备和转化关系(反应条件略去):____ (选填写“强”或“弱”);
②为验证铜和浓硫酸反应生成的气体,将气体通入品红溶液,观察到的现象是_______ 。
③由上图可知,制备硫酸铜可以用途径甲(反应Ⅰ)或途径乙(反应Ⅱ+Ⅲ),从环保角度考虑,应选择途径______ (选填“甲”或“乙”),理由是_______ 。
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为______ ,装置的连接顺序为: a → _____ → e ( 按气流方向,用小写字母表示 ),碱石灰的主要作用为______ 。
(1)下图为硫酸铜的制备和转化关系(反应条件略去):
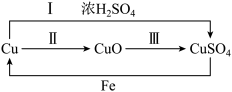
②为验证铜和浓硫酸反应生成的气体,将气体通入品红溶液,观察到的现象是
③由上图可知,制备硫酸铜可以用途径甲(反应Ⅰ)或途径乙(反应Ⅱ+Ⅲ),从环保角度考虑,应选择途径
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为
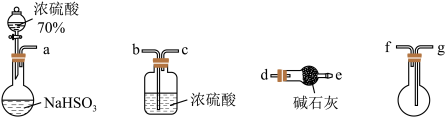
您最近一年使用:0次
10 . 对于反应C(s)+O2(g) =CO2(g) △H<0,下列措施可使反应速率增大的是
| A.恒温恒容时通入稀有气体 | B.恒温恒压下通入N2 |
| C.增加碳的量 | D.升高温度 |
您最近一年使用:0次



