1 . 现有含有 杂质的
杂质的 样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
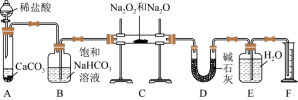
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是_____ 。
(2)装置B中饱和碳酸氢钠的作用是除去 中HCl气体,该过程涉及的离子反应方程式是
中HCl气体,该过程涉及的离子反应方程式是_____ 。
(3)写出装置C中 和
和 反应的化学方程式:
反应的化学方程式:_____ 。
(4)若无装置D,测得样品中 的质量分数
的质量分数_____ (填“偏高”“偏低”或“无影响”)。
(5)1.95g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为0.24g,则样品中 的质量分数为
的质量分数为_____ 。
(6)若除去 粉末中的
粉末中的 ,采用的简单方法为
,采用的简单方法为_____ 。
(7)若将 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有__________ (填离子符号)。
 杂质的
杂质的 样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是
(2)装置B中饱和碳酸氢钠的作用是除去
 中HCl气体,该过程涉及的离子反应方程式是
中HCl气体,该过程涉及的离子反应方程式是(3)写出装置C中
 和
和 反应的化学方程式:
反应的化学方程式:(4)若无装置D,测得样品中
 的质量分数
的质量分数(5)1.95g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为0.24g,则样品中
 的质量分数为
的质量分数为(6)若除去
 粉末中的
粉末中的 ,采用的简单方法为
,采用的简单方法为(7)若将
 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有
您最近一年使用:0次
2024-04-07更新
|
88次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 .  .为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇(CH3OH)燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
.为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇(CH3OH)燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应: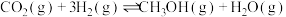 。经测得CH3OH和CO2的物质的量随时间变化如图所示。
。经测得CH3OH和CO2的物质的量随时间变化如图所示。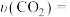
___________ 。
(2)达到平衡时,H2的浓度为___________  。
。
(3)改变条件后,化学反应速率会减小的是___________(填字母)
(4)平衡时,CO2的体积分数为___________ %。
(5)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为 ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)
 .利用如图所示原电池的装置使NH3与NO2均转化为N2,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,请回答下列问题:
.利用如图所示原电池的装置使NH3与NO2均转化为N2,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,请回答下列问题:___________ (填“A”或“B”),电极B上发生的电极反应为:___________ 。
(7)阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。为使电池持续放电,离子交换膜应为___________ 离子交换膜(填“阳”或“阴”)。
 .为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇(CH3OH)燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
.为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇(CH3OH)燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应: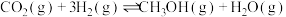 。经测得CH3OH和CO2的物质的量随时间变化如图所示。
。经测得CH3OH和CO2的物质的量随时间变化如图所示。
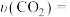
(2)达到平衡时,H2的浓度为
 。
。(3)改变条件后,化学反应速率会减小的是___________(填字母)
| A.降低温度 | B.加入催化剂 |
| C.增大容器容积 | D.恒容下充入He |
(4)平衡时,CO2的体积分数为
(5)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为
 ,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)
,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)A.反应中CO与CH3OH的物质的量之比为 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO,同时生成1molCH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
 .利用如图所示原电池的装置使NH3与NO2均转化为N2,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,请回答下列问题:
.利用如图所示原电池的装置使NH3与NO2均转化为N2,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,请回答下列问题: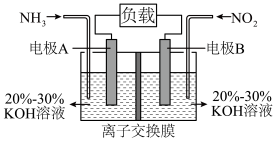
(7)阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。为使电池持续放电,离子交换膜应为
您最近一年使用:0次
名校
3 . 阅读下列短文,并回答相关问题。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个 内盛一条被
内盛一条被 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。
(1)物质①~④中,属于单质的有______ (填序号,下同),属于化合物的有______ ,属于混合物的有______ 。
(2)酒精的分子式为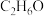 ,燃烧时的化学方程式为
,燃烧时的化学方程式为______ ,酒精中 的质量分数为
的质量分数为______ (用百分数表示,保留3位数字),已知物质碳元素含量较高时,在空气中燃烧时冒黑烟。乙醇在空气中充分燃烧时火焰为淡蓝色的原因可能是______ 。
(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作______ 有关。
(4)已知淀粉遇碘单质 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸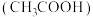 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:______ 。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个
 内盛一条被
内盛一条被 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。(1)物质①~④中,属于单质的有
(2)酒精的分子式为
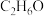 ,燃烧时的化学方程式为
,燃烧时的化学方程式为 的质量分数为
的质量分数为(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作
(4)已知淀粉遇碘单质
 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸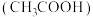 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
您最近一年使用:0次
2023-12-26更新
|
57次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
名校
4 . 综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量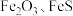 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
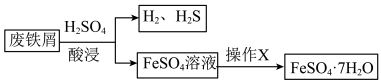
(1)酸浸过程中, 的作用是
的作用是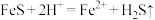 、
、 、
、___________ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
①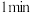 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式___________
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③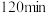 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因___________ 。
(3)已知: 受热易失水。操作X为:
受热易失水。操作X为: ___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入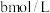 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液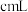 。
。
①依题意完善Ⅱ中 氧化
氧化 的离子方程式
的离子方程式________

 ___________
___________
 ___________
___________
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
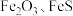 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中,
 的作用是
的作用是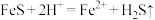 、
、 、
、(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  |  |
用 溶液检验 溶液检验 | 变红 | 未变红 | 变红 |
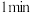 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
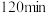 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因(3)已知:
 受热易失水。操作X为:
受热易失水。操作X为: (4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入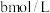 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液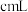 。
。①依题意完善Ⅱ中
 氧化
氧化 的离子方程式
的离子方程式
 ___________
___________
 ___________
___________②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-27更新
|
225次组卷
|
4卷引用:江西省丰城中学2023-2024学年高一下学期开学化学试题
名校
5 . 侯氏制碱法为我国纯碱工业做出了重要贡献。
I.某化学兴趣小组模拟侯氏制碱法制备 ,进一步处理得到
,进一步处理得到 和
和 ,实验流程如图:
,实验流程如图:
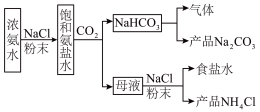
回答下列问题:
(1)生成 的总反应的化学方程式为
的总反应的化学方程式为___________ 。
II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中 的含量。
的含量。
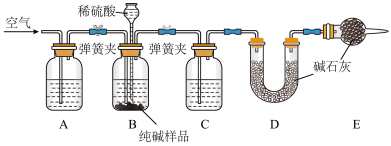
(2)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(3)实验结束后通入空气的目的:___________ 。
(4)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留2位小数)。按照以上装置及操作,有同学提出测定结果可能会偏大,他的理由是___________ 。
I.某化学兴趣小组模拟侯氏制碱法制备
 ,进一步处理得到
,进一步处理得到 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)生成
 的总反应的化学方程式为
的总反应的化学方程式为II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中
 的含量。
的含量。
(2)装置A中的试剂为
(3)实验结束后通入空气的目的:
(4)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-11-30更新
|
133次组卷
|
2卷引用:江西省清江中学2023-2024学年高一上学期11月期中化学试题
6 . 回答下列问题
Ⅰ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

(1)沉淀池中总反应的化学方程式为___________ 。
(2)产品碳酸钠中可能含有氯化钠,验证方法为___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
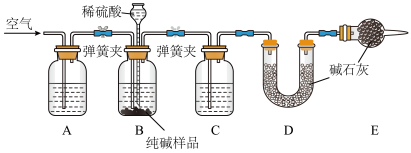
(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
(4)装置A中的试剂为___________ (填名称),装置C中的试剂为___________ (填名称)。
(5)实验结束后通入空气的目的:___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为___________ (保留小数点后一位);若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
Ⅰ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

(1)沉淀池中总反应的化学方程式为
(2)产品碳酸钠中可能含有氯化钠,验证方法为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(4)装置A中的试剂为
(5)实验结束后通入空气的目的:
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-11-04更新
|
430次组卷
|
2卷引用:江西省赣州市信丰中学2023-2024学年高一上学期11月月考化学试题
解题方法
7 . 根据化学反应与能量情景综合应用。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为___________ 。
②A在5min末的浓度___________ 。
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___________ (填序号)
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有___________ (填序号)
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C___________ mol。
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色___________ (填变深、变浅或不变,下同)。
②若维持容器内压强不变,充入Ne时,混合物的颜色___________ 。
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
根据键能数据估算上述反应中反应热数值为___________ kJ。
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为___________ 。若线路中转移2mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为___________ 。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为
②A在5min末的浓度
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色
②若维持容器内压强不变,充入Ne时,混合物的颜色
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
| 共价键 | N≡N | N-H | N≡O | H-O |
| 键能/kJ/mol | 946 | 391 | 607 | 464 |
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:已知 在低温下溶解度较小。
在低温下溶解度较小。
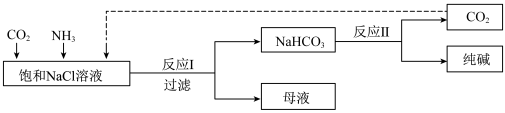
(1)一定温度下,往一定量饱和NaCl溶液中先通入___________ 达到饱和后,再不断通入另一种气体,一段时间后,出现沉淀,过滤得到 晶体。
晶体。
(2)得到的 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是___________ 。
(3) 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显___________ (填“酸性”、“中性”或“碱性”)。写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 的含量。
的含量。
(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
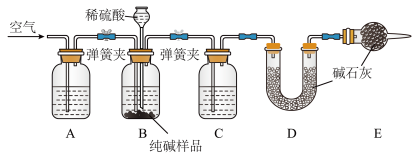
(5)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留小数点后一位):若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
 在低温下溶解度较小。
在低温下溶解度较小。
(1)一定温度下,往一定量饱和NaCl溶液中先通入
 晶体。
晶体。(2)得到的
 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(3)
 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显 的离子方程式
的离子方程式Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中
 的含量。
的含量。(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若

(5)装置A中的试剂为
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-03更新
|
79次组卷
|
2卷引用:江西省抚州市资溪县第一中学2023-2024学年高一上学期11月期中考试化学试题
9 . 四种有机物M、N、P、Q是生活中常见的有机物,M、N属于烃类物质,P、Q都是烃的衍生物。M是含氢质量分数最大的有机物,分子结构为正四面体;N分子是平面型分子,是衡量一个国家石油化工产业的重要标志;P的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应;Q是厨房中一种常用调味品的主要成分,向该物质的水溶液中滴加紫色石蕊溶液,溶液变红色。请回答下列问题:
(1)M的电子式是___________ ,Q中官能团的名称是___________ 。
(2)N物质发生加聚反应的化学方程式为___________ 。
(3)已知P可以发生如图转化过程制备乳酸:
N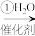 P
P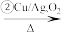 CH3CHO
CH3CHO

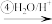
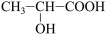
写出过程②的化学方程式___________ ,③的反应类型是___________ 。
(4)葡萄糖、纤维素、油脂、蛋白质均为人体必需的营养素,回答下列问题:
①可测定血液或尿液中葡萄糖的含量来判断糖尿病患者的病情,葡萄糖的结构简式为___________ 。
②抗击新冠肺炎过程中有专家建议适当摄入蛋白质和维生素以增强免疫能力。精面粉、鲜鸡蛋、精炼植物油、柠檬汁中,富含蛋白质的是___________ ,富含维生素的是___________ 。
(1)M的电子式是
(2)N物质发生加聚反应的化学方程式为
(3)已知P可以发生如图转化过程制备乳酸:
N
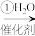 P
P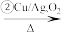 CH3CHO
CH3CHO

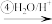
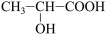
写出过程②的化学方程式
(4)葡萄糖、纤维素、油脂、蛋白质均为人体必需的营养素,回答下列问题:
①可测定血液或尿液中葡萄糖的含量来判断糖尿病患者的病情,葡萄糖的结构简式为
②抗击新冠肺炎过程中有专家建议适当摄入蛋白质和维生素以增强免疫能力。精面粉、鲜鸡蛋、精炼植物油、柠檬汁中,富含蛋白质的是
您最近一年使用:0次
10 . 氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。“84”消毒液说明书如图,请回答下列问题:
(1)漂白粉的主要成分为___________ (填化学式,下同),有效成分为___________ 。工业上用石灰乳和氯气制备漂白粉,写出反应的化学方程式:___________ 。
(2)洁厕剂的主要成分为稀盐酸,用化学方程式解释注意事项中不可与洁厕剂混合使用的原因:___________ 。
(3) 可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为
可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为________ (填标号)。
A.增强漂白能力和消毒作用
B.将 转化为较稳定的物质,便于保存和运输
转化为较稳定的物质,便于保存和运输
C.提高氯的质量分数,有利于漂白、消毒
(4)某小组在实验室制备“84”消毒液,并进行性质探究。
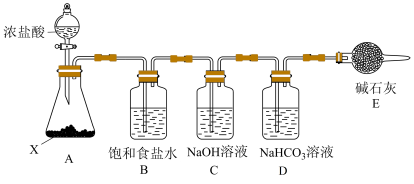
①装置E盛放碱石灰的仪器的名称是___________ ,装置E的作用是___________ 。
②若撤去装置B,则可能产生的后果是___________ 。
③装置C中发生制备消毒液的反应,写出反应的离子方程式:___________ 。
| “84”消毒液说明书 | 药品名称 | “84”消毒液 |
| 主要成分 | NaClO,有效氯含量为 | |
| 注意事项 | 不可与洁厕剂或其他消毒液混合使用 | |
| 用法用量 | 稀释后洗刷白色衣物、浴缸等(1:200水溶液),餐饮具、瓜果等(1:100水溶液) |
(1)漂白粉的主要成分为
(2)洁厕剂的主要成分为稀盐酸,用化学方程式解释注意事项中不可与洁厕剂混合使用的原因:
(3)
 可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为
可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为A.增强漂白能力和消毒作用
B.将
 转化为较稳定的物质,便于保存和运输
转化为较稳定的物质,便于保存和运输C.提高氯的质量分数,有利于漂白、消毒
(4)某小组在实验室制备“84”消毒液,并进行性质探究。

①装置E盛放碱石灰的仪器的名称是
②若撤去装置B,则可能产生的后果是
③装置C中发生制备消毒液的反应,写出反应的离子方程式:
您最近一年使用:0次
2023-12-07更新
|
125次组卷
|
2卷引用:江西省赣州市十八县市2023-2024学年高一上学期期中考试化学试题



