名校
解题方法
1 . 过二硫酸钾( )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
Ⅰ. 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。______ (填“a”或“b”)极,b极的电极反应式为______________________ 。
(2)下列关于a,b极的电极材料合理的是________ (填标号)。
Ⅱ.制备过二硫酸钾( )。
)。
往 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。
(3)制备 的化学方程式为
的化学方程式为_____________________ 。
Ⅲ.产品提纯。
在450mL 0.5 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。
(4)现用KOH固体配制上述KOH水溶液,需称量_________ g KOH固体,所需仪器如图所示,其中不需要的仪器是________________ (填标号),还缺少的仪器为_______________________ (写仪器名称)。 (
(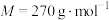 )含量测定。
)含量测定。
取a g样品全部溶解在烧杯中,加入20.00mL 0.1
 溶液,恰好完全反应。
溶液,恰好完全反应。
(5)反应生成 写出该反应的离子方程式:
写出该反应的离子方程式:________________ 。
(6)此样品中 的质量分数为
的质量分数为________________ 。
 )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:Ⅰ.
 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。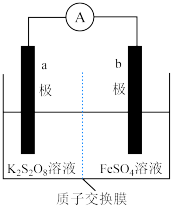
(2)下列关于a,b极的电极材料合理的是
选项 | a极 | b极 |
A | Pt | Pt |
B | 石墨 | 石墨 |
C | 石墨 | Zn |
D | Al | Cu |
Ⅱ.制备过二硫酸钾(
 )。
)。往
 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。(3)制备
 的化学方程式为
的化学方程式为Ⅲ.产品提纯。
在450mL 0.5
 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。(4)现用KOH固体配制上述KOH水溶液,需称量

 (
(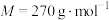 )含量测定。
)含量测定。取a g样品全部溶解在烧杯中,加入20.00mL 0.1

 溶液,恰好完全反应。
溶液,恰好完全反应。(5)反应生成
 写出该反应的离子方程式:
写出该反应的离子方程式:(6)此样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 回答下列问题
Ⅰ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

(1)沉淀池中总反应的化学方程式为___________ 。
(2)产品碳酸钠中可能含有氯化钠,验证方法为___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
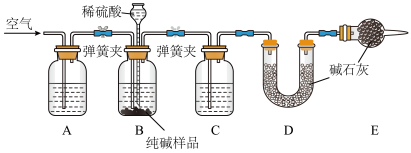
(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
(4)装置A中的试剂为___________ (填名称),装置C中的试剂为___________ (填名称)。
(5)实验结束后通入空气的目的:___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为___________ (保留小数点后一位);若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
Ⅰ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

(1)沉淀池中总反应的化学方程式为
(2)产品碳酸钠中可能含有氯化钠,验证方法为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(4)装置A中的试剂为
(5)实验结束后通入空气的目的:
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-11-04更新
|
430次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年高一上学期11月期中考试化学试题
3 . I.下表是某儿童在医院临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童___________ (填元素符号)元素含量偏低,如果以医学中惯用单位“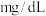 ”来表示,该元素的含量是
”来表示,该元素的含量是___________ 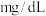 (结果保留两位小数。已知:
(结果保留两位小数。已知: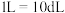 )。
)。
(2)硫酸亚铁颗粒是一种补铁剂,临床建议与维生素C同服,有利于Fe2+的吸收,原因是_____ 。
II.某实验小组欲测定某硫酸亚铁颗粒中铁元素的质量分数,实验过程如下:
①称取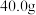 硫酸亚铁颗粒,溶于水配成
硫酸亚铁颗粒,溶于水配成 待测液;
待测液;
②配制 的酸性
的酸性 溶液;
溶液;
③取待测液 ,用酸性
,用酸性 溶液氧化(
溶液氧化( 被还原为
被还原为 )。该测定实验共进行了3次,消耗的酸性
)。该测定实验共进行了3次,消耗的酸性 溶液的体积平均为
溶液的体积平均为 。
。
(3)上述实验中常用于酸化 溶液的酸是
溶液的酸是___________ 。
(4)由 固体配制
固体配制 酸性
酸性 溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、
溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、___________ (填两种仪器的名称)。
(5)以下操作会导致所配溶液浓度偏低的有___________ 。
a.容量瓶洗净后未干燥,内有少量蒸馏水
b.未洗涤烧杯和玻璃棒
c.定容时俯视刻度线
d.定容摇匀后发现溶液体积低于刻度线,直接转移至试剂瓶中
(6)假设实验中杂质不参与反应且损耗不计,该硫酸亚铁颗粒中铁元素的质量分数为___________ (保留三位有效数字)。
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌 | 115.92 |  |  |
| 2 | 铁 | 6.95 | 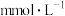 |  |
| 3 | 钙 | 1.78 | 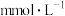 |  |
(1)该儿童
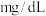 ”来表示,该元素的含量是
”来表示,该元素的含量是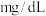 (结果保留两位小数。已知:
(结果保留两位小数。已知: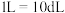 )。
)。(2)硫酸亚铁颗粒是一种补铁剂,临床建议与维生素C同服,有利于Fe2+的吸收,原因是
II.某实验小组欲测定某硫酸亚铁颗粒中铁元素的质量分数,实验过程如下:
①称取
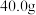 硫酸亚铁颗粒,溶于水配成
硫酸亚铁颗粒,溶于水配成 待测液;
待测液;②配制
 的酸性
的酸性 溶液;
溶液;③取待测液
 ,用酸性
,用酸性 溶液氧化(
溶液氧化( 被还原为
被还原为 )。该测定实验共进行了3次,消耗的酸性
)。该测定实验共进行了3次,消耗的酸性 溶液的体积平均为
溶液的体积平均为 。
。(3)上述实验中常用于酸化
 溶液的酸是
溶液的酸是(4)由
 固体配制
固体配制 酸性
酸性 溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、
溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、(5)以下操作会导致所配溶液浓度偏低的有
a.容量瓶洗净后未干燥,内有少量蒸馏水
b.未洗涤烧杯和玻璃棒
c.定容时俯视刻度线
d.定容摇匀后发现溶液体积低于刻度线,直接转移至试剂瓶中
(6)假设实验中杂质不参与反应且损耗不计,该硫酸亚铁颗粒中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 某化学小组同学利用二氧化锰和浓盐酸制备氯气,再用氯气制备高锰酸钾、次氯酸钠和氯水。
已知:锰酸钾为墨绿色晶体,其水溶液呈深绿色,可以与酸和氯气反应,发生反应的离子方程式分别为: 、
、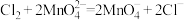 。
。
Ⅰ.制备氯气
该小组同学设计了如下气体发生装置。

(1)装置A中生成氯气的离子方程式为___________ 。
(2)装置A在放入药品前需检查气密性,其方法是___________ 。
(3)装置B的特点是___________ (填字母序号)。
a.可以随时添加浓盐酸
b.可以控制反应的开始和结束
c.与装置A相比,产生的气流更稳定
Ⅱ.制备高锰酸钾、次氯酸钠和氯水
该小组同学利用装置B~F完成实验。

(4)若装置C、D互换位置,装置D中可观察到的现象是___________ 。
(5)次氯酸钠高于35℃容易分解,制备次氯酸钠强碱性溶液时需注意的两个关键问题是___________ 。
(6)装置F中小漏斗的作用是___________ 。
Ⅲ.产品中含量测定
①称取Ⅱ中最终所得固体样品0.3500 g,用蒸馏水溶解,定容于100 mL容量瓶中,所得溶液记为溶液X。
②准确称取0.1340 g草酸钠,加蒸馏水50 mL使其溶解,再加入10 mL 3.0 mol/L 溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为:
溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为: )
)
(7)所得产品中 的质量分数为
的质量分数为___________ (结果保留三位有效数字)。
已知:锰酸钾为墨绿色晶体,其水溶液呈深绿色,可以与酸和氯气反应,发生反应的离子方程式分别为:
 、
、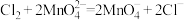 。
。Ⅰ.制备氯气
该小组同学设计了如下气体发生装置。

(1)装置A中生成氯气的离子方程式为
(2)装置A在放入药品前需检查气密性,其方法是
(3)装置B的特点是
a.可以随时添加浓盐酸
b.可以控制反应的开始和结束
c.与装置A相比,产生的气流更稳定
Ⅱ.制备高锰酸钾、次氯酸钠和氯水
该小组同学利用装置B~F完成实验。

(4)若装置C、D互换位置,装置D中可观察到的现象是
(5)次氯酸钠高于35℃容易分解,制备次氯酸钠强碱性溶液时需注意的两个关键问题是
(6)装置F中小漏斗的作用是
Ⅲ.产品中含量测定
①称取Ⅱ中最终所得固体样品0.3500 g,用蒸馏水溶解,定容于100 mL容量瓶中,所得溶液记为溶液X。
②准确称取0.1340 g草酸钠,加蒸馏水50 mL使其溶解,再加入10 mL 3.0 mol/L
 溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为:
溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为: )
)(7)所得产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 为了测定NaCl、Na2CO3⋅10H2O和NaHCO3的混合物中各组分的含量,某同学设计如下实验:取一定质量的样品,通过测量反应前后C和D装置质量的变化,测定该混合物中各组分的质量分数。

(1)E装置中的仪器名称是___________ 。
(2)实验时,B中发生反应的化学方程式有___________ 。
(3)装置C、D中盛放的试剂分别为C___________ ,D___________ 。(请从下列试剂选择:浓硫酸、碱石灰、无水氯化钙)
(4)若样品质量为wg,反应后通入一段空气,C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3质量分数为___________ %(用分数表示即可),若将A装置中的碱石灰换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将___________ (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将___________ 。

(1)E装置中的仪器名称是
(2)实验时,B中发生反应的化学方程式有
(3)装置C、D中盛放的试剂分别为C
(4)若样品质量为wg,反应后通入一段空气,C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3质量分数为
您最近一年使用:0次
解题方法
6 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石(TiO2),其是冶炼钛的重要原料。生产钛的工艺流程如图:
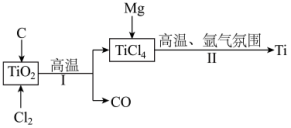
已知:
①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应Ⅰ中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应Ⅰ的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应Ⅱ中:氩气的作用是_______ 。
(3)为了测定反应Ⅱ制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应Ⅱ制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为c mol·L-1的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。

已知:
①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应Ⅰ中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应Ⅰ的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应Ⅱ中:氩气的作用是
(3)为了测定反应Ⅱ制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应Ⅱ制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为c mol·L-1的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
解题方法
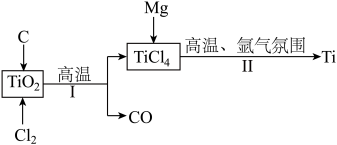
7 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石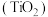 ,其是冶炼钛的重要原料。生产钛的工艺流程如图:
,其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关 的说法正确的是
的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ 。
③每转移 电子,同时生成
电子,同时生成 的体积为
的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含 )中的钛元素含量。常温下,取
)中的钛元素含量。常温下,取 反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共用去
的稀硫酸,当不再出现气泡时,共用去 稀硫酸:
稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
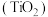 ,其是冶炼钛的重要原料。生产钛的工艺流程如图:
,其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关
 的说法正确的是
的说法正确的是A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移
 电子,同时生成
电子,同时生成 的体积为
的体积为(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含
 )中的钛元素含量。常温下,取
)中的钛元素含量。常温下,取 反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共用去
的稀硫酸,当不再出现气泡时,共用去 稀硫酸:
稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-02-03更新
|
130次组卷
|
2卷引用:湖北省十堰市2022-2023学年高一上学期期末调研考试题化学试卷
8 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)a管的作用是_____ 。
(2)在装置A中,用KMnO4与浓盐酸反应制取氯气,写出反应的离子方程式_____ 。
(3)D中装的药品是碱石灰,其作用是_____ 。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____ (只能选取一种试剂,填序号)进行检测。
①H2O2溶液 ②KI-淀粉溶液 ③KSCN溶液 ④K3[Fe(CN)6]溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取4.60g产品溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_____ %(结果精确到小数点后两位)。
(6)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_____ (填“相等”“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_____ 。
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)a管的作用是
(2)在装置A中,用KMnO4与浓盐酸反应制取氯气,写出反应的离子方程式
(3)D中装的药品是碱石灰,其作用是
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的
①H2O2溶液 ②KI-淀粉溶液 ③KSCN溶液 ④K3[Fe(CN)6]溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取4.60g产品溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为
(6)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是
您最近一年使用:0次
名校
9 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石( ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
 ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-01-11更新
|
290次组卷
|
7卷引用:湖北省襄阳市2022-2023学年高一上学期期末统考化学试题
解题方法
10 . 实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为mg的生铁粉末样品,分别进行如图实验。
I.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为_______ ,所需的玻璃仪器有_______ 。
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为_______ ,检验硫酸铁溶液中Fe3+存在的试剂是_______ 。
II.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C 4Fe+3 CO2↑
4Fe+3 CO2↑
②Fe2O3+3H2 2Fe+3H2O↑。
2Fe+3H2O↑。
如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。
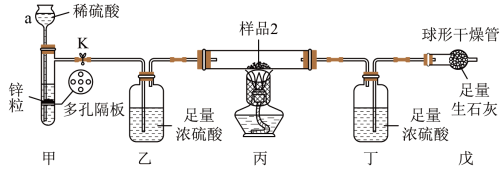
(3)仪器a的名称为_______ 。
(4)若无装置乙,会导致测得氧化铁的质量分数_______ (填“偏大”“偏小”或“不变”)。
(5)装置戊的作用为:_______ 。
(6)原样品中氧化铁的质量为_______ 。
I.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为
II.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C
 4Fe+3 CO2↑
4Fe+3 CO2↑②Fe2O3+3H2
 2Fe+3H2O↑。
2Fe+3H2O↑。如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。

(3)仪器a的名称为
(4)若无装置乙,会导致测得氧化铁的质量分数
(5)装置戊的作用为:
(6)原样品中氧化铁的质量为
您最近一年使用:0次



