名校
1 .  、
、 、
、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。
(1)已知破坏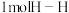 键、
键、 键、
键、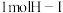 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成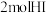 需要放出
需要放出___________ kJ的热量。
(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入氧气的电极反应式是___________ ,电池工作时如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为___________ (用 表示)。
表示)。
(3)为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上可以用
,工业上可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入
来生产燃料甲醇。在体积为2L的密闭容器中,充入 和
和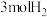 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
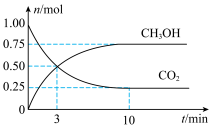
①从反应开始到平衡, 的平均反应速率
的平均反应速率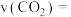
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。
(4)工业上也用CO和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
a.反应中CO与 的物质的量之比为1:1
的物质的量之比为1:1
b.混合气体的压强不随时间的变化而变化
c.单位时间内每消耗 ,同时生成
,同时生成
d. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
e.混合气体的密度保持不变
 、
、 、
、 、
、 等都是重要的能源,也是重要为化工原料。
等都是重要的能源,也是重要为化工原料。(1)已知破坏
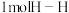 键、
键、 键、
键、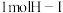 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成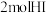 需要放出
需要放出(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入氧气的电极反应式是
 表示)。
表示)。(3)为倡导“节能减排”和“低碳经济”,降低大气中
 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上可以用
,工业上可以用 来生产燃料甲醇。在体积为2L的密闭容器中,充入
来生产燃料甲醇。在体积为2L的密闭容器中,充入 和
和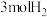 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率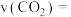
②达到平衡时,
 的转化率为
的转化率为(4)工业上也用CO和
 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是a.反应中CO与
 的物质的量之比为1:1
的物质的量之比为1:1b.混合气体的压强不随时间的变化而变化
c.单位时间内每消耗
 ,同时生成
,同时生成
d.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变e.混合气体的密度保持不变
您最近一年使用:0次
名校
2 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石( ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
 ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-01-11更新
|
290次组卷
|
7卷引用:甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题
解题方法
3 . 维生素C是人体必须的营养素,又称抗坏血酸,还具备提高免疫力的功效,体内维生素C含量高的人不容易吸收铅、镉、铬等有害元素。维生素C主要存在于新鲜蔬菜和水果中,所以提倡多吃蔬菜和水果。维生素C的化学式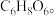 请据此计算:
请据此计算:
(1)维生素C的相对分子质量_______ 。
(2)维生素C中碳元素的质量分数_______ 。(精确到0.1)
 请据此计算:
请据此计算:(1)维生素C的相对分子质量
(2)维生素C中碳元素的质量分数
您最近一年使用:0次
解题方法
4 . 二氧化氯( ,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠(
,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠( )、泡腾剂(
)、泡腾剂( )、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时,
)、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时, 与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯:
与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯: ,同时泡腾剂(
,同时泡腾剂( )与酸反应释放
)与酸反应释放 ,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:
,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:
(1) 中Cl的化合价为
中Cl的化合价为_______ 价, 在水中的电离方程式为
在水中的电离方程式为________ 。
(2)从氧化还原角度分析, 可能具有的性质为
可能具有的性质为________ 。
(3)用上述泡腾片配制 溶液。(已知泡腾片中
溶液。(已知泡腾片中 的质量分数为45.25%)
的质量分数为45.25%)
①需要用托盘天平称取泡腾片的质量为_______ g,亚氯酸分解释放二氧化氯的过程中转移的电子数为_______  。
。
②配制溶液时,除天平(带砝码,最小砝码为1g)、镊子,还缺少的仪器是_______ (填标号)。
③下列操作使配制的 溶液浓度偏低的有
溶液浓度偏低的有________ (填标号)。
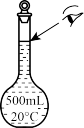
A.称量时,砝码与泡腾片放反了
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.砝码上沾有杂质
E.某同学观察液面的情况如上图所示
(4)已知“有效氯”的含量定义为从KI中氧化出相同量的 所需
所需 的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则
的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则 的“有效氯”为
的“有效氯”为_____ (保留三位有效数字)%。
 ,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠(
,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠( )、泡腾剂(
)、泡腾剂( )、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时,
)、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时, 与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯:
与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯: ,同时泡腾剂(
,同时泡腾剂( )与酸反应释放
)与酸反应释放 ,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:
,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:(1)
 中Cl的化合价为
中Cl的化合价为 在水中的电离方程式为
在水中的电离方程式为(2)从氧化还原角度分析,
 可能具有的性质为
可能具有的性质为(3)用上述泡腾片配制
 溶液。(已知泡腾片中
溶液。(已知泡腾片中 的质量分数为45.25%)
的质量分数为45.25%)①需要用托盘天平称取泡腾片的质量为
 。
。②配制溶液时,除天平(带砝码,最小砝码为1g)、镊子,还缺少的仪器是

③下列操作使配制的
 溶液浓度偏低的有
溶液浓度偏低的有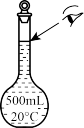
A.称量时,砝码与泡腾片放反了
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.砝码上沾有杂质
E.某同学观察液面的情况如上图所示
(4)已知“有效氯”的含量定义为从KI中氧化出相同量的
 所需
所需 的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则
的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则 的“有效氯”为
的“有效氯”为
您最近一年使用:0次
名校
解题方法
5 . 二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________ 。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓)
 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O2SO2+SeO2+2H2O
 Se+2SO42-+4H+
Se+2SO42-+4H+SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3
 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
您最近一年使用:0次
6 . (1)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之为_________________
(2)M(NO3)2热分解化学方程式为2M(NO3)2 ="=" 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是_____________________
(3)现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录。有关数据记录如下表:
试计算:①10.0g此样品中铜的物质的量______________ ②样品中氧化亚铁的质量分数_____________ ③所用硫酸溶液溶质的物质的量浓度_______________ 。
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228 g CS2在448 mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是_______________ 。
(2)M(NO3)2热分解化学方程式为2M(NO3)2 ="=" 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是
(3)现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录。有关数据记录如下表:
| 加硫酸的序号 | 加硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
试计算:①10.0g此样品中铜的物质的量
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228 g CS2在448 mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是
您最近一年使用:0次
名校
解题方法
7 . 含硫物质的价类二维图及部分物质间转化关系如图,下列说法错误的是
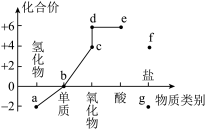
| A.工业制硫酸时将d通入水中得到浓硫酸 |
| B.b附着在试管壁上可以用热的浓NaOH溶液洗涤 |
| C.c可以使滴有酚酞的NaOH溶液褪色,适量c可做食品添加剂 |
| D.e的浓溶液长时间暴露在空气中,质量增大,质量分数减小 |
您最近一年使用:0次
8 . 实验室欲用质量分数为 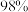 、密度为
、密度为 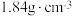 的浓硫酸配制
的浓硫酸配制  的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:
的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:
(1)正确的操作步骤为(填入序号)___________ 。选用的主要仪器有:量筒、烧杯、玻璃棒、___________ 、___________ 。
(2)应量取浓硫酸的体积约为___________ ;量取浓硫酸所用的量筒的规格是___________ (从下列选项中选用)。
A. B.
B. C.
C.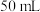 D.
D.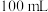
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________ 。
(4)下列情况中,所配制的稀硫酸浓度偏大的是___________ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶
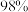 、密度为
、密度为 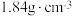 的浓硫酸配制
的浓硫酸配制  的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:
的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:(1)正确的操作步骤为(填入序号)
(2)应量取浓硫酸的体积约为
A.
 B.
B.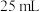 C.
C.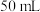 D.
D.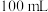
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
(4)下列情况中,所配制的稀硫酸浓度偏大的是
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶
您最近一年使用:0次
解题方法
9 . 为测定含有 杂质的
杂质的 样品的纯度,甲、乙二位同学设计了两种不同的实验方案。
样品的纯度,甲、乙二位同学设计了两种不同的实验方案。
甲同学:用如图所示装置,通过测定 与
与 反应生成
反应生成 的体积来测定样品的纯度。
的体积来测定样品的纯度。___________ 。A中橡皮管的作用是___________ 。
(2)利用该实验方案所测得的 的纯度明显偏大,其原因可能是
的纯度明显偏大,其原因可能是___________ (填字母)。
a.读数时U形量气管中的液面左高右低 b.读数时U形量气管中的液面左低右高
乙同学:称取1.560g含有少量 的
的 试样,利用下图装置测定混合物中
试样,利用下图装置测定混合物中 的质量分数(已知锥形瓶和水的总质量为190.720g),每隔相同时间读得电子天平的数据如下表:
的质量分数(已知锥形瓶和水的总质量为190.720g),每隔相同时间读得电子天平的数据如下表:
(3)写出 和
和 反应的化学方程式:
反应的化学方程式:___________ 。
(4)不必读取第6次数据的原因是___________ 。
(5)由表中数据可计算出样品中 的纯度为
的纯度为___________ 。
 杂质的
杂质的 样品的纯度,甲、乙二位同学设计了两种不同的实验方案。
样品的纯度,甲、乙二位同学设计了两种不同的实验方案。甲同学:用如图所示装置,通过测定
 与
与 反应生成
反应生成 的体积来测定样品的纯度。
的体积来测定样品的纯度。
(2)利用该实验方案所测得的
 的纯度明显偏大,其原因可能是
的纯度明显偏大,其原因可能是a.读数时U形量气管中的液面左高右低 b.读数时U形量气管中的液面左低右高
乙同学:称取1.560g含有少量
 的
的 试样,利用下图装置测定混合物中
试样,利用下图装置测定混合物中 的质量分数(已知锥形瓶和水的总质量为190.720g),每隔相同时间读得电子天平的数据如下表:
的质量分数(已知锥形瓶和水的总质量为190.720g),每隔相同时间读得电子天平的数据如下表: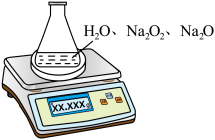
| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |
(3)写出
 和
和 反应的化学方程式:
反应的化学方程式:(4)不必读取第6次数据的原因是
(5)由表中数据可计算出样品中
 的纯度为
的纯度为
您最近一年使用:0次
名校
10 . NA代表阿伏加德罗常数的值。下列说法正确的是
| A.5.6g红热的铁丝与标况下测得的0.05mol氯气充分反应,转移的电子数目为0.3NA |
| B.将0.1mol氯气溶于足量的水中,则该氯水中的Cl—、ClO—、HClO和Cl2四种微粒的总数为0.2NA |
| C.常温常压下,5.6gCO和N2的混合气体中含有0.4NA个原子 |
| D.100g质量分数为46%的乙醇(C2H5OH)水溶液中含有的氧原子数为NA |
您最近一年使用:0次



