名校
1 . 下图转化关系中,A、B、G、Y都是主族元素组成的单质,其余均是化合物。通常条件下B、E、F、Y均为气体;A、C、H焰色反应均呈黄色;E、F相遇会产生白烟。

请按要求回答下列问题:
(1)化合物F的电子式_______________ 。
(2)G在元素周期表中位置_______________ 。
(3)以上反应既属于化合又属于氧化还原反应的有________________ (填反应编号)。
(4)E与F反应的化学方程式为________________________________________ ;
加热条件下C与D的溶液反应的离子反应方程式为_______________________ 。
(5)G与C的溶液发生反应的离子方程式为_____________________________ 。

请按要求回答下列问题:
(1)化合物F的电子式
(2)G在元素周期表中位置
(3)以上反应既属于化合又属于氧化还原反应的有
(4)E与F反应的化学方程式为
加热条件下C与D的溶液反应的离子反应方程式为
(5)G与C的溶液发生反应的离子方程式为
您最近一年使用:0次
解题方法
2 . Ⅰ.元素周期表是化学发展史上的重要里程碑之一。“价-类” 二维图有助于认识物质之间的转化,更有利于提升对元素周期表的认识。
(1)元素周期表共有________ 个周期。其中氮元素在周期表中的位置是第________ 周期,第________ 主族。
(2)在放电或高温下,空气中的N2会转化为HNO3,过程如图:________ (选填图中编号);写出③的化学方程式____________ 。
(3)检验硝酸铵溶液中铵根离子的方法为________________ 。
(4)对“N”“P”元素及其化合物相关性质进行比较,下列说法不正确 的是________。
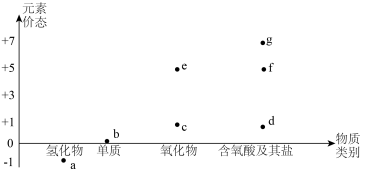
Ⅱ.下图是某元素的“价-类”二维图:________ (填写元素符号)。
Ⅲ.从元素周期表中我们可以知道元素原子的基本结构,而元素周期律的发现是化学系统化过程中的一个重要里程碑,根据元素周期律,我们可以根据元素在周期表中的位置预测其性质。
(6)元素性质呈现周期性变化的根本原因是________。
(7)放射性同位素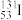 的中子数为________。
的中子数为________。
(8)下列元素中,原子半径最大的是________。
(9)下列元素的最高价氧化物对应的水化物中碱性最强的是________。
(1)元素周期表共有
(2)在放电或高温下,空气中的N2会转化为HNO3,过程如图:
(3)检验硝酸铵溶液中铵根离子的方法为
(4)对“N”“P”元素及其化合物相关性质进行比较,下列说法
| A.原子半径大小: P<N | B.原子得电子的能力: P<N |
| C.气态氢化物的热稳定性: PH3<NH3 | D.最高价氧化物对应水化物的酸性: H3PO4<HNO3 |
Ⅱ.下图是某元素的“价-类”二维图:
Ⅲ.从元素周期表中我们可以知道元素原子的基本结构,而元素周期律的发现是化学系统化过程中的一个重要里程碑,根据元素周期律,我们可以根据元素在周期表中的位置预测其性质。
(6)元素性质呈现周期性变化的根本原因是________。
| A.核外电子排布呈周期性变化 | B.元素的相对原子质量逐渐增大 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
(7)放射性同位素
 的中子数为________。
的中子数为________。| A.184 | B.131 | C.78 | D.53 |
(8)下列元素中,原子半径最大的是________。
| A.Mg | B.Al | C.Si | D.P |
(9)下列元素的最高价氧化物对应的水化物中碱性最强的是________。
| A.Al | B.Li | C.Na | D.Mg |
您最近一年使用:0次
2024-03-12更新
|
211次组卷
|
2卷引用:甘肃省会宁县第四中学2023-2024学年高一下学期第一次月考化学试卷
解题方法
3 . 元素周期表是发现新元素的强有力手段。
Ⅰ.俄罗斯科学家联合小组宣布合成出第116号元素𫟷(Lv)的一种同位素,𫟷原子的质量数是293。
(1)𫟷元素在元素周期表中的位置为______ ,钲原子的核内中子数为______ 。
(2)𫟷元素与硫元素相比,非金属性更强的是______ (填元素符号)。
Ⅱ.下图为元素周期表的一部分,列出了10种元素在元素周期表中的位置:
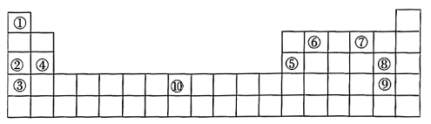
(3)②③④三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是____________ (填化学式)。
(4)⑤⑦⑧三种元素中,离子半径最小的是______ (填离子符号)。
(5)元素②和⑤的最高价氧化物对应的水化物相互反应的离子方程式为____________ 。
(6)元素⑩的单质与元素⑦的最简单氢化物在高温下反应的化学方程式为____________ 。
Ⅰ.俄罗斯科学家联合小组宣布合成出第116号元素𫟷(Lv)的一种同位素,𫟷原子的质量数是293。
(1)𫟷元素在元素周期表中的位置为
(2)𫟷元素与硫元素相比,非金属性更强的是
Ⅱ.下图为元素周期表的一部分,列出了10种元素在元素周期表中的位置:

(3)②③④三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是
(4)⑤⑦⑧三种元素中,离子半径最小的是
(5)元素②和⑤的最高价氧化物对应的水化物相互反应的离子方程式为
(6)元素⑩的单质与元素⑦的最简单氢化物在高温下反应的化学方程式为
您最近一年使用:0次
名校
4 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,下图是元素周期表的一部分,回答下列问题:
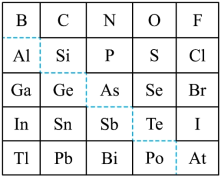
(1)元素Ga在元素周期表中的位置为:______ ;
(2)Sn的最高正价为______ ,C1的最高价氧化物对应水化物的化学式为______ ;
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是______ (写化学式),其电子式为______ 。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4______ H2SeO4(填“>”、<”、“=”或“无法比较”);
③氢化物的还原性:H2O______ H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N______ Si(填“>”、“<”、“=”或“无法比较”)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
您最近一年使用:0次
名校
5 . 元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。

(1)Ga在元素周期表中的位置为第_______ 周期_______ 族。
(2)Sn的最高正价为_______ ,Cl的最高价氧化物对应水化物的化学式为_______ ,Bi的最高价氧化物为_______ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是_______ (填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_______ H2SeO4(填“>”“<”或“=”,下同)。
③氢化物的还原性:H2O_______ H2S。
④原子半径比较:N_______ Si。
(4)可在图中分界线(虚线部分)附近寻找_______(填字母)。

(1)Ga在元素周期表中的位置为第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
(4)可在图中分界线(虚线部分)附近寻找_______(填字母)。
| A.优良的催化剂 | B.半导体材料 | C.合金材料 | D.农药 |
您最近一年使用:0次
解题方法
6 . 表中显示了元素周期表中短周期的一部分,D、E、G、Q、M、X代表6种短周期元素,请回答以下问题。

(1)E在元素周期表中的位置是_____ ,E形成的稳定氧化物的结构式为_____ 。
(2)X的最高价氧化物对应水化物的化学式是_____ ,M和X二者原子半径的关系是:X_____ M(填“>”“=”或“<”)。
(3)由DX组成的化合物属于_____ 化合物(填“离子”或“共价”)。D、M、G所形成的化合物中所含化学键的类型是_____ 。
(4)写出实验室制取X单质的化学方程式并用双线桥法标出电子转移的方向和数目______ 。该反应的氧化剂是_____ (填化学式)。

(1)E在元素周期表中的位置是
(2)X的最高价氧化物对应水化物的化学式是
(3)由DX组成的化合物属于
(4)写出实验室制取X单质的化学方程式并用双线桥法标出电子转移的方向和数目
您最近一年使用:0次
名校
7 . 随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。

(1)在A、C、F、G四种元素中,非金属性最强的元素在周期表中的位置为______ 。
(2) A、E、F三种元素的原子半径由大到小的顺序是______ (填元素符号)。
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是______ 。
(4)元素C与D按原子个数比1∶1形成的化合物,其所含的化学键有______ (填化学键类型)。
(5)下列事实能判断F和G的非金属性强弱的是______ 。
①相同温度下,氢化物的溶解度大小
②氢化物的稳定性强弱
③最高价氧化物对应的水化物的酸性强弱
(6)D、E中更容易与水反应的为______ (写化学式),请从原子结构角度解释其原因:______ 。
(7)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。50Sn在元素周期表中的位置是______ ,以下说法中正确的是______ 。
①Sn元素的最高正化合价为+4 ②Sn的原子半径比F大
③SnF2只具有氧化性

(1)在A、C、F、G四种元素中,非金属性最强的元素在周期表中的位置为
(2) A、E、F三种元素的原子半径由大到小的顺序是
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是
(4)元素C与D按原子个数比1∶1形成的化合物,其所含的化学键有
(5)下列事实能判断F和G的非金属性强弱的是
①相同温度下,氢化物的溶解度大小
②氢化物的稳定性强弱
③最高价氧化物对应的水化物的酸性强弱
(6)D、E中更容易与水反应的为
(7)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。50Sn在元素周期表中的位置是
①Sn元素的最高正化合价为+4 ②Sn的原子半径比F大
③SnF2只具有氧化性
您最近一年使用:0次
2023-02-11更新
|
269次组卷
|
2卷引用:甘肃省兰州第一中学2022-2023学年高一上学期期末考试化学试题
8 . 根据如图,已知有机物A,B,C,D,E,F有以下转化关系。A是分子量为28的气体烯烃,其产量是衡量一个国家石油化工生产水平的标志;D是食醋的主要成分,E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍,F是一种高分子化合物。结合如图关系回答问题:
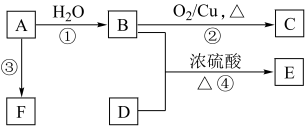
(1)写出D中官能团的名称:D____ 。
(2)写出下列反应的化学方程式:④____ ;该反应类型是____ 。F是常见的高分子材料,合成F的化学方程式是____ 。
(3)根据如图,实验室用该装置制备E,试管A中浓硫酸的作用是____ ;B中的试剂是____ ;B中导管的位置在液面上方,目的是:____ 。
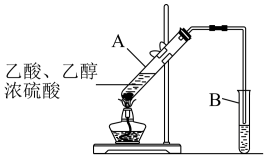
(4)根据如图,某化学课外小组设计了这样的装置(图中铁架台、铁夹、加热装置均已略去)制取E,与原装置相比,该装置的主要优点有:____ 。(至少回答两点)
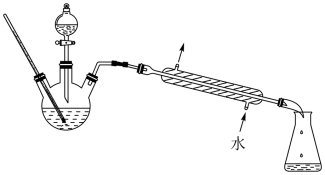

(1)写出D中官能团的名称:D
(2)写出下列反应的化学方程式:④
(3)根据如图,实验室用该装置制备E,试管A中浓硫酸的作用是

(4)根据如图,某化学课外小组设计了这样的装置(图中铁架台、铁夹、加热装置均已略去)制取E,与原装置相比,该装置的主要优点有:

您最近一年使用:0次
名校
9 . 元素周期表体现了元素“位–构–性”的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:

(1)元素Ga在元素周期表中的位置为:第__ 周期第__ 族。
(2)Sn的最高正价为__ ,S的最高价氧化物对应的水化物的化学式为__ ,Bi的最高价氧化物为___ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是___ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4__ (填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O___ (填“>”“<”或“=”)H2S。
(4)Al的最高价氧化物可以和Na的最高价氧化物的水化物反应,其反应方程式为__ 。

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
(4)Al的最高价氧化物可以和Na的最高价氧化物的水化物反应,其反应方程式为
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________ 。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________ (用离子符号表示)。
(4)化合物D2C的形成过程为______________________ (用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________ ,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________ 。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________ 。
(1)B在元素周期表中的位置为
(2)E的氧化物对应的水化物有
(3)B、C、D、E形成的简单离子半径由大到小的关系是
(4)化合物D2C的形成过程为
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
您最近一年使用:0次
2018-12-13更新
|
698次组卷
|
3卷引用:甘肃省临泽一中2018-2019学年高一下学期期末模拟化学试题



