1 . 短周期主族元素组成的中学化学常见物质,发生如图所示的转化关系(部分反应物、产物和反应条件已略去),常温下,A、E为气体单质,分别呈黄绿色、无色,C为两性氢氧化物,F为淡黄色固体,固态G可用于人工降雨,H为生活中最常见的无色无味液体。
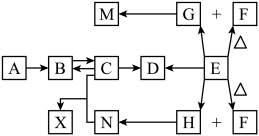
回答下列问题:
(1)组成物质A的元素,在元素周期表中的位置是_______ 。
(2)G的电子式为________ ,F中含有的化学键为______ (填“离子键”“极性键”或“非极性键”)。
(3)下列转化中属于氧化还原反应的是_______ (填标号)。
①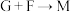 ②
②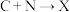 ③
③
(4)上述转化关系的方框中,属于盐类物质的有_________ (填化学式)。
(5)D和N溶液反应的化学方程式为_________ ;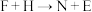 对应的离子方程式为
对应的离子方程式为_______ 。
(6)实验室中检验B溶液中阴离子的方法为_________ 。

回答下列问题:
(1)组成物质A的元素,在元素周期表中的位置是
(2)G的电子式为
(3)下列转化中属于氧化还原反应的是
①
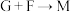 ②
②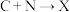 ③
③
(4)上述转化关系的方框中,属于盐类物质的有
(5)D和N溶液反应的化学方程式为
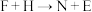 对应的离子方程式为
对应的离子方程式为(6)实验室中检验B溶液中阴离子的方法为
您最近一年使用:0次
名校
2 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
241次组卷
|
2卷引用:四川省内江市第六中学2022-2023学年高一下学期入学考试化学试题
名校
3 . 现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应生成盐,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
(1)E在元素周期表中的位置是_______ 。
(2)上述元素形成的最高价氧化物的水化物碱性最强的物质是_______ (填化学符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:
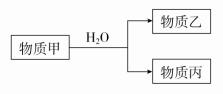
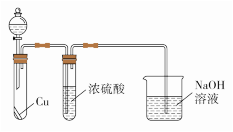
①若丙的水溶液是强碱性溶液,则甲为_______ 或_______ (填化学式)。
②若乙遇空气变为红棕色,物质丙为一种强酸,则物质甲与水反应的化学方程式为_______ 。有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确。用如上图装置进行实验时,分液漏斗中应加入_______ (填试剂名称)。实验过程中,浓硫酸中未发现有气体逸出且溶液变为红棕色,由此得出的结论是_______ 。
(4)某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如图转化关系图,图中A、B、C、D是由短周期元素组成的物质。并用于研究的性质及其变化。

请回答:若A为单质,其焰色试验为黄色,C为淡黄色固体。
①C中阴阳离子个数比为_______ 。
②下列说法正确的是_______ (填字母)。
a.A可经一步反应转化为D
b.B、C均可作呼吸面具的供氧剂
c.B、C、D均可与CO2反应
(5)若A为能使红色石蕊试纸变蓝的气体,C为红棕色气体。A与C反应生成E和水,E是空气中含量最多的气体,写出A与C发生反应的化学方程式_______ 。当生成19.6gE时,转移电子的物质的量为_______ mol。
(1)E在元素周期表中的位置是
(2)上述元素形成的最高价氧化物的水化物碱性最强的物质是
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:


①若丙的水溶液是强碱性溶液,则甲为
②若乙遇空气变为红棕色,物质丙为一种强酸,则物质甲与水反应的化学方程式为
(4)某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如图转化关系图,图中A、B、C、D是由短周期元素组成的物质。并用于研究的性质及其变化。

请回答:若A为单质,其焰色试验为黄色,C为淡黄色固体。
①C中阴阳离子个数比为
②下列说法正确的是
a.A可经一步反应转化为D
b.B、C均可作呼吸面具的供氧剂
c.B、C、D均可与CO2反应
(5)若A为能使红色石蕊试纸变蓝的气体,C为红棕色气体。A与C反应生成E和水,E是空气中含量最多的气体,写出A与C发生反应的化学方程式
您最近一年使用:0次
名校
4 . 短周期元素W、X、Y、Z、Q、R的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成,d能使品红溶液褪色,是液体,上述物质的转化关系如下图所示(个别产物略去)。请回答下列问题:
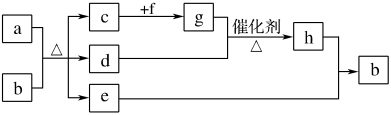
(1)R在元素周期表中的位置:_______ 。
(2)化合物f的电子式:_______ 该化合物存在的化学键种类是:_______ ;化合物c的结构式:_______ 。
(3)用电子式表示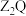 的形成过程为
的形成过程为_______ 。
(4)W、Y、Z、Q四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为_______ 、_______ ,这两种酸式盐相互反应的离子方程式为_______ 。
(5)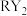 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过 和
和 在稀硫酸酸化的环境中反应制得气体
在稀硫酸酸化的环境中反应制得气体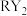 ,试写出该反应的离子反应方程式并配平:
,试写出该反应的离子反应方程式并配平:_______ 。
(6)在100mL 18mol/L b的浓溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,产生的气体在标准状况下的体积可能是_______(填序号)。

(1)R在元素周期表中的位置:
(2)化合物f的电子式:
(3)用电子式表示
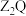 的形成过程为
的形成过程为(4)W、Y、Z、Q四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为
(5)
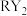 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过 和
和 在稀硫酸酸化的环境中反应制得气体
在稀硫酸酸化的环境中反应制得气体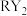 ,试写出该反应的离子反应方程式并配平:
,试写出该反应的离子反应方程式并配平:(6)在100mL 18mol/L b的浓溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,产生的气体在标准状况下的体积可能是_______(填序号)。
| A.7.32L | B.6.72L | C.20.16L | D.30.24L |
您最近一年使用:0次
名校
解题方法
5 . 元素周期表是学习和研究化学的重要工具。
(1)原子序数为 1~18 的元素在元素周期表中的位置如下表所示。
①Al原子的核电荷数为____ 。②钠离子的结构示意图为____ 。
③周期表中磷元素的有关信息为 ,图中“30.97”所表示的含义是
,图中“30.97”所表示的含义是____ 。
(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价﹣物质类别”关系图。
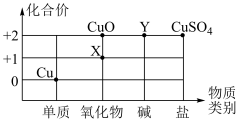
①写出物质 X 的化学式:________________ 。
②写出由物质 Y 转化为 CuSO4的化学反应方程式:_______________ 。
③氧化还原反应是化学学习中的核心概念,对氧化还原反应的定义为有化合价升降的反应,下列转化中属于氧化还原反应的是_________________ 。
A、Cu—X B、X—CuO C、CuO—Y D、Y—CuSO4
(1)原子序数为 1~18 的元素在元素周期表中的位置如下表所示。
| 第1周期 | H | He | ||||||
| 第2周期 | Li | Be | B | C | N | O | F | Ne |
| 第3周期 | Na | Mg | Al | Si | P | S | Cl | Ar |
①Al原子的核电荷数为
③周期表中磷元素的有关信息为
 ,图中“30.97”所表示的含义是
,图中“30.97”所表示的含义是(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价﹣物质类别”关系图。

①写出物质 X 的化学式:
②写出由物质 Y 转化为 CuSO4的化学反应方程式:
③氧化还原反应是化学学习中的核心概念,对氧化还原反应的定义为有化合价升降的反应,下列转化中属于氧化还原反应的是
A、Cu—X B、X—CuO C、CuO—Y D、Y—CuSO4
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E、F、G均为常见短周期元素,原子序数依次递增。已知A、B、C能分别与D 组成二元化合物K、L、M,甲、乙分别是B、D的单质,常温下分别是常见的固体和气体,化合物M是产生光化学烟雾的主要气体之一,丙是C的最高价氧化物对应的水化物,它们之间有如图所示转化关系。E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
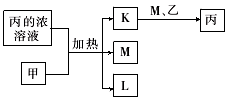
(1)C在元素周期表中的位置为_________ 。
(2)甲与丙的浓溶液反应的化学方程式_______________ 。
(3)D与E按原子个数比1:1形成化合物的电子式为________ ,其与水发生反应的化学方程式是_______________ 。
(4)E、F、G形成的简单离子,半径由大到小顺序是________ (用离子符号表示)。B、F、G元素的非金属性由强到弱的顺序__________ (用元素符号表示)。

(1)C在元素周期表中的位置为
(2)甲与丙的浓溶液反应的化学方程式
(3)D与E按原子个数比1:1形成化合物的电子式为
(4)E、F、G形成的简单离子,半径由大到小顺序是
您最近一年使用:0次
2018-07-16更新
|
244次组卷
|
5卷引用:四川省仁寿县四校联考2020-2021学年高一下学期6月月考理综化学试题
名校
7 . Ⅰ.短周期元素X、Y、Z、W、Q的原子序数依次增大,Z的原子半径是短周期主族元素中最大的,X、Y、W、Q在元素周期表中的位置如表所示,Y、Q的原子序数之和是X的4倍。回答下列问题:
(1)写出P元素简单氢化物和其最高价氧化物的水化物反应的化学方程式___________ 。
(2)葡萄酒中添加适量的某种Q的氧化物,可以起到杀菌的作用,同时利用其的___________ 性防止葡萄酒被氧化。
(3)X与Y按原子数之比为1:2形成化合物的电子式为___________ ,Y与Z形成的一种化合物是淡黄色固体,该化合物中所含化学键的类型是___________ 。
Ⅱ.汽车尾气(含碳氢化合物、CO、SO2与NO等物质)是城市空气的污染源之一、治理的方法之一是在汽车的排气管上装一个催化转化器(用Pt、Pd合金作催化剂),它的特点是使CO与NO反应,生成可参与大气循环的无毒气体,并促使汽油充分燃烧及SO2的转化。
(4)写出在催化剂的作用下CO与NO反应的化学方程式:___________ 。
(5)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是___________ 。
(6)控制城市空气污染源的方法有___________(填字母)。
| X | P | Y |
| W | Q |
(2)葡萄酒中添加适量的某种Q的氧化物,可以起到杀菌的作用,同时利用其的
(3)X与Y按原子数之比为1:2形成化合物的电子式为
Ⅱ.汽车尾气(含碳氢化合物、CO、SO2与NO等物质)是城市空气的污染源之一、治理的方法之一是在汽车的排气管上装一个催化转化器(用Pt、Pd合金作催化剂),它的特点是使CO与NO反应,生成可参与大气循环的无毒气体,并促使汽油充分燃烧及SO2的转化。
(4)写出在催化剂的作用下CO与NO反应的化学方程式:
(5)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是
(6)控制城市空气污染源的方法有___________(填字母)。
| A.植树造林 | B.开发氢能源 | C.使用电动车 | D.使用无铅汽油 |
您最近一年使用:0次
名校
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子_______ 、_______ 。
(3)有以下几种粒子: 、
、 、
、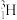 、
、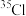 、
、 、
、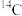 、
、 。其中含有
。其中含有_______ 种核素,互为同位素的有_______ 。由 、
、 、
、 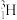 与
与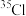 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有_______ 种。
(4)以下说法正确的是_______。
(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子
(3)有以下几种粒子:
 、
、 、
、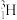 、
、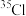 、
、 、
、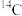 、
、 。其中含有
。其中含有 、
、 、
、 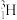 与
与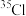 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有(4)以下说法正确的是_______。
| A.碱金属单质和卤素单质随着核电荷数的增加,熔沸点依次升高,密度依次增大 |
| B.由于F、Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI的还原性及热稳定性依次减弱 |
| C.第85号元素砹At是核电荷数最大的卤素,其单质At2可能是一种有色固体,难溶于水易溶于有机溶剂 |
| D.在新制氯水中加入少量铁粉,发生2Fe+3Cl2=2FeCl3 |
您最近一年使用:0次
名校
解题方法
9 . 镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)镓 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是_______ 。
(2) 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”)。
(3)已知 与
与 同周期,
同周期, 与N同主族。
与N同主族。
①用原子结构理论推测, 中
中 元素的化合价为
元素的化合价为_______ ;
②下列事实不能用元素周期律解释的是_______ (填标序号);
a.原子半径: b.热稳定性:
b.热稳定性: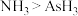
c.碱性: d.酸性:
d.酸性: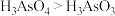
(4) 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产 的工艺如图。
的工艺如图。

①“热转化”时 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
②某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
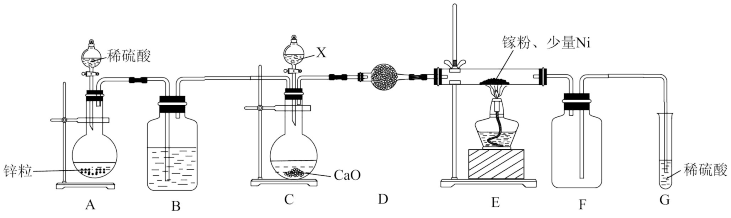
仪器X中的试剂是_______ ;加热前需先通入一段时间的 ,原因是
,原因是_______ ;装置G的作用是_______ 。
(1)镓
 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)
 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是(3)已知
 与
与 同周期,
同周期, 与N同主族。
与N同主族。①用原子结构理论推测,
 中
中 元素的化合价为
元素的化合价为②下列事实不能用元素周期律解释的是
a.原子半径:
 b.热稳定性:
b.热稳定性: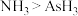
c.碱性:
 d.酸性:
d.酸性: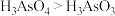
(4)
 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产 的工艺如图。
的工艺如图。
①“热转化”时
 转化为
转化为 的化学方程式是
的化学方程式是②某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:

仪器X中的试剂是
 ,原因是
,原因是
您最近一年使用:0次
名校
10 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是___________ (填化学式)。
(2)d与f能形成一种淡黄色的物质,其电子式为___________ 。
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)由a的单质制成的电池需要注意防水,其原因为___________ (用化学方程式表示)。
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为___________ 。预测g与Ga的最高价氧化物对应水化物的碱性较强的是___________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液

请选择装置丙、丁两处应该加入的药品代号:丙___________ 、丁___________ 。
(7)某实验小组向100mL 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。

从开始通入 到
到 时,溶液中
时,溶液中
___________ 。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是
(2)d与f能形成一种淡黄色的物质,其电子式为
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为
(4)由a的单质制成的电池需要注意防水,其原因为
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液
请选择装置丙、丁两处应该加入的药品代号:丙
(7)某实验小组向100mL
 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。
从开始通入
 到
到 时,溶液中
时,溶液中
您最近一年使用:0次
2024-01-15更新
|
142次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题



