解题方法
1 . A、B、C是中学化学中常见的物质,且A、B、C均含有同一种元素,在一定条件下相互转化关系如下图所示(部分产物已略去)。请回答:
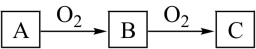
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是______ 。
② 下列说法正确的是______ (填字母)。
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式__________________ 。
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是______ 。
② 下列说法不正确的是______ (填字母)。
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为______________ (填吸热或放热)反应。
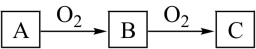
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是
② 下列说法正确的是
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是
② 下列说法不正确的是
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为
您最近一年使用:0次
2020-07-07更新
|
197次组卷
|
2卷引用:天津市河东区三校2020-2021学年高一下学期期中联考化学试题
名校
2 . Ⅰ.形式一:(由粒子数推断)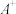 、
、 、
、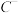 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①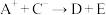 ;②
;② 。据此,回答下列问题:写出
。据此,回答下列问题:写出 、
、 的化学式:
的化学式:____ 、______ 、
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________ ,B________ ,E________
(2)F在元素周期表中的位置为___________________________________
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______
(4)元素的非金属性为(原子的得电子能力):E________ F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法__________________________________________________ (至少2条)
通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语 回答下列问题:
(1)请画出元素⑦的离子结构示意图________________ 。
(2)写出元素⑤在周期表中的位置______________ 。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________ 。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______ 。
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:____________________ 。该化合物与④的最高价氧化物反应的离子方程式为____________________ 。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________ 周期_______ 族,它属于_____ 元素(填“金属”或“非金属”)
 、
、 、
、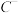 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:① ;②
;② 。据此,回答下列问题:写出
。据此,回答下列问题:写出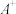 、
、 的化学式:
的化学式:Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A
(2)F在元素周期表中的位置为
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式
(4)元素的非金属性为(原子的得电子能力):E
通过Ⅱ的解题你认为推断出本题各元素的关键环节为
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用
(1)请画出元素⑦的离子结构示意图
(2)写出元素⑤在周期表中的位置
(3)②、③、⑥的离子半径由大到小的顺序为
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第
您最近一年使用:0次
名校
3 . Ⅰ.形式一:(由粒子数推断)A+、B+、C-、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++ C-→D+E;②B++C-→2D。据此,回答下列问题:写出A+、B+的化学式:____________ 、____________ 。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________ ,B________ ,E________ 。
(2)F在元素周期表中的位置为___________________________________ 。
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______ 。
(4)元素的非金属性为(原子的得电子能力):E________ F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法_________________ 、___________________ (至少2条)。
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________ 。
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语 回答下列问题:
(1)请画出元素⑦的离子结构示意图________________ 。
(2)写出元素⑤在周期表中的位置______________ 。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________ 。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______ 。
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为_________ 。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________ 周期_______ 族,它属于_____ 元素(填“金属”或“非金属”)。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A
(2)F在元素周期表中的位置为
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式
(4)元素的非金属性为(原子的得电子能力):E
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的离子结构示意图
(2)写出元素⑤在周期表中的位置
(3)②、③、⑥的离子半径由大到小的顺序为
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第
您最近一年使用:0次
名校
解题方法
4 . W、X、Y、Z、M、G、H七种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、G同主族,可形成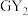 、
、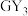 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)X的气态氢化物的电子式为_____ ,工业合成X的气态氢化物的化学方程式为______ 。
(3)Y、Z、G三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为_______ ,G的最高价氧化物对应的水化物的浓溶液与金属铜反应的化学方程式为_______ 。
(5)G的非金属性_______ (填“>”或“<”)H的非金属性,下列表述可以作为验证的证据的是_______ (填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、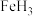
D.比较这两种元素单质与酸或碱反应的难易程度
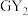 、
、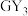 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:(1)Y在元素周期表中的位置为
(2)X的气态氢化物的电子式为
(3)Y、Z、G三种元素原子半径由大到小的顺序是
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为
(5)G的非金属性
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、
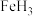
D.比较这两种元素单质与酸或碱反应的难易程度
您最近一年使用:0次
名校
解题方法
5 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
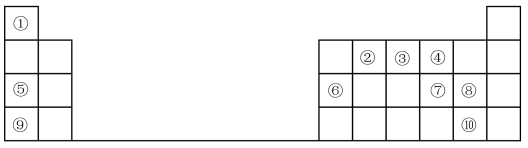
(1)元素②在周期表中的位置___________
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是___________ (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:___________ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是___________ (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:___________ 。
(6)元素的非金属性⑩___________ ⑧(填“>”或“<”);下列事实不能 证明上述结论的是___________ 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱

(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:
(6)元素的非金属性⑩
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
您最近一年使用:0次
2024-02-13更新
|
164次组卷
|
2卷引用:天津市重点校2023-2024学年高一上学期期末联考化学试题
名校
6 . 如图为元素周期表的一部分,列出了前四周期11种主族元素在周期表中的位置。

请回答下列问题:
(1)元素E的原子结构示意图为___________ ,I在元素周期表中的位置为___________ ,C与I形成的化合物的电子式为___________ 。
(2)G与J形成原子数之比为 的化合物P,P是日常生活中常见的物质,P分子的结构式为
的化合物P,P是日常生活中常见的物质,P分子的结构式为___________ ,空间构型为___________ ,P的沸点与元素K的氢化物的沸点大小关系为___________ (用化学式表示),原因是___________ 。
(3)元素D的氧化物与氢氧化钠溶液反应的离子方程式为___________ 。
(4)J、F、G、K可以形成原子个数之比为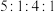 的化合物M,M的化学式为
的化合物M,M的化学式为___________ ;M中含有的化学键类型为___________ ,J、F、G、K还可以形成原子个数之比为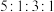 的化合物N,M与N反应的离子方程式为
的化合物N,M与N反应的离子方程式为___________ 。
(5)下列各图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是___________ 。

请回答下列问题:
(1)元素E的原子结构示意图为
(2)G与J形成原子数之比为
 的化合物P,P是日常生活中常见的物质,P分子的结构式为
的化合物P,P是日常生活中常见的物质,P分子的结构式为(3)元素D的氧化物与氢氧化钠溶液反应的离子方程式为
(4)J、F、G、K可以形成原子个数之比为
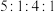 的化合物M,M的化学式为
的化合物M,M的化学式为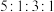 的化合物N,M与N反应的离子方程式为
的化合物N,M与N反应的离子方程式为(5)下列各图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是
 |  |  |
| A.原子半径 | B.原子最外层电子数 | C.原子序数 |
您最近一年使用:0次
7 . P、S、Cl、Br四种元素在元素周期表中的位置如图所示。下列比较关系正确的是
| P | S | Cl |
| Br |
A.原子半径: | B.热稳定性: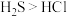 |
C.还原性: | D.酸性: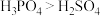 |
您最近一年使用:0次
解题方法
8 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题
(1)上述元素中,金属性最强的是_______ (填元素名称),最高价氧化物对应水化物酸性最强的是_______ (写出酸的化学式)。
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:_______ 。(用离子符号表示)
(3)由元素①和④形成的18电子的结构式为_______ ;由元素①、③、⑨形成的离子化合物的电子式为_______ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程_______ 。
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为:_______
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系_______ 。
(6)可以比较⑤、⑥两元素金属性强弱的实验是_______。
(7)元素③、磷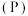 、砷
、砷 、锑
、锑 、铋
、铋 为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置_______ 。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ | |||||||
(1)上述元素中,金属性最强的是
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:
(3)由元素①和④形成的18电子的结构式为
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为:
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系
(6)可以比较⑤、⑥两元素金属性强弱的实验是_______。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
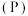 、砷
、砷 、锑
、锑 、铋
、铋 为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
您最近一年使用:0次
名校
9 . 现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内_______ 。
(2)上述元素形成的常见氢化物中,分子间存在氢键的有(填氢化物的化学式)_______ 。
(3)氢化铝锂( )是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式
)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式_______ 。写出该物质受热分解的反应方程式_______ 。
(4)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除 外,还有
外,还有 ;碳元素的氢化物除
;碳元素的氢化物除 外,还有
外,还有 等;与之相似的氮元素的氢化物除
等;与之相似的氮元素的氢化物除 外,还有
外,还有_______ (填化学式),其沸点比液氨_______ (填“高”或“低”),稳定性比氨_______ (填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为_______ 。
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最底 | 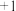 |  |  |  |  |  | 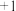 | 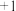 |
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内
| Ⅰ族 | Ⅱ族 | Ⅲ族 | Ⅳ族 | Ⅴ族 | Ⅵ族 | Ⅶ族 | Ⅷ族 | |
| 第一周期 | ||||||||
| 第二周期 | ||||||||
| 第三周期 |
(2)上述元素形成的常见氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)氢化铝锂(
 )是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式
)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式(4)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除
 外,还有
外,还有 ;碳元素的氢化物除
;碳元素的氢化物除 外,还有
外,还有 等;与之相似的氮元素的氢化物除
等;与之相似的氮元素的氢化物除 外,还有
外,还有
您最近一年使用:0次
名校
10 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
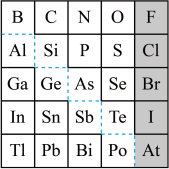
(1)元素Ga在元素周期表中的位置为:第________ 周期第________ 族。
(2)Sn的最高正价为________ ,Cl的最高价氧化物对应水化物的化学式为________ ,Bi的最高价氧化物为________ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是________ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________ (填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O________ (填“>”“<”或“=”)H2S。
④原子半径比较:N________ (填“>”“<”或“=”)Si。
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱___________________ (可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液)

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱
您最近一年使用:0次
2019-03-20更新
|
566次组卷
|
2卷引用:【全国百强校】天津市静海区第一中学2018-2019学年高一下学期3月月考化学试题2



